激素对不同种源樟树体胚发生的影响
杨 柳,李志辉,林立彬
(中南林业科技大学 林学院,湖南 长沙 410004)
体胚发生一直都是植物组织培养中的重要环节,我国虽然开展木本植物体胚发生研究较晚,但也取得了不错的成绩,研究的树种包括龙眼[1]、鹅掌楸[2]、荔枝[3]、马尾松[4]、橡胶树[5]、水曲柳[6]、麻栎[7]、杉木[8]、枇杷[9]、香榧[10]等。樟树作为“江南四大名木”,国内对于樟树体细胞胚胎发生的研究却不多,仅有杜丽[11]利用香樟未成熟合子胚初步建立了香樟体胚发生途径的植株再生体系,在此研究基础上,施雪萍[12]、陈甘明[13]对香樟体胚发生体系进行优化,完善了植株再生体系,提高了遗传转化效率。
近些年来,基因工程的快速发展,为不结实、不耐寒和被害虫危害严重的樟树提供了新的培育方法,这种方法不但可以保留樟树的优良性状,还可以创造更为丰富的性状类型,就樟树而言,目前尚未建立起高效稳定的再生体系,体细胞胚胎方面研究较少,从而在很大程度上限制了樟树改良的进程。
研究了湖南省不同种源樟树,对其体胚发生过程中的激素配比及相应表现进行了分析,旨在为湖南省不同种源樟树体胚发生建立良好的基础,完善樟树再生植株体系,同时为樟树的遗传改良和新品种培育提供参考依据。
1 材料与方法
1.1 材料与外植体处理
选择树干饱满、生长健壮、无病虫害的樟树植株为供试母体,材料于2016年7月采自湖南省长沙、岳阳、娄底、醴陵、郴州、怀化的樟树未成熟种子。
将不同种源的樟树种子在自来水下冲洗干净,置于无菌超净工作台上,用70%的酒精浸泡45 s,无菌水冲洗2次,转入0.1%升汞溶液浸泡8 min,无菌水冲洗3次。外植体按以上步骤消毒后,在无菌操作台上切开果实,取出合子胚接种于诱导樟树体胚发生的培养基上,每个处理接种30瓶,每瓶一个外植体,3次重复。
1.2 实验方法
1.2.1 不同种源樟树体胚的诱导
采用MS培养基为基本培养基,添加激素为6-BA(1、3、5 mg·L-1)、2,4-D(0.1、0.3、0.5 mg·L-1)、NAA(0.1、0.3、0.5 mg·L-1),水解酪蛋白(CH)700 mg,蔗糖30 g,琼脂粉7.5 g,pH值5.8~6.0,培养条件为暗培养。培养温度为23±2 ℃。
1.2.2 不同种源樟树芽的分化
将诱导产生的体胚培养至成熟,接种到芽分化培养基上,7 d后观察芽的诱导情况,采用MS培养基为基本培养基,添加激素为6-BA(1、3、5 mg·L-1)、2,4-D(0.1、0.3、0.5 mg·L-1)、NAA(0.1、0.3、0.5 mg·L-1),水解酪蛋白(CH)700 mg,蔗糖30 g,琼脂粉7.5 g,pH值5.8~6.0,培养条件为光照培养16 h,黑暗培养8 h,光照强度为1 000 Lx左右。培养温度为23±2 ℃。
1.2.3 不同种源樟树根的诱导
将诱导产生的芽经过进一步生长后从基部剪断,转入诱导生根培养基,20 d后观察生根率,采用MS培养基为基本培养基,添加激素为IBA(1 mg·L-1)、NAA(0、0.1、0.3、0.5 mg·L-1),水解酪蛋白(CH)700 mg,蔗糖30 g,琼脂粉7.5 g,pH值5.8~6.0,培养条件为光照培养16 h,黑暗培养8 h,光照强度为1 000 Lx左右。培养温度为23±2 ℃。
1.3 数据统计
接种后的外植体培养4周后统计各个处理的体胚诱导率,成熟体胚接种4周后统计芽的分化率,芽接种4周后统计生根率,用SPSS软件进行方差分析和多重比较,最小显著性差异水平P=0.05。
体胚诱导率=(诱导出体胚的外植体总数/接种合子胚总数)×100%;
芽的分化率=(诱导出芽的外植体总数/接种的成熟体胚总数)×100%;
植株生根率=(诱导出根的外植体总数/接种的芽总数)×100%。
2 结果与分析
2.1 不同种源樟树在不同激素组合上体胚的诱导
将幼胚接种到不同激素组合的MS培养基上进行体胚诱导,培养3~5 d,幼胚开始膨大,7~10 d观察到有两种形态的愈伤组织形成,一般分为非胚性愈伤和胚性愈伤,非胚性愈伤是灰色疏松性,胚性愈伤是白、绿色紧密型,经过后期培养,灰色疏松性少部分可诱导产生不定芽,此种非胚性愈伤组织后期产生的芽玻璃化程度严重或者直接褐化死亡,无法培育成正常植株,白、绿色紧密型的胚性愈伤组织在合适的条件下经培养可产生不定芽及再生植株。除形成愈伤组织外,培养10~15 d,子叶膨大处边缘颜色加深出现微小透明组织,经过培养可直接发育成形态各异的子叶期体胚,诱导的体胚大多聚集在一起,可能是起源于同一细胞团,外植体基部随着体胚的发生颜色逐渐加深直至褐色,诱导不定芽的过程中同时会有不定根的产生,这是体胚两极性的表现,若先产生不定根则无法观察到不定芽的产生,一定程度上不定根的先发生机制抑制了不定芽的发生(见图1)。

图1 樟树体细胞胚胎发生Fig.1 Somatic embryogenesis of Cinnamomum camphora L.
在诱导不同种源樟树体胚发生过程中,6-BA、2,4-D、NAA 3个因素均设置3个水平,6-BA为1、3、5 mg·L-1、2,4-D 和 NAA 均 为 0.1、0.3、0.5 mg·L-1。从表1可以发现,并不是每个激素质量浓度都能成功诱导出体胚,其中郴州种源樟树不能诱导产生体胚数较多,不能诱导产生体胚的原因大多是产生了非胚性愈伤组织,另外发现郴州种源樟树体胚在同样的处理下有较高污染率,体胚易死亡。长沙种源樟树合子胚污染率低,诱导率高,胚性愈伤组织呈乳白色紧密型,表面光泽度明显。不同种源樟树在不同激素组合上体胚诱导结果(表1)表明,不同种源樟树体胚诱导率随着激素质量浓度的变化而变化。大体上呈现体胚诱导率随着6-BA质量浓度的升高而下降的趋势,在 5 mg·L-1的 6-BA 与 0.3、0.5 mg·L-1的 NAA激素组合中,各种源没有观察到体胚及胚性愈伤组织发生。当6-BA质量浓度一定时,体胚诱导率大体上随着2,4-D或NAA质量浓度的升高而降低,在6-BA质量浓度为1 mg·L-1时,各种源樟树有最大体胚诱导率;当6-BA质量浓度一样时,2,4-D的体胚诱导率高于NAA。表1结果显示,适合岳阳、怀化樟树诱导体胚发生的最适培养基为MS+1 mg·L-16-BA+0.1 mg·L-12,4-D,最大体胚诱导率分别为77.8%、73.3%,郴州、醴陵、长沙、娄底樟树最适培养基均为 MS+1 mg·L-16-BA+0.3 mg·L-12,4-D,最大体胚诱导率分别为60%、64.4%、82.2%、66.7%。
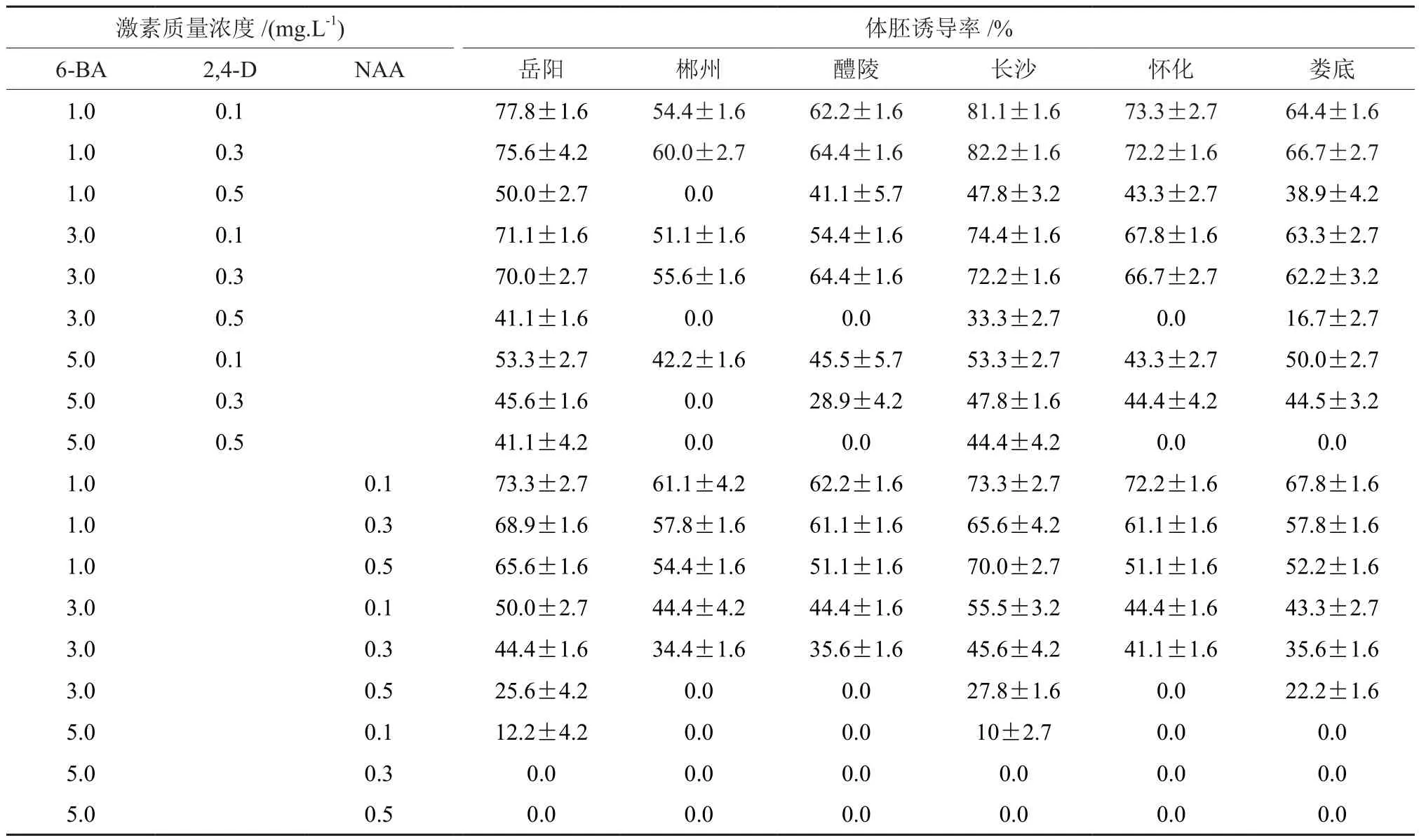
表1 激素对不同种源樟树体胚诱导的影响†Table1 The effect of hormone for somatic embryo from different provenances of Cinnamomum camphora
2.2 不同种源樟树在不同激素组合上芽的分化
将愈伤组织和成熟的体胚接种到芽诱导培养基上,经过7~10 d,在樟树体胚的基部,开始有芽抽生萌动的迹象,伴随着体胚上愈伤组织的形成,绿色的芽点也遍布在愈伤组织表层形成突起,培养4周左右,绿色芽点慢慢发育长大,形成肉眼可辨的不定芽,芽长至2~4 cm可从基部截断转至生根培养基。
不同种源樟树在不同激素质量浓度培养基上芽分化结果(见表2)显示,不同种源樟树在同一质量浓度培养基或同一种源樟树在不同质量浓度培养基上表现不同。总体来看,随着6-BA质量浓度的增加,各种源表现不一,有的种源表现为诱导率随着6-BA质量浓度的增加而增加,另一部分种源诱导率表现为先升高后降低。6-BA质量浓度一定时,NAA诱导率明显高于2,4-D,2,4-D和NAA质量浓度过高时,部分种源芽的诱导率为0。
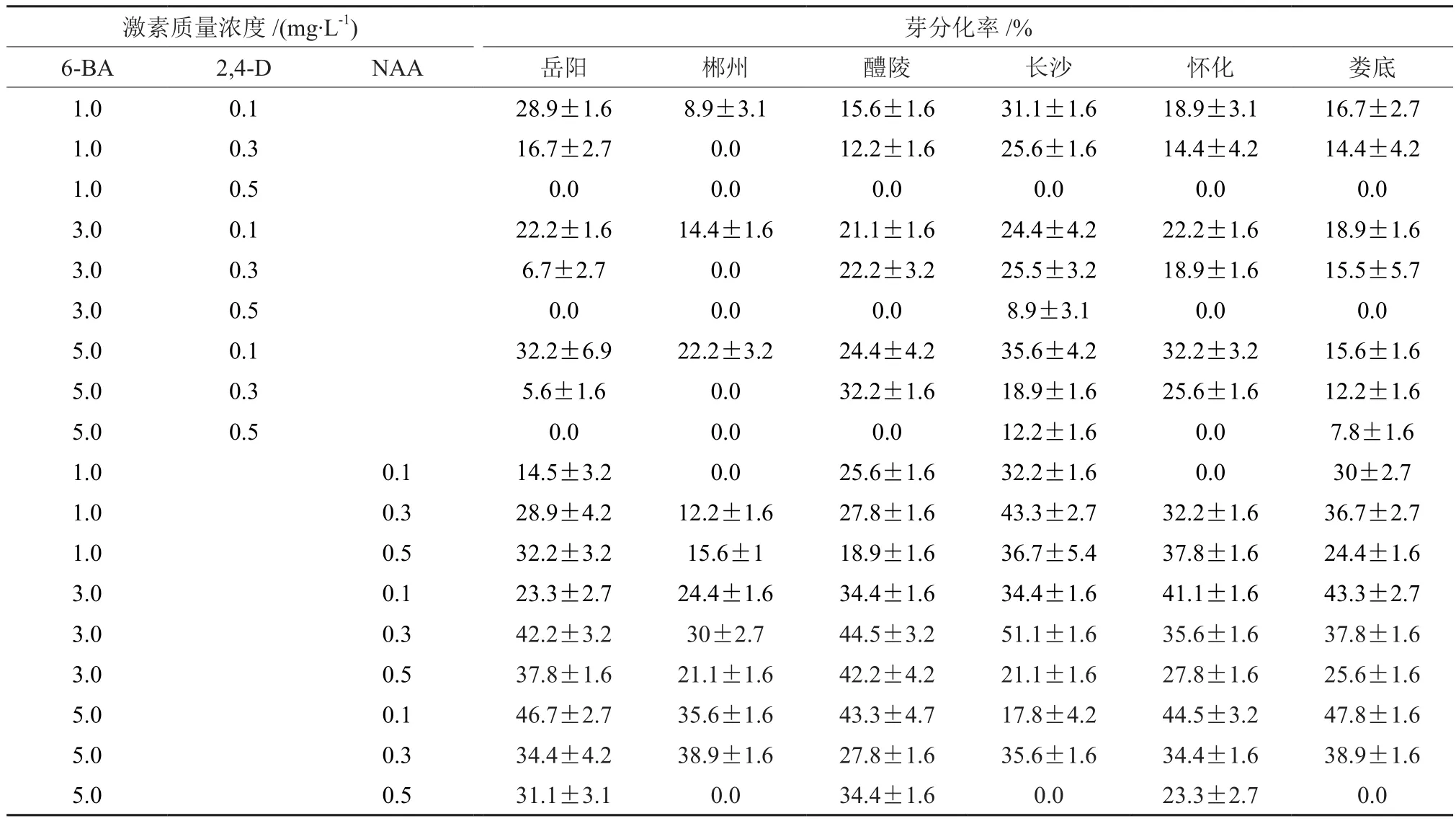
表2 激素对不同种源樟树芽分化的影响†Table2 The effect of hormone for bud from different provenances of Cinnamomum camphora
岳阳种源分化率最高为46.7%,激素组合为 5 mg·L-16-BA+0.1 mg·L-1NAA。低质量浓度(0.1 mg·L-1)的2,4-D芽的分化率好于高质量浓度(0.3 mg·L-1)的2,4-D,当 2,4-D质量浓度过高为0.5 mg·L-1时,分化率为0。分化率随着6-BA质量浓度的升高而升高,6-BA与NAA激素组合均有芽的出现,诱导结果明显好于2,4-D。
郴州种源樟树整体看来芽的诱导率较差,最高为38.9%,激素组合为5 mg/L 6-BA+0.3 mg·L-1NAA。在2,4-D质量浓度为0.3和0.5 mg·L-1时诱导率为0,低质量浓度2,4-D诱导率最高也就22.2%。整体看来,当NAA质量浓度为0.3 mg·L-1时有较高的诱导率,NAA诱导效果明显好于2,4-D对芽的诱导。
醴陵种源最高分化率44.5%是在3 mg·L-16-BA+0.3 mg·L-1NAA中诱导得到的。诱导率随着6-BA质量浓度的增加而增加,6-BA质量浓度一定时,随着2,4-D和NAA质量浓度的增加呈现先升高后下降的趋势,组合6-BA质量浓度为5 mg·L-1和NAA质量浓度为0.5 mg·L-1时例外。同样,高质量浓度的2,4-D(0.5 mg·L-1)芽的分化率为0。
长沙种源樟树整体看来芽分化率效果最好达51.1%,激素组合为 3 mg·L-16-BA+0.3 mg·L-1NAA。除了2个激素组合没有观察到芽的分化,大部分诱导效果不错,分化率明显高于其他几个种源。6-BA质量浓度一定时,分化率随着2,4-D浓度升高而下降,随着NAA质量浓度的升高为先上升后下降。
怀化种源樟树分化率与醴陵种源相同为44.5%,诱导的激素组合为 5 mg·L-16-BA+0.1 mg·L-1NAA。芽的分化率随着6-BA质量浓度的升高大致为升高的趋势,6-BA质量浓度一定时,分化率随着2,4-D和NAA质量浓度的上升而下降。低质量浓度6-BA(1 mg·L-1)和低质量浓度NAA(0.1 mg·L-1)的组合中芽的诱导率为0。
娄底种源樟树芽的分化率最高为47.8%,诱导此分化率的激素组合(5 mg·L-16-BA+0.1 mg·L-1NAA)与岳阳、怀化种源一致。分化率随着6-BA浓度的升高而升高,6-BA质量浓度一定时,随着2,4-D浓度升高而降低,6-BA为低质量浓度(1 mg·L-1)时,随着NAA质量浓度的升高表现为先升高后降低,6-BA为高质量浓度(3 mg·L-1和5 mg·L-1)时,随着NAA浓度的升高而下降。
2.3 不同种源樟树在不同激素组合上根的诱导
切割下来的芽经过进一步生长后转入生根培养基,从表3中可以看出,不同种源在不同激素组合上生根率差异显著,长沙种源有最高生根率,达到84.4%,郴州和醴陵都有最低生根率,为72.2%,总体看来,各种源在各处理下生根率均大于50%,根状态良好能发育成完整植株。得出结论如下,诱导岳阳、郴州、醴陵、长沙、怀化、娄底樟树芽生根的最适激素质量浓度分别为 1 mg·L-1IBA+0.1 mg·L-1NAA、1 mg·L-1IBA+0.5 mg·L-1NAA、1 mg·L-1IBA+0.3 mg·L-1NAA、1 mg·L-1IBA、1 mg·L-1IBA+0.1 mg·L-1NAA、1 mg·L-1IBA+0.3 mg·L-1NAA。
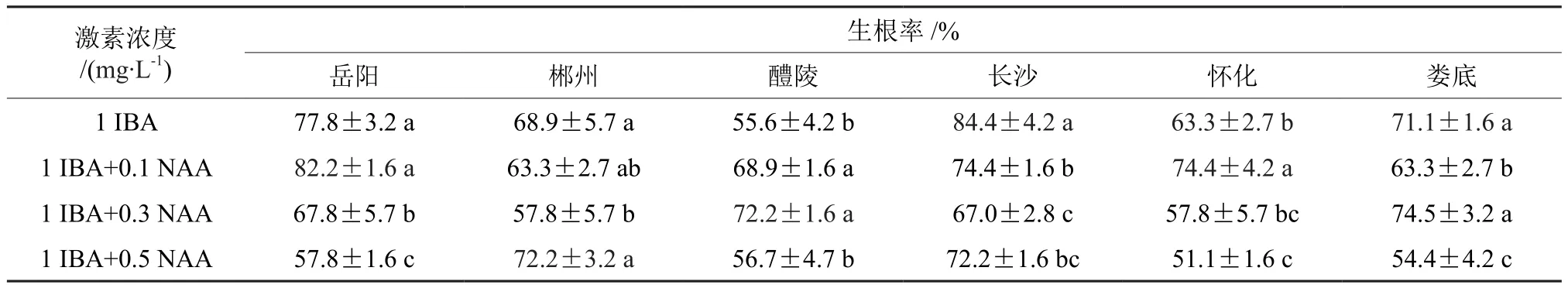
表3 激素对不同种源樟树生根的影响†Table3 The effect of hormone for root from different provenances of Cinnamomum camphora
3 结论与讨论
3.1 结 论
(1)实验结果表明,长沙、岳阳樟树为较易诱导体胚发生的种源,最高诱导率分别为82.2%、77.8%,郴州种源诱导效果最差,2,4-D较NAA诱导效果好,而低质量浓度的2,4-D诱导效果较好,适合岳阳、怀化樟树诱导体胚发生的最适培养基为 MS+1 mg·L-16-BA+0.1 mg·L-12,4-D,郴州、醴陵、长沙、娄底樟树最适培养基为MS+1 mg·L-16-BA+0.3 mg·L-12,4-D;
(2)在芽诱导试验中,NAA诱导率明显高于2,4-D,较高浓度的6-BA和较低质量浓度的NAA对芽有更高的诱导率,5 mg·L-16-BA+0.1 mg·L-1NAA激素组合适合岳阳、怀化、娄底种源樟树芽分化,醴陵和长沙种源樟树为3 mg·L-16-BA+0.3 mg·L-1NAA,郴 州种 源 为 5 mg·L-16-BA+0.3 mg·L-1NAA;
(3)不同种源在不同激素组合上生根率差异显著,各种源生根率均大于50%,诱导岳阳、郴州、醴陵、长沙、怀化、娄底樟树芽生根的最适激素质量浓度分别为 1 mg·L-1IBA+0.1 mg·L-1NAA、1 mg·L-1IBA+0.5 mg·L-1NAA、1 mg·L-1IBA+0.3 mg·L-1NAA、1 mg·L-1IBA、1 mg·L-1IBA+0.1 mg·L-1NAA、1 mg·L-1IBA+0.3 mg·L-1NAA。
3.2 讨 论
近年来,樟树组织培养取得了一定的成功,多数研究者对樟树组织培养过程中的最佳培养基进行筛选,在激素质量浓度组合方面做了众多研究,但是仍存在很大的分歧,这与外植体、采种时间、生理年龄、基因型等多种因素有关。到目前为止,对于樟树的研究主要集中在樟树茎段组织培养诱导植株再生[14-15]以及樟树提取物[16]、生长模型[17]等方面,在樟树体胚发生方面研究较少,利用樟树幼胚诱导体胚发生及再生植株方面就更少。本试验表明低质量浓度的2,4-D对樟树体胚发生诱导效果较好,与杜丽[11]诱导香樟体胚发生结果类似;在芽诱导阶段,较高质量浓度的细胞分裂素和较低质量浓度的生长素对愈伤组织有更高的分化率,这与青钱柳[18]在组织培养过程中激素使用原则是一样的;樟树组培苗是易诱导生根的材料,张椿芳[18]以香樟茎段为外植体,组培苗生根率可达100%,辛全伟[19]的研究中樟树生根率达95%,且各家系生根率均在50%以上,本研究取得的成果与前人类似,各种源生根率均大于50%,但并没有100%生根的情况,这可能是起始外植体及采种时间不同。
在植物体胚发生过程中,生长素是非常重要的因素。植物组培中生长素2,4-D对植株再生的影响,一直以来就有不同的观点。李文静[20]等人发现愈伤组织在2,4-D质量浓度较高的培养基上,荠菜再生植株能力有所降低;刘福平和陈移亮[22]在只含有2,4-D的培养基上蝴蝶兰诱导产生的愈伤组织不具有分化能力;而在马忠华等[22]的实验中,随着2,4-D质量浓度的增加,早熟禾出愈率不断增加,植株再生能力提高。在实验中我们发现,添加2,4-D的培养基确实能诱导较高频率的体胚产生,且胚性愈伤组织发生频率也高,诱导效果明显好于NAA,可见2,4-D确实有促进体胚发生的效果,但是继续培养,会发现这种促进效果也有抑制体胚发育的能力,即在含有2,4-D的培养基上次生体胚不断发生,体胚难以发育至成熟、发芽乃至植株再生,只有在降低2,4-D质量浓度或去除2,4-D的条件下能观察到芽分化,添加2,4-D前期体胚诱导过程中,并不能发现体胚大量发生,只有在后期(15 d以后)才能明显观察到体胚的大量发生,可能是在培养的过程中,2,4-D质量浓度下降促进了体胚的发育。
NAA体胚诱导率没有2,4-D高,我们发现较高质量浓度的6-BA与NAA组合几乎不能诱导体胚发生,发生频率低,诱导效果不好,但在芽分化过程中含有NAA的培养基诱导效果好,这与上面所说的2,4-D抑制体胚往下一阶段发育相符。实验结果还发现,6-BA质量浓度低,利于愈伤组织及体胚发生,6-BA质量浓度高,利于芽分化,这与辜夕容[23]研究结果相似,而王长宪[24]认为2,4-D:6-BA=4时,能提高愈伤诱导率,这在我的实验中没有体现出来,以后可设置更多的质量浓度梯度验证这一结论。
本研究虽然发现降低或去除2,4-D质量浓度能够使樟树再生体系进行下去,但是转化效率不高,植株再生仍有困难,生根率也不是百分之百,所以我们可以猜测可能添加某些激素或物质可以提高遗传转化效果,使芽分化更容易或更高频率发生,黄健秋等[26]研究发现附加一定量的肌醇可得到粗壮的后期原胚,ABA和活性炭的同时使用能促进体胚形成,肌醇作为一种有效的渗透剂、ABA作为一种催熟剂是不是在樟树体胚诱导过程中有作用呢?对后期原胚的形成是否有促进作用?本次实验还有很多不足的地方,对于激素比例对体胚发生过程的作用还需设置更多梯度,对肌醇、ABA、活性炭等物质还需做更多的因素分析试验,这要在以后的实验中加以验证,得出更多准确的结论。

