细胞色素P450 2C9*8与CYP2C9*27慢病毒表达载体的构建及在HEK239T细胞中的稳定表达
廖 凯, 刘 勇, 万子衿, 李 巍
(1. 扬州大学医学院, 江苏 扬州, 225001; 2. 江苏省中西医结合老年病防治重点实验室, 江苏 扬州, 225001; 3. 大连理工大学 生命与医药学院, 辽宁 盘锦, 124221)
CYP2C9是人体内重要的药物I相代谢酶,参与了超过15%临床药物的代谢清除[1], 其底物包括S-华法林、苯妥英、双氯芬酸、格列甲嗪和甲苯磺丁脲等。CYP2C9基因具有高度的多态性,目前已发现超过60种CYP2C9突变体。这些基因多态性可能影响其底物药的代谢速率及血药浓度,在药物不良反应中起到了关键作用[2-3]。故研究CYP2C9基因多态性对临床安全用药、药物不良反应的预测及指导合理用药具有重要的意义。
CYP2C9*8 (449G>A)为非裔美国人CYP2C9常见的单碱基突变[4-5], 而在亚洲人中该位点常见突变为CYP2C9*27 (499G>T), 在蛋白序列上CYP2C9蛋白上150位精氨酸分别突变为赖氨酸和组氨酸[2, 6]。体外数据[7-8]表明,在对催化底物代谢速率的影响上, CYP2C9*8与CYP2C9*27表现出了不同的选择性。这两种突变均导致CYP2C9的底物氯沙坦等药物的代谢清除速率降低。CYP2C9*8代谢双氯芬酸和氟西汀的速率与野生型CYP2C9相比均下降,而CYP2C9*27催化双氯芬酸和氟西汀代谢的速率与野生型并无显著差异[9-10]。此外CYP2C9*8代谢清除苯妥英速率降低,而CYP2C9*27却导致了代谢清除速率的显著上升[11]。目前CYP2C9*8与CYP2C9*27突变体对酶活性影响的机制仍未完全明确,因此构建CYP2C9*8与CYP2C9*27的表达体系,对研究底物代谢的变化和催化机制十分必要。
细胞色素P450(CYPs)为膜蛋白,大肠杆菌表达CYPs后与脂质重构是目前常见的表达CYPs的方法之一[12], 另外常用的真核表达模型为昆虫细胞模型,具有表达量高的优点,但没有足够的辅酶表达以支持反应[13]。这些模型可能在蛋白修饰或脂质构成上与人存在种属差异,可能导致使用这些模型获得的数据与人体数据存在差异。另外目前也缺乏稳定表达CYP2C9*8与CYP2C9*27的人源化体系。因此本研究通过建立慢病毒表达质粒,将CYP2C9*8与CYP2C9*27稳定表达于人HEK293T细胞,对于CYP2C9*8与CYP2C9*27的功能和催化机制研究是一个有效的模型。
1 材料与方法
1.1 材料与试剂
逆转录试剂盒、PCR扩增试剂盒(PrimeSTAR®GXL DNA Polymerase)、DL 5000 DNA分子质量标准、EcoR I限制性内切酶、Xho I限制性内切酶、E. coli DH5α感受态细胞购自Takara公司, T4连接酶购自NEB公司,胶回收试剂盒、DNA纯化试剂盒、质粒提取试剂盒购自康为世纪生物科技有限公司, MigR1、pCMV-VSV-G与pCMV-Gag-Pol质粒由扬州大学郁多男教授惠赠, HEK293T细胞由扬州大学郑英教授惠赠, TRIzol、lipofectamine 2000购自Invitrogen公司, CYP2C9抗体购自Bio-rad公司, β-actin抗体、HRP-山羊抗小鼠二抗和HRP-山羊抗兔二抗购自中杉金桥公司。
1.2 重组质粒的构建
TRIzol法提取人肝组织总RNA, 并逆转录。采用带有限制性内切酶酶切位点的CYP2C9编码区的上下游引物(CYP2C9-RE-F与CYP2C9-RE-R,引物序列见表1)进行PCR扩增。PCR反应条件为: 94 ℃ 5 min; 94 ℃ 10 s、60 ℃ 30 s、72 ℃ 90 s, 30个循环; 72 ℃ 5 min。PCR产物采用EcoR I和 Xho I进行双酶切,纯化后采用T4 DNA连接酶与EcoR I和 Xho I双酶切后的MigR1质粒进行连接。将连接产物转化至感受态E. coli DH5α, 双酶切筛选阳性克隆并送生工公司测序。获得CYP2C9的重组慢病毒表达质粒,命名为MigR1-CYP2C9。
用重叠PCR方法构建CYP2C9*8与CYP2C9*27编码序列。采用含有449位G>A的正义引物(CYP2C9*8-F)与CYP2C9-RE-R组合,含有449位G>A的反义引物(CYP2C9*8-R)与CYP2C9-RE-F组合,以MigR1-CYP2C9为模板,分别PCR扩增获得两段产物。将这两段产物组合进行重叠PCR反应,获得含有限制性内切酶酶切位点的CYP2C9*8的编码序列。采用含有449位G>T的正义引物CYP2C9*27-F与CYP2C9-RE-R组合,含有449位G>T的反义引物CYP2C9*27-R与CYP2C9-RE-F组合,同样方法获得含有限制性内切酶酶切位点的CYP2C9*27的编码序列。限制性内切酶酶切CYP2C9*8与CYP2C9*27编码序列后并连接至MigR1载体,筛选阳性克隆并测序鉴定。获得CYP2C9*8与CYP2C9*27的重组慢病毒表达质粒,命名为MigR1-CYP2C9*8与MigR1-CYP2C9*27。引物序列见表1。

表1 引物序列
1.3 表达CYP2C9、CYP2C9*8与CYP2C9*27的细胞株的建立
HEK293T细胞培养于3×105/孔的密度接种于6孔板后培养24 h, 用Lipfectamine 2000将MigR1、MigR1-CYP2C9、MigR1-CYP2C9*8或MigR1-CYP2C9*27分别与病毒包装质粒GAG-POL和VSV-G共转染293T细胞(DNA分别为1.8、0.6和0.6 μg), 5 h后更换为新鲜培养基。24 h后收集培养基上清,采用0.45 μm滤膜过滤,获得含慢病毒的培养基,加入聚凝胺(终浓度10 μg/mL)。293T细胞(3×105/孔)接种于6孔板后培养24 h, 更换培养基为上一步获得的含病毒的培养基,继续培养72 h后,更换培养基为RPIM1640培养基(含10%胎牛血清、100 KU/L青霉素和100 mg/链霉素)。传代至100 mm细胞培养皿继续培养后,进行流式分选,稀释至6个/mL, 接种于100 mm细胞培养皿(5 mL), 培养72 h。于荧光显微镜下观察,挑取表达绿色荧光蛋白的克隆至24孔板中。细胞传代30代后绿色荧光蛋白仍稳定表达,细胞命名为293T-MigR1、293T-2C9、293T-2C9*8与293T-2C9*27。
1.4 胞内CYP2C9表达水平的检测
1.4.1qRT-PCR检测CYP2C9的mRNA水平: Trizol法提取293T-MigR1、293T-2C9、293T-2C9*8与293T-2C9*27的总RNA进行反转录。采用SYBR Green qRT-PCR方法,利用2-ΔΔCt对CYP2C9的相对表达量进行分析。CYP2C9和GAPDH的qRT-PCR引物序列见参考文献[14]。
1.4.2Western Blot检测CYP2C9的蛋白表达水平: RIPA裂解液收集293T-MigR1、293T-2C9、293T-2C9*8与293T-2C9*27细胞全蛋白。以20 μg的蛋白量上样于10%SDS-PAGE凝胶并电泳,将蛋白转移到硝酸纤维素膜上, 5%脱脂奶粉封闭,分别与CYP2C9抗体(1︰5 000稀释)或β-actin抗体(1︰1 000稀释)于4 ℃孵育过夜,TBST洗3次后与HRP-山羊抗兔抗体(1︰5 000稀释)或HRP-山羊抗小鼠抗体(1︰5 000稀释)室温孵育1 h, TBST洗3次, ECL显色,用化学发光成像系统成像(Tanon 5500)。
1.4.3CYP2C9活性检测: 分别培养293T-MigR1、293T-2C9、293T-2C9*8与293T-2C9*27至对数生长期并用细胞刮刀收集全部细胞并重悬于含0.15 mol/L KCl 的100 mmol/L磷酸钾缓冲液(pH值7.4), 70W功率下超声破碎细胞,于9 000×g离心20 min, 收集上清后100 000×g离心1 h, 获得沉淀重悬于100 mmol/L磷酸缓冲液(pH 值7.4), 即为细胞的微粒体悬液。人肝微粒体的制备方法见参考文献[15]。分别上述取微粒体(0.5 mg/mL)与氯化镁(MgCl2)(5 mmol/L), 双氯芬酸钠(100 μmol/L)及NADPH(10 μmol/L)混合, 37 ℃水浴30 min后加入甲醇终止反应。采用LC/MS/MS检测代谢产物4-羟基双氯芬酸[14]。
2 结 果
2.1 重组表达质粒的鉴定
来自人肝组织的cDNA经PCR扩增后,获得产物大小在1 500 bp左右。通过重叠PCR法获得产物大小也约为1 500 bp,与预期CYP2C9编码序列一致。上述片段分别插入MigR1质粒后,重组获得的MigR1-CYP2C9、MigR1-CYP2C9*8与MigR1-CYP2C9*27质粒分别经EcoR I和Xho I双酶切,得到与预期片段相符约6 000 bp的载体片段和约1 400 bp的目的片段(图1)。测序结果利用NCBI中的Blast工具与CYP2C9进行比对,结果表明449G>A (CYP2C9*8)与449G>T(CYP2C9*27)突变成功(图2), 序列中无其他突变。
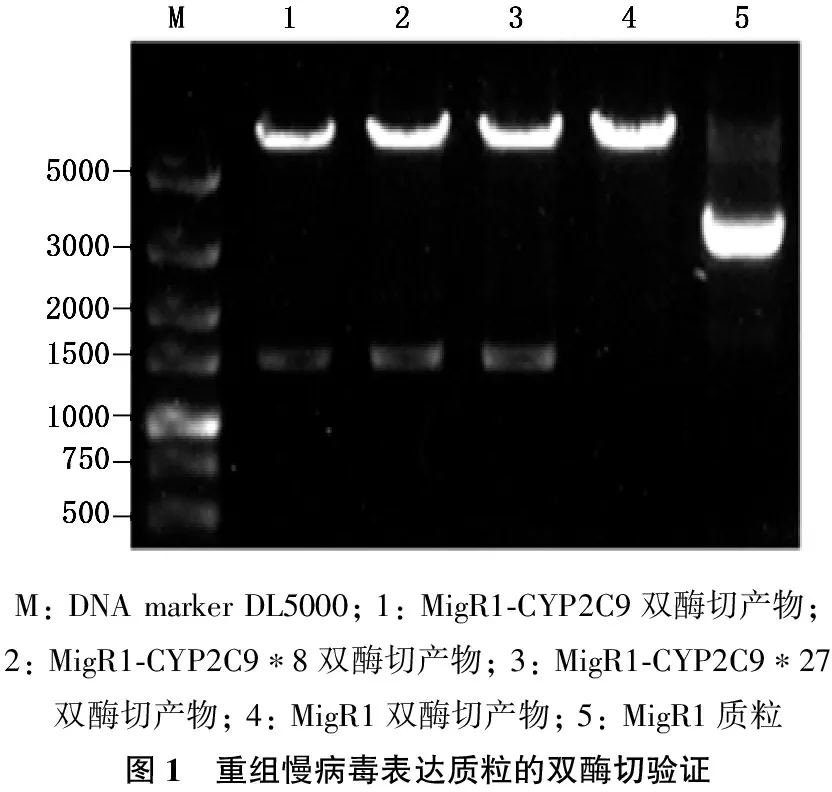
M:DNAmarkerDL5000;1:MigR1⁃CYP2C9双酶切产物;2:MigR1⁃CYP2C9∗8双酶切产物;3:MigR1⁃CYP2C9∗27双酶切产物;4:MigR1双酶切产物;5:MigR1质粒图1 重组慢病毒表达质粒的双酶切验证

图2 重组质粒MigR1⁃CYP2C9(A)、MigR1⁃CYP2C9∗8(B)与MigR1⁃CYP2C9∗27(C)测序结果
2.2 绿色荧光蛋白的表达情况
细胞连续培养30代后,在荧光显微镜下观察可以看到293T-2C9、293T-2C9*8、293T-2C9*27与293T-MigR1细胞均有明显的绿色荧光,而未感染的293T细胞未见绿色荧光(图3)。
2.3 qRT-PCR检测CYP2C9 mRNA水平
细胞连续培养30代后,提取293T-MigR1、293T-2C9、293T-2C9*8与293T-2C9*27胞内的总RNA,逆转录后,采用qRT-PCR方法,检测胞内的CYP2C9 mRNA表达水平。与空质粒对照组(293T-MigR1)比较, 293T-2C9、293T-2C9*8与293T-2C9*27胞内的mRNA高水平明表达(图4)。
2.4 Western blot检测CYP2C9蛋白表达水平
细胞连续培养30代后,提取293T-MigR1、293T-2C9、293T-2C9*8与293T-2C9*27细胞总蛋白。Western blot结果显示, 293T-2C9、293T-2C9*8与293T-2C9*27细胞株及阳性对照(肝组织裂解液)在53kD附近可见特异性条带,而空质粒对照(293T-MigR1)组未见条带(图5)。

左图为明场图像,右图为荧光图像。图3 HEK293T(A)、293T⁃MigR1(B)、293T⁃2C9(C)、293T⁃2C9∗8(D)、293T⁃2C9∗27(E)与细胞连续培养30代后,细胞内的绿色荧光水平。
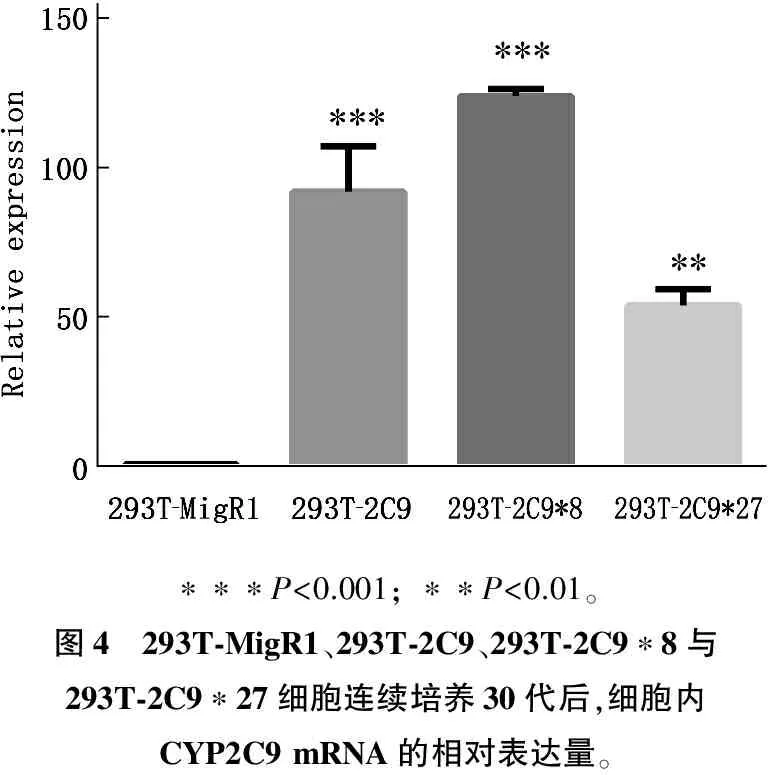
∗∗∗P<0.001;∗∗P<0.01。图4 293T⁃MigR1、293T⁃2C9、293T⁃2C9∗8与293T⁃2C9∗27细胞连续培养30代后,细胞内CYP2C9mRNA的相对表达量。

图5 Westernblot检测细胞内CYP2C9蛋白的表达水平
2.5 CYP2C9活性检测
提取细胞微粒体,采用特异性探针底物双氯芬酸对CYP2C9的活性进行评价。双氯芬酸与微粒体在NADPH存在条件下分别孵育后,检测4-羟基双氯芬酸的生成速率。结果表明,采用Western blot蛋白相对表达量标准化结果后, 293T-2C9、293T-2C9*8与293T-2C9*27的微粒体均有催化双氯芬酸代谢为4-羟基双氯芬酸代谢的活性,而且催化活性为CYP2C9与CYP2C9*27接近,而CYP2C9*8的催化活性较弱(图6)。

图6 293T⁃2C9、293T⁃2C9∗8与293T⁃2C9∗27细胞微粒体催化双氯芬酸生成4⁃羟基双氯芬酸的相对生成速率
3 讨 论
CYP2C9*8(R150H)与CYP2C9*27(R150L)虽然为同位点的突变,但其对底物代谢清除速率的影响因底物而异[7-11]。因此评价不同药物代谢速率所受的影响对预测血药浓度和预防药物不良反十分必要[16]。尽管体内实验研究可以直接反映基因多态性对药物的血药浓度的影响,但由于突变体出现频率较低和直接人体实验的存在安全风险[17]等原因,重组表达突变体并进行体外酶活性评价是可行的替代方法[18-19]。CYPs为膜蛋白,在大肠杆菌中表达后常与二月桂酰基卵磷脂(DLPC)重构[20-23]。杆状病毒-昆虫细胞体系也是常见的CYPs表达体系[24-26]。上述系统中磷脂成分与人膜磷脂成分存在差异,这些差异对CYPs的活性的影响也影响体外模型预测的准确性[27-28]。体外研究中,应用昆虫Sf21、非洲绿猴COS-7与人HepG2细胞所表达CYP2C9*2突变体,在研究该突变对甲苯磺丁脲的代谢影响中得到了相反的结论。本研究采用人源HEK293细胞表达CYP2C9及其突变体,可极大降低表达体系的种属差异在代谢酶活性研究存在的潜在影响。
本研究采用了慢病毒包装质粒后感染HEK2C9T细胞,其效率明显高于使用脂质体直接转染质粒,有效提高了流式分选和单克隆筛选的效率。获得的单克隆细胞在传代30代后仍保持100%绿色荧光,可稳定表达外源基因。qRT-PCR与Western blot实验结果这表明目标蛋白在HEK293T细胞中高表达。
以双氯芬酸为底物研究表明, CYP2C9*8催化生成4-羟基双氯芬酸的速率低于野生型CYP2C9, 该结果与人体内结果相符[29], 表明该稳定表达CYP2C9*8的细胞模型可适合体内代谢情况的预测研究。CYP2C9特异性底物甲苯磺丁脲的体内研究表明, CYP2C9*27突变并不显著影响甲苯磺丁脲的体内药代动力学行为[30]。本研究构建的CYP2C9*27与野生型CYP2C9的代谢速率相近,该结果与体内结论相似。表明本研究构建的稳定表达体系适用于CYP2C9*8与CYP2C9*27两个突变体的研究。
综上所述,本研究成功建立一种稳定表达CYP2C9、CYP2C9*8与CYP2C9*27的细胞模型,为CYP2C9蛋白150位的常见突变体的代谢能力的预测和CYP2C9底物的药物的安全用药提供理论依据。
[1] Miners J O, Birkett D J. Cytochrome P4502C9: an enzyme of major importance in human drug metabolism[J]. Br J Clin Pharmacol, 1998, 45(6): 525-538.
[2] Maekawa K, Fukushima-Uesaka H, Tohkin M, et al. Four novel defective alleles and comprehensive haplotype analysis of CYP2C9 in Japanese[J]. Pharmacogenet Genomics, 2006, 16(7): 497-514.
[3] Zanger U M, Schwab M. Cytochrome P450 enzymes in drug metabolism: regulation of gene expression, enzyme activities, and impact of genetic variation[J]. Pharmacol Ther, 2013, 138(1): 103-141.
[4] Cavallari L H, Vaynshteyn D, Freeman KM, et al. CYP2C9 promoter region single-nucleotide polymorphisms linked to the R150H polymorphism are functional suggesting their role in CYP2C9*8-mediated effects[J]. Pharmacogenet Genomics, 2013, 23(4): 228-231.
[5] Liu Y, Jeong H, Takahashi H, et al. Decreased warfarin clearance associated with the CYP2C9 R150H (*8) polymorphism[J]. Clin Pharmacol Ther, 2012, 91(4): 660-665.
[6] Dai D P, Xu R A, Hu L M, et al. CYP2C9 polymorphism analysis in Han Chinese populations: building the largest allele frequency database[J]. Pharmacogenomics J, 2014, 14(1): 85-92.
[7] Wang Y H, Pan P P, Dai D P, et al. Effect of 36 CYP2C9 variants found in the Chinese population on losartan metabolism in vitro [J]. Xenobiotica, 2014, 44(3): 270-275.
[8] Dai D P, Wang Y H, Wang S H, et al. In vitro functional characterization of 37 CYP2C9 allelic isoforms found in Chinese Han population[J]. Acta Pharmacol Sin, 2013, 34(11): 1449-1456.
[9] Ji Y, Chen S, Zhao L, et al. In vitro assessment of 39 CYP2C9 variants found in the Chinese population on the metabolism of the model substrate fluoxetine and a summary of their effects on other substrates[J]. J Clin Pharm Ther, 2015, 40(3): 320-327.
[10]Xia M M, Wang L, PP P A, et al. The role of CYP2C9 genetic polymorphisms in the oxidative metabolism of diclofenac in vitro[J]. Pharmazie, 2014, 69(12): 898-903.
[11]Chen L G, Wang Z, Zhu Y, et al. In vitro metabolism of phenytoin in 36 CYP2C9 variants found in the Chinese population[J]. Chem Biol Interact, 2016, 253: 93-99.
[12]Kaspera R, Naraharisetti S B, Evangelista E A, et al. Drug metabolism by CYP2C8. 3 is determined by substrate dependent interactions with cytochrome P450 reductase and cytochrome b5[J]. Biochem Pharmacol, 2011, 82(6): 681-691.
[13]Hiratsuka M. In vitro assessment of the allelic variants of cytochrome P450[J]. Drug Metab Pharmacokinet, 2012, 27(1): 68-84.
[14]李巍, 虞茜, 万子衿, 等. 雷公藤内酯醇对肝细胞色素P450的诱导及机制研究[J]. 中国药理学通报, 2017, 33(3): 7-15.
[15]Li W, Liu Y, He Y Q, et al. Characterization of triptolide hydroxylation by cytochrome P450 in human and rat liver microsomes[J]. Xenobiotica, 2008, 38(12): 1551-1565.
[16]Zhou Y, Ingelman-Sundberg M, Lauschke V M. Worldwide Distribution of Cytochrome P450 Alleles: A Meta-analysis of Population-scale Sequencing Projects[J]. Clin Pharmacol Ther, 2017, 102(4): 688-700.
[17]Hiratsuka M. Genetic Polymorphisms and in Vitro Functional Characterization of CYP2C8, CYP2C9, and CYP2C19 Allelic Variants[J]. Biol Pharm Bull, 2016, 39(11): 1748-1759.
[18]Dai D P, Wang S H, Li C B, et al. Identification and Functional Assessment of a New CYP2C9 Allelic Variant CYP2C9*59[J]. Drug Metab Dispos, 2015, 43(8): 1246-1259.
[19]Wienkers L C, Heath T G. Predicting in vivo drug interactions from in vitro drug discovery data[J]. Nat Rev Drug Discov, 2005, 4(10): 825-833.
[20]Jerabek P, Florian J, Martinek V. Lipid molecules can induce an opening of membrane-facing tunnels in cytochrome P450 1A2[J]. Phys Chem Chem Phys, 2016, 18(44): 30344-30356.
[21]Dawaliby R, Trubbia C, Delporte C, et al. Phosphatidylethanolamine Is a Key Regulator of Membrane Fluidity in Eukaryotic Cells[J]. J Biol Chem, 2016, 291(7): 3658-3667.
[22]Liu K C, Hughes J M X, Hay S, et al. Liver microsomal lipid enhances the activity and redox coupling of colocalized cytochrome P450 reductase-cytochrome P450 3A4 in nanodiscs[J]. FEBS J, 2017, 284(14): 2302-2319.
[23]Llerena A, Alvarez M, Dorado P, et al. Interethnic differences in the relevance of CYP2C9 genotype and environmental factors for diclofenac metabolism in Hispanics from Cuba and Spain[J]. Pharmacogenomics J, 2014, 14(3): 229-234.
[24]Hu G X, Pan P P, Wang Z S, et al. In vitro and in vivo characterization of 13 CYP2C9 allelic variants found in Chinese Han population[J]. Drug Metab Dispos, 2015, 43(4): 561-569.
[25]常泽娜, 杨长青. 中药注射剂对细胞色素P450 2C9酶活性及细胞色素P450 2C9底物的药物代谢影响的研究现状[J]. 中国临床药理学杂志, 2017, 33(12): 1165-1168.
[26]王晓东, Arthur I. Cederbaum细胞色素P450 2E1在酒精性肝损伤中的作用及研究进展[J]. 第三军医大学学报, 2016, 38(14): 1585-1592.
[27]李辉, 李妙男, 康品方, 等. 细胞色素P450 3A4+894C>T基因多态性与急性冠脉综合症患者冠状动脉介入术预后的关系[J]. 南方医科大学学报, 2017, 37(2): 261-265.
[28]王晓焕, 傅薇, 张云坤, 等. CYP2C19基因多态性与云南汉族人群冠心病的相关性研究[J]. 中华全科医学, 2017, 15(5): 763-766.
[29]张巧利, 张丽娟, 李芬. 细胞色素P450基因多态性对围绝经期妇女潮热易感性的影响[J]. 第三军医大学学报, 2016, 38(14): 1639-1644.
[30]Song B J, Akbar M, Jo I, et al. Translational Implications of the Alcohol-Metabolizing Enzymes, Including Cytochrome P450-2E1, in Alcoholic and Nonalcoholic Liver Disease[J]. Adv Pharmacol, 2015, 74: 303-372.

