马拉色菌在特应性皮炎患者皮损区和非皮损区定植情况的研究*
陆 茂,冉玉平,代亚玲,欧 美,吴红梅,罗媛元
1.四川大学华西医院 皮肤科(成都 610041);2.成都医学院第一附属医院 皮肤科(成都 610500)
特应性皮炎(atopic dermatitis, AD)是一种临床常见的复发性、瘙痒性、炎症性皮肤病,其病因和发病机制尚不清楚,可能是遗传因素、免疫因素、环境因素、感染因素等共同作用所致。与感染因素有关的微生物主要有金黄色葡萄球菌,其次是真菌(包括马拉色菌及念珠菌等)[1-2]。目前,国外有关马拉色菌在AD患者皮肤定植情况的报道[3-4]较多,但阳性检出率及菌种构成差异较大,可能与种族、地区及鉴定方法不同有关,而国内相关报道很少。本研究采用Sugita等[5]实时荧光定量 PCR方法,对从AD患者面部、上肢、背部皮损区和非皮损区皮肤鳞屑提取的马拉色菌DNA进行定量PCR检测,分析国内AD患者皮损区和非皮损区马拉色菌的分布特点和菌种构成。现报道如下。
1 资料与方法
1.1 临床资料
选取2016年3—5月四川大学华西医院皮肤科门诊或住院就诊的AD患者共28例,符合AD诊断标准[6]。其中,男15例,女13例;年龄1~12(5.25±3.64)岁。参照湿疹面积及严重度指数(eczema area and severity index, EASI)评分法[7],对患者病情严重程度进行评分,得分1.2~55.2(12.57±11.71)分。23例健康对照者来自我院工作人员子女,男13例,女10例,年龄2~15(6.69±3.71)岁。所有研究对象2周内无使用抗真菌药物和糖皮质激素史,采样前24 h内不能在采样部位使用任何清洁用品(包括水洗)或药物,不伴有其他皮肤病,不伴有肿瘤或其他严重疾患。两组研究对象性别、年龄比较,差异无统计学意义(P>0.05),具有可比性。所有研究对象在入组前均已获得知情同意,并签署知情同意书。
1.2 主要试剂和仪器
OpSiteTM无菌透明敷贴(英国Smith and Nephew Medical公司);1M Tris-HCI、10%SDS、0.5M EDTA、TE缓冲液(日本Wako公司);苯酚/氯仿/异戊醇溶液(美国Invitrogen公司);氯仿、异戊醇、无水乙醇(上海索莱宝生物科技有限公司);3M乙酸钠、Ethatimate(日本Nippon Gene公司);pUC57载体、大肠杆菌BL21感受态细胞(上海生工生物工程股份有限公司);QIAprep Spin Miniprep Kit质粒小量提取试剂盒(德国Qiagen公司);S1000TM Thermal Cycler基因扩增仪、Power PAC300电泳仪、GelDoc1000型数字化凝胶成像系统(美国Bio-rad公司);FTC2000荧光定量PCR仪(加拿大Funglyn Biotech公司);Ultrospec 3100 pro紫外分光光度计(美国GE公司)。
1.3 引物与探针的设计和合成
参照Sugita等[5]设计的马拉色菌属、球形马拉色菌、限制马拉色菌特异性引物和探针,由北京华大基因研究中心合成3对引物以及与之对应的MGB荧光探针(表1)。

表1 实时荧光定量PCR 所用的引物及探针
1.4 采样
以OpSiteTM无菌透明敷贴采集AD患者3个部位(面部、上肢、背部)皮损区和非皮损区以及健康对照者相应区域的皮肤鳞屑。敷贴重复粘贴同一区域3次以保证菌量。取一部分敷贴(3 cm×3 cm)进行直接DNA提取。
1.5 马拉色菌基因DNA的提取
向1.5 mL无菌EP管加入700 μL lysing solution(100 mM Tris-HCl,30 mM EDTA,0.5%SDS),然后取3 cm×3 cm敷贴放入EP管中,置于100 ℃,干浴15 min,离心半径5 cm,14 000 r/min,离心5 min,取200 L上清液转移到一个新的1.5 mL无菌EP管中。加入100 μL苯酚/氯仿/异戊醇溶液(25∶24∶1)混匀,离心半径5 cm,14 000 r/min,离心5 min,取200 μL上清液转移到1个新的1.5 mL的无菌EP 管中。加入100 μL氯仿/异戊醇溶液(24∶1)混匀,离心半径5 cm,14 000 r/min,离心5 min,取200 μL上清液转移到一个新的1.5 mL的无菌EP 管中。加入3.3 μL 3M乙酸钠,混匀5 s,再加入1 μL Ethatimate,混匀5 s,向每管加入500 μL无水乙醇,混匀3 s,离心半径5 cm,14 000 r/min,离心20 min。弃上清,加入200 μL70%乙醇,离心半径5 cm,14 000 r/min,离心5 min。弃乙醇,室温下干燥30 min。加入30 μL TE缓冲液,至DNA完全溶解后,-20 ℃保存备用。
1.6 马拉色菌标准质粒构建与验证
由北京华大基因研究中心人工合成马拉色菌属、球形马拉色菌、限制马拉色菌特异性引物上下游相应区域约150 bp片段[5],作为构建马拉色菌属、球形马拉色菌、限制马拉色菌标准质粒所需插入的序列(标准质粒的序列涵盖扩增片段即可)。合成产物与 pUC57载体连接后转化大肠杆菌BL21感受态细胞,用含有 LB琼脂平板筛选阳性克隆,用 PCR 扩增鉴定阳性克隆菌,并对阳性重组质粒测序验证。用质粒小量提取试剂盒提取质粒,紫外分光光度计测定浓度与纯度,计算拷贝数。将重组质粒DNA进行10倍梯度稀释制备不同拷贝数的标准品阳性质粒模板,用于实时荧光定量PCR反应条件标准曲线的建立。
1.7 PCR反应
反应体积为10 μL:PCR buffer 5 μL,正方向引物、探针各0.2 μL,模板DNA 2 μL,去离子水2.35 μL。反应条件:94 ℃预变性4 min;94 ℃变性20 s,60 ℃复性30 s,72 ℃延伸30 s,循环35次;最后72 ℃延伸10 min。选用实验室保存的白色念珠菌(ATCC10231)以及表皮葡萄球菌(ATCC040188)标准株作为对照,检验马拉色菌引物的特异性。扩增时均用去离子水作为模板设阴性对照,每板均带标准曲线,3孔重复。分别以 105~109拷贝/反应,于同等条件下进行实时荧光定量PCR,每个稀释度设置 3孔重复。以各标准品质粒起始拷贝数的对数为横坐标,Ct 值为纵坐标,生成标准曲线。检测未知样品的 Ct 值,即可从标准曲线上计算出该样品的拷贝数。
1.8 统计学方法

2 结果
2.1 PCR质量控制
马拉色菌属、球形马拉色菌、限制马拉色菌重组质粒10倍倍比稀释101~108拷贝/反应,于同等条件下进行荧光定量PCR,均得到阳性扩增曲线,白念珠菌以及表皮葡萄球菌标准株作为对照,无阳性结果。马拉色菌属、球形马拉色菌、限制马拉色菌标准曲线的相关系数均≥0.995,扩增效率为96.15%~102.97%,反映了标准曲线有良好的线性度和反应效率。
2.2 AD患者、健康对照者各部位马拉色菌拷贝数比较
AD患者、健康对照者各部位马拉色菌拷贝数比较结果显示:部位与区域交互作用差异无统计学意义(P>0.05);AD患者面部皮损区、非皮损区和健康对照者面部马拉色菌属、球形马拉色菌、限制马拉色菌拷贝数均高于上肢、背部相应区域,差异有统计学意义(P<0.05),上肢与背部比较,差异无统计学意义(P>0.05);AD患者同一部位皮损区、非皮损区、健康对照者相应区域马拉色菌属、球形马拉色菌、限制马拉色菌拷贝数比较,差异无统计学意义(P>0.05)(表2)。
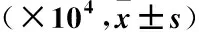
表2 AD患者、健康对照者不同部位马拉色菌拷贝数比较
注:与面部比较,*P<0.05
2.3 AD患者各部位马拉色菌拷贝数与EASI评分的相关性
AD患者面部、上肢、背部的皮损区、非皮损区马拉色菌属拷贝数与EASI评分均无相关性(r=0.282、0.139、0.210、0.175、0.253、0.148,P>0.05);AD患者面部、上肢、背部的皮损区、非皮损区球形马拉色菌拷贝数与EASI评分均无相关性(r=0.360、0.162、0.231、0.181、0.284、0.054,P>0.05);AD患者面部、上肢、背部的皮损区、非皮损区限制马拉色菌拷贝数与EASI评分均无相关性(r=0.166、0.135、0.314、0.223、0.220、0.184,P>0.05)。
2.4 AD患者、健康对照者各部位马拉色菌菌种构成
AD患者及健康对照者各部位马拉色菌菌种构成均以球形马拉色菌和限制马拉色菌为主,两者占比合计达80%以上。AD患者、健康对照者各部位马拉色菌占比结果显示:菌种与区域交互作用差异无统计学意义(P>0.05); AD患者各部位皮损区、非皮损区和健康对照者相应区域球形马拉色菌、限制马拉色菌占比比较,差异无统计学意义(P>0.05);AD患者各部位皮损区、非皮损区和健康对照者相应区域同一菌种占比比较,差异无统计学意义(P>0.05)(表3)。

表3 AD患者、健康对照者各部位球形马拉色菌、限制马拉色菌占比比较
3 讨论
马拉色菌现分为14个种,传统的菌种鉴定方法是在分离培养后进行形态学和生理生化学特性分析。近年来,随着皮肤微生态研究技术的不断发展,基于培养的鉴定方法已逐渐被认识到存在以下3个方面的不足:1)马拉色菌各菌种对营养条件的需求不同,生长速度不一,不同菌种生长条件和快慢有差异,不同菌种易发生相互抑制生长,容易生长的菌种可抑制和掩盖不易生长的菌种;2)准确的马拉色菌菌种结构分析要求待测标本中所有种类的马拉色菌均能在培养基中生长复苏,但迄今尚无一种培养基能满足所有马拉色菌菌种的生长要求;3)各菌种的形态特征和生理生化指标会随着培养方法的不同而发生变化,加上判断结果时受主观因素和客观条件的影响均比较大,形态学和生理生化学鉴定方法所得出的结果不可避免存在一定误差,同时不同实验室之间数据分享和横向比较也存在一定的困难[8-9]。基于分离培养的鉴定方法曾经广泛应用于健康者和AD患者皮肤马拉色菌研究中,大多数此类方法的研究[4,10]结果表明,球形马拉色菌、糠秕马拉色菌和合轴马拉色菌是AD患者皮肤的优势菌种。随着对马拉色菌微生态研究深入,发现培养法的偏向性和局限性使其误差较大,比较突出的问题是限制马拉色菌的检出率很低甚至检测不到,可能是由于限制马拉色菌在培养中生长缓慢,常被其他马拉色菌菌种抑制和掩盖所致。为避免培养法的局限性,国际上逐渐采用不依赖于培养的分子研究方法(非培养法)来鉴定马拉色菌菌种。2001年,Sugita等[11]首次报道了一种通过敷贴粘取鳞屑标本直接提取马拉色菌DNA,然后经巢式PCR进行定性研究的非培养鉴定方法,此方法不仅使菌种检测灵敏度明显提高,还避免了培养环节对马拉色菌各菌种生长的影响,可真实反映马拉色菌原位定植情况。2006年,Sugita等[5]在上述方法的基础上,采用实时荧光定量 PCR对日本34例AD患者头颈部、躯干、上肢皮损区马拉色菌DNA进行定量分析,结果显示AD患者头颈部的马拉色菌含量是躯干的12.4倍、四肢的6.8倍,其中球形马拉色菌、限制马拉色菌分别占马拉色菌总量的30.3%~34.7%、45.4%~51.0%。此方法可明确马拉色菌的原位含量和菌种构成比例,有助于马拉色菌的微生态研究以及相关疾病的疗效判定,已应用到多种马拉色菌相关疾病和正常健康者的研究中[8,12-13]。2011年,Kaga等[14]又报道了用同样的方法研究轻、中、重度共56例头颈部AD患者皮损区和32例健康对照者相应区域的马拉色菌含量和构成,结果显示马拉色菌含量和构成与病情严重程度有关,重度AD患者马拉色菌含量是轻、中度患者和健康对照者的2~5倍。Akaza等[15]用实时荧光定量PCR分析日本20例男性AD患者和47例女性AD患者面部、躯干上部马拉色菌定植情况,结果表明,中重度女性患者面部马拉色菌含量多于轻度患者,女性躯干上部和男性两个部位马拉色菌含量与病情严重程度无关。综上所述,大多数研究结果显示,AD患者面部马拉色菌含量高于躯干和四肢,菌种构成以球形马拉色菌和限制马拉色菌为主,但马拉色菌含量与疾病严重程度之间的关系尚存争议。
本研究结果显示,AD患者面部皮损区、非皮损区和健康对照者面部马拉色菌属、球形马拉色菌、限制马拉色菌拷贝数均高于上肢、背部相应区域,差异有统计学意义(P<0.05),而上肢、背部马拉色菌含量比较差异无统计学意义(P>0.05);AD患者同一部位皮损区、非皮损区与健康对照者相应区域马拉色菌含量比较差异无统计学意义(P>0.05);AD患者各部位皮损区、非皮损区马拉色菌含量与病情严重程度无关;AD患者、健康对照者各部位马拉色菌菌种构成均以球形马拉色菌和限制马拉色菌为主。尽管人种、气候、生活环境存在一定差异,本研究定量分析结果与日本学者[5,14-15]研究结果基本相符,这也从另一方面说明此方法实验重复性较好,可用于多中心不同实验室的数据分享和横向研究。
AD患者普遍存在皮肤屏障功能障碍,定植于皮肤表面的马拉色菌容易进入体内,然后通过特异性IgE抗体和T细胞介导的免疫反应释放炎症介质,这些炎症介质不仅可使局部炎症加重,引起瘙痒、搔抓,破坏皮肤屏障功能,而且可直接影响与皮肤屏障功能有关的丝聚蛋白和神经酰胺的合成[16-17],还能抑制皮肤表面具有抵御病原微生物活性的抗菌肽合成[18],上述效应都更加有利于马拉色菌定植和入侵,形成恶性循环。此外,由于马拉色菌是嗜脂性酵母菌,好定植于头颈部,通过此处进入人体的马拉色菌量较其余部位多,因此该部位的炎症反应和皮肤屏障受损程度更重,也更有利于马拉色菌在此处的定植和入侵。这些都有可能导致AD患者面部马拉色菌含量高于其他部位,较正常人更加明显。
既往有研究[19-21]表明,AD患者(尤其是头颈部AD患者)血清中抗马拉色菌特异性IgE抗体水平明显高于健康对照者,而且血清抗马拉色菌特异性IgE抗体水平与病情严重程度有相关性,提示AD患者病情严重程度与进入体内引起免疫反应马拉色菌的量有关。由于AD患者多有皮肤屏障功能障碍,进入体内马拉色菌的多少不是只由皮肤表面马拉色菌含量高低来决定的,此外皮损的性质、局部免疫反应也可能对马拉色菌定植难易程度有影响,由此可以从理论上推测,AD患者皮肤表面马拉色菌含量不一定与疾病严重程度有关。
[1]Bjerre R D, Bandier J, Skov L,etal. The role of the skin microbiome in atopic dermatitis: a systematic review[J]. Br J Dermatol, 2017, 177(5): 1272-1278.
[3]Jagielski T, Rup E, Zió1 kowska A,etal. Distribution of Malassezia species on the skin of patients with atopic dermatitis, psoriasis, and healthy volunteers assessed by conventional and molecular identification methods[J]. BMC Dermatol, 2014, 14: 3.
[4]Prohi A, Jovovi Sadikovi T, Kuskunovi-Vlahovljak S,etal. Distribution of Malassezia Species in Patients with Different Dermatological Disorders and Healthy Individuals[J]. Acta Dermatovenerol Croat, 2016, 24(4): 274-281.
[5]Sugita T, Tajima M, Tsubuku H,etal. Quantitative analysis of cutaneous malassezia in atopic dermatitis patients using real-time PCR[J]. Microbiol Immunol, 2006, 50(7): 549-552.
[6]张学军.皮肤性病学[M].第8版.北京:人民卫生出版社,2013:113.
[7]赵辨. 湿疹面积及严重度指数评分法[J]. 中华皮肤科杂志, 2004, 37(1):7-8.
[8]Saad M, Sugita T, Saeed H,etal. Molecular epidemiology of Malassezia globosa and Malassezia restricta in Sudanese patients with pityriasis versicolor[J]. Mycopathologia, 2013, 175(1/2): 69-74.
[9]冉玉平. 马拉色菌及其相关皮肤病诊治进展[J]. 皮肤性病诊疗学杂志, 2011, 18(3):142-143.
[10] Kim S Y, Lee Y W, Choe Y B,etal. Progress in Malassezia Research in Korea[J]. Ann Dermatol, 2015, 27(6): 647-657.
[11] Sugita T, Suto H, Unno T,etal. Molecular analysis of malassezia microflora on the skin of atopic dermatitis patients and healthy subjects[J]. Nihon Ishinkin Gakkai Zasshi, 2001, 42(4): 217-218.
[12] Zhang E, Tanaka T, Tsuboi R,etal. Characterization of Malassezia microbiota in the human external auditory canal and on the sole of the foot[J]. Microbiol Immunol, 2012, 56(4): 238-244.
[13] Takahata Y, Sugita T, Hiruma M,etal. Quantitative analysis of Malassezia in the scale of patients with psoriasis using a real-time polymerase chain reaction assay[J]. Br J Dermatol, 2007, 157(4): 670-673.
[14] Kaga M, Sugita T, Nishikawa A,etal. Molecular analysis of the cutaneous Malassezia microbiota from the skin of patients with atopic dermatitis of different severities[J]. Mycoses, 2011, 54(4): e24-e28.
[15] Akaza N, Akamatsu H, Sasaki Y,etal. Cutaneous Malassezia microbiota in atopic dermatitis patients differ by gender and body part[J]. Dermatology (Basel), 2010, 221(3): 253-260.
[16] Rerknimitr P, Otsuka A, Nakashima C,etal. The etiopathogenesis of atopic dermatitis: barrier disruption, immunological derangement, and pruritus[J]. Inflamm Regen, 2017, 37: 14.
[17] Koppes S A, Brans R, Ljubojevic Hadzavdic S,etal. Stratum Corneum Tape Stripping: Monitoring of Inflammatory Mediators in Atopic Dermatitis Patients Using Topical Therapy[J]. Int Arch Allergy Immunol, 2016, 170(3): 187-193.
[18] Schmid-Grendelmeier P, Ballmer-Weber B K. Atopic dermatitis -current insights into path physiology and management[J]. Ther Umsch, 2010, 67(4): 175-185.
[19] Glatz M, Bosshard P P, Hoetzenecker W,etal. The Role of Malassezia spp. in Atopic Dermatitis[J]. J Clin Med, 2015, 4(6): 1217-1228.
[20] Brodská P, Panzner P, Pizinger K,etal. IgE-mediated sensitization to malassezia in atopic dermatitis: more common in male patients and in head and neck type[J]. Dermatitis, 2014, 25(3): 120-126.
[21] Glatz M, Buchner M, von Bartenwerffer W,etal. Malassezia spp.-specific immunoglobulin E level is a marker for severity of atopic dermatitis in adults[J]. Acta Derm Venereol, 2015, 95(2): 191-196.

