新鲜大黄鱼优势腐败菌碳源利用的差异性分析
朱彦祺,郭全友*,姜朝军,李保国*
大黄鱼(Pseudosciaena crocea)是我国地方性海水鱼类,在我国渔业经济中占据重要地位[1-2]。大黄鱼多以鲜鱼出口、内销或制成轻腌大黄鱼流通,生鲜制品已成为大黄鱼产品最常用的运输和消费途径。据联合国粮食及农业组织调查,捕获的鱼类大约有30%~50%在食品供应链的不同环节发生损失,主要是由于水产品的运输、贮藏条件要求高,环境和温度的波动对其货架期影响大[3]。
影响大黄鱼货架期的主要因素是微生物的生长代谢作用[4-6]。在微生物的作用下,鱼体中的蛋白质、氨基酸及其他含氮物质被分解,会产生氨、胺类、硫化物、醇类、醛类、酮类、有机酸和其他小分子产物,导致鱼体腐败变质。造成鱼变质的主要微生物称作优势腐败菌[7],腐败菌的生长受到营养成分、水分活度、pH值、贮藏温度、相对湿度、环境气体等影响[8]。微生物的生长繁殖和自我修复都需要消耗营养来维持内部平衡,营养成分的缺失会导致细菌生长缓慢、失活、死亡[9]。碳源作为微生物生长的六大要素之一,对微生物的生长繁殖有很大影响,研究微生物对碳源的利用情况,分析其差异性对抑制微生物生长,延长货架期具有指导作用。其中Biolog检测系统可以研究微生物对营养成分碳源的利用程度,探索微生物群体水平的生理功能和代谢功能的多样性,可作为控制腐败微生物生长的有效方法,目前有郭全友等[10]对鱼源莓实假单胞菌的碳源利用进行了分析,对淡腌青鱼中木糖葡萄球菌的碳源代谢能力进行了研究[11],但鲜见对同种特定产品中优势腐败菌碳源利用差异性的分析。
最大比生长速率和延滞期是反映微生物生长动力学的主要参数,最大比生长速率反映微生物生长的快慢,延滞期表示细菌适应环境的能力,是描述微生物生长及货架期预测的主要指标,通常使用Gompertz模型进行参数拟合运算,得到相应动力学参数,建立微生物生长模型。许钟等[12]建立了冷藏罗非鱼特定腐败菌在0、5、10、15 ℃的生长动力学Gompertz模型,可实时预测0~15 ℃贮藏罗非鱼的微生物量和剩余货架期。焦维桢等[13]建立了真空包装鲟鱼在冷藏过程中的优势腐败菌的生长Gompertz预测模型,为延长货架期提供参考依据。但微生物碳源利用过程生长动力学的研究甚少,对Biolog检测结果使用Gompertz模型拟合,得到其动力学参数,可知该种碳源是否为其生长所需碳源及其利用程度,相关模型可为优化产品配方、有效抑制细菌活动提供参考。
本研究以新鲜大黄鱼作为研究对象,在常用运输贮藏温度5、25 ℃条件下确定其货架期,分离优势腐败菌,使用Biolog检测系统检测优势腐败菌对碳源利用率,并运用Gompertz模型拟合确定其碳源利用代谢的动力学参数,反映细菌能够利用的底物种类以及对于底物的利用代谢水平和生长情况,探索新鲜大黄鱼不同温度下优势腐败菌对碳源利用、动力学的差异性,为调控大黄鱼在生产贮藏运输中抑菌因子、延长新鲜大黄鱼的货架期提供实验支撑。
1 材料与方法
1.1 材料与试剂
新鲜大黄鱼(每条约(450±50)g) 上海东方国际水产中心;Ezup柱式细菌基因组DNA抽提试剂盒、聚合酶链式反应(polymerase chain reaction,PCR)扩增试剂盒 生工生物工程(上海)股份有限公司;胰蛋白大豆琼脂(TSA)培养基、高氯酸(分析纯)、甲醇(优级纯)、氢氧化钠、硫代巴比妥酸、硼酸 国药集团化学试剂有限公司;BUG培养基、Protrol A接种液、GEN-3鉴定板 美国Biolog公司;叔丁基甲基醚(优级纯)德国Sigma公司;盐酸溶液(0.01 mol/L) 深圳博林达有限公司。
1.2 仪器与设备
微生物鉴定仪 美国Biolog公司;MIDI微生物脂肪酸鉴定仪 美国安捷伦公司;PCR扩增仪(PCR System 9700) 美国ABI公司;GelDoc-It凝胶成像仪 美国UVP公司。
1.3 方法
1.3.1 大黄鱼货架期的确定
依据GB/T 18108—2008《鲜海水鱼》方法取样,对产品进行感官检测,参照GB 4789.2—2010《食品微生物学检验 菌落总数测定方法》进行菌落总数的测定,参照SC/T 3032—2007《水产品中挥发性盐基氮的测定方法》进行挥发性盐基氮(total volatile basic nitrogen,TVBN)含量的测定。样品分别于5 ℃每24 h进行检测,于25 ℃每8 h检测。参照SC/T 3101—2010《鲜大黄鱼、冻大黄鱼、鲜小黄鱼、冻小黄鱼》与GB 2733—2015《鲜、冻动物性水产品》,当菌落总数达到7(lg(CFU/g))或TVBN含量不小于30 mg/100 g时判断该产品到达其货架期。
1.3.2 优势腐败菌的分离及鉴定
1.3.2.1 细菌的分离
在贮藏初始点和货架期终点,在测定菌落总数的平板上根据菌落形态挑取菌株,依据菌落形态、革兰氏染色、细胞形态、芽孢有无、运动性及氧化、发酵等特征,采用双歧分类法进行分组,每组挑取所有菌落或若干菌落,分离纯化,25 ℃培养48 h[14]。纯化后进行鉴定,根据贮藏初始点和货架期终点的菌相变化确定优势腐败菌。
1.3.2.2 优势腐败菌的鉴定
将腐败菌株经过反复分离纯化,接种到TSA培养基中25 ℃培养24 h。
采用MIDI脂肪酸初步鉴定:挑取分离所得菌在营养琼脂上进行划线,25 ℃恒温培养24 h,挑取40 mg(湿质量)菌落,进行皂化、甲基化、萃取、洗涤等步骤,获取含有细菌脂肪酸的萃取液;用气相色谱仪结合氢火焰离子化检测器及MIDI分析系统分析测试结果,分析其菌相变化,将货架期终点占比最高的腐败菌反复纯化进行下一步鉴定。
分子鉴定方法:用Ezup柱式细菌基因组DNA抽提试剂盒提取纯化菌株的DNA,正向引物为27F,反向为1492R,由生工生物工程(上海)股份有限公司合成:正向27F:5’-GAGAGTTTGATCCTGGCTCAG-3’,反向1492R:5’-CTACGGCTACCTTGTTACGA-3’。
PCR扩增采用25.0 μL体系,反应条件为:2.5 μL 10×PCR buffer;2.5 μL dNTP(含Mg2+);0.3 μL Taq DNA酶;1.0 μL正向引物;1.0 μL反向引物;1.0 μL DNA模板;16.7 μL ddH2O。PCR步骤:94 ℃热启动5 min;94 ℃预变性5 min;进行25 个循环[15-16];94 ℃变性1 min、57 ℃退火1 min、72 ℃复性2 min;72 ℃延伸10 min。使用1.0%琼脂糖凝胶电泳检验PCR扩增产物,产物约为1 500 bp。将PCR产物送至生工生物工程(上海)有限公司测序。
1.3.3 优势腐败菌碳源利用分析
1.3.3.1 碳源利用的测定
将鉴定后的优势腐败菌划线分离纯化。取单菌落在BUY培养基上划线,25 ℃培养48 h,挑取单菌落,接种到鉴定板配套的接种液Protrol A试剂中,使菌体均匀分散于接种液,浊度值达到(98±1)%时,将菌悬液加在96 孔鉴定板(GEN-3)内,每孔100 μL。25 ℃培养100 h,5 ℃培养145 h,待利用达到平稳。每3 h测定OD值,碳源包括糖类31 种、氨基酸类10 种、己糖磷酸类8 种、羧酸类15 种、酯类3 种、其他4 种[17]。通过OD值可以反映微生物对碳源利用的种类、速率、延滞期,体现微生物的生长情况。
1.3.3.2 碳源利用动力学分析
每孔颜色平均变化率(average well color development,AWCD)是衡量微生物利用不同碳源整体能力的指标之一[18-19],颜色变化的深浅即代表该种碳源的利用强弱。AWCD的计算公式如式(1)所示:

式中:Ci为每个测试孔590 nm波长处的OD值;R为对照孔的OD值;n为底物数量(GEN-3板,n=71)。
参考郭全友等[20]针对环境因子对大黄鱼腐败希瓦氏菌生长影响的计数法分析研究,以及Verschuere等[21]对Biolog微孔板的数据进行建模;对4 种腐败菌碳源利用的生长情况采用Gompertz方程进行拟合,计算其碳源利用的动力学参数,见式(2):
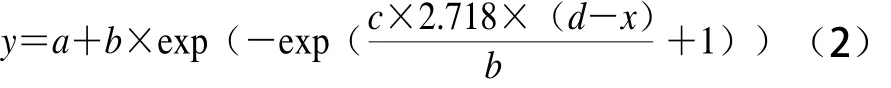
式中:a为最小OD值;b为最大OD值与最小OD值之差;c为该碳源利用下的最大比生长速率[21];d为延滞期;x为时间;y为OD值。
1.4 数据分析
系统发育树分析:测序得到菌株16S rRNA序列(约1 500 bp),将测序结果登陆NCBI网站,通过BLAST程序与GenBank中的核酸序列进行比对,从中选出相似性最高的序列,应用Chromas version 1.62进行多重比较,利用MEGA 7.0软件构建系统发育树,选择HKY模型,Bootstrap重复为500 次。Biolog数据分析使用SPSS 21.0软件以及Origin 9.0作图。
2 结果与分析
2.1 大黄鱼的货架期结果
如图1所示,贮藏初始点时大黄鱼中的菌落总数为(4.21±0.25)(lg(CFU/g)),TVBN含量为(8.04±1.07)mg/100 g,在5 ℃贮藏过程中随时间延长,菌落总数和TVBN含量都呈逐步递增趋势,在50 h后上升的速率明显增加,最终在216 h(9 d)为(7.70±0.15)(lg(CFU/g))和(29.98±2.19)mg/100 g,表明新鲜大黄鱼在5 ℃时贮藏的货架期为(9.0±1.0)d。在25 ℃贮藏过程中菌落总数和TVBN含量都随时间延长而增加,在24 h时分别达到(7.21±0.24)(lg(CFU/g))和(28.03±0.38)mg/100 g,超出标准,表明大黄鱼在25 ℃贮藏的货架期为(1.0±0.11)d。
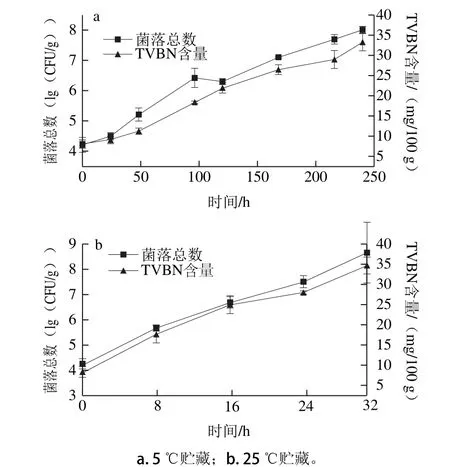
图1 贮藏过程中大黄鱼的品质变化Fig. 1 Change in microbial quality during storage of fresh P. crocea
许钟等[22]研究了大黄鱼在0、5、10 ℃冷藏条件下的货架期,通过曲线拟合得到的货架期分别为15、8.6 d和4.5 d;郭全友等[23]建立了0~25 ℃间新鲜大黄鱼的货架期模型,结果显示25 ℃贮藏条件下大黄鱼的货架期为1.1 d,与本实验5、25 ℃时的研究结果相接近,说明温度对大黄鱼产品的货架期影响显著。
2.2 优势腐败菌鉴定
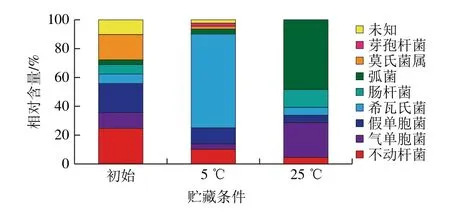
图2 新鲜大黄鱼2 种贮藏条件货架期终点的菌相变化Fig. 2 Changes in bacterial flora at the end of shelf life at two storage temperatures
经MIDI脂肪酸初步鉴定后,生鲜大黄鱼贮藏初始点、5、25 ℃货架期终点的菌相组成比例如图2所示。由图2可知,贮藏初期大黄鱼中有不动杆菌(Acinetobacter)24.44%、气单胞菌(Aeromonas)11.13%、假单胞菌(Pseudomonas)20.0%、希瓦氏菌属(Shewanella spp.)6.66%、肠杆菌(Enterobacter)6.66%、弧菌属(Vibrio spp.)3.1%、莫氏菌属(Mohs spp.)17.8%、未知菌属10.33%;5 ℃货架期终点时,希瓦氏菌比例从6.66%增加到65.12%,25 ℃货架期终点时,弧菌相对含量从3.1%增加到48.48%。初始阶段2 种菌的相对含量并不高,在货架期终点达到最大比例。腐败希瓦氏菌是冷藏大黄鱼中典型的腐败菌,适宜在低温环境中生长[24],相对不动杆菌属和气单胞菌属在低温贮藏环境有更短代时,生长速度快;弧菌能吸附于鱼体黏液,在室温条件下更易于繁殖,在贮藏过程中的优势菌具有更短的代时,生长速度快,底物利用率高或者可以通过某种方式抑制其他菌属的生长[23]。其他细菌由于温度降低、营养缺乏使生长速率减缓,代时增长使细胞失活逐渐消亡,腐败希瓦氏菌和河流弧菌的生长繁殖逐渐占据主导地位,通过生长代谢分解鱼体蛋白质、氨基酸及其他含氮物质,产生氨、胺类、硫化物、醇类、醛类、酮类、有机酸和其他小分子产物,导致鱼体腐败变质。
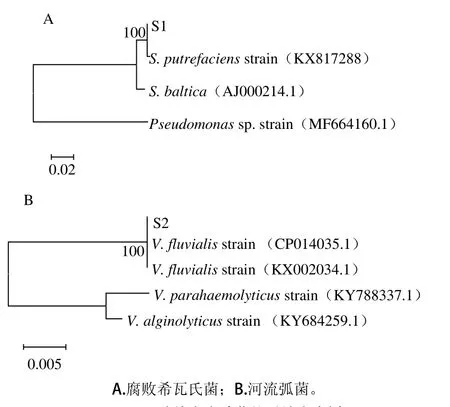
图3 2 种特定腐败菌的系统发育树Fig. 3 Phylogenetic trees for the dominant spoilage bacteria
对希瓦氏菌属及弧菌属的腐败菌进行进一步分子鉴定,通过BLAST比对和系统发育树显示(图3),S1和腐败希瓦氏菌的相似度达到100%,S2与河流弧菌的相似度达到100%,说明在5、25 ℃条件下,新鲜大黄鱼的优势腐败菌分别为腐败希瓦氏菌(Shewanella putrefaciens KX822698)与河流弧菌(Vibrio fluvialis KX817289)。
李学英等[25]研究表明大黄鱼低温贮藏货架期终点时的优势腐败菌为腐败希瓦氏菌,其次为假单胞菌;郭全友等[26]研究认为大黄鱼在室温下特定腐败菌为弧菌和肠杆菌,出现肠杆菌可能与水产品生长的水质和环境有关;Zhu Junli等[8]研究得出贮藏初期新鲜大黄鱼中腐败希瓦氏菌占29%,弧菌属占22.6%,经过5 d、4 ℃贮藏,腐败希瓦氏菌比例可上升到72.1%,弧菌属比例下降到7%;另外,朱苏琴等[27]的研究证实河流弧菌能很好地黏附于大黄鱼的黏液,室温下黏液中的河流弧菌很容易加速大黄鱼的腐败变质,也与本研究分离得出的新鲜大黄鱼中优势腐败菌为腐败希瓦氏菌与河流弧菌结果相一致。
2.3 腐败菌碳源利用的差异性
2.3.1 腐败菌对总体碳源的利用
图4 2 种腐败菌在不同温度下总体碳源利用情况Fig. 4 Overall carbon source utilization by the spoilage bacteria at different temperatures
由图4可知,5 ℃条件下2 种腐败菌的总体能源利用率低于25 ℃,5 ℃腐败希瓦氏菌AWCD是25 ℃时的2/3,5 ℃河流弧菌的AWCD是25 ℃时的1/7;5 ℃时腐败希瓦氏菌的AWCD大于河流弧菌,在5 ℃时河流弧菌的AWCD仅为0.13,利用能源的能力减弱,生长受到抑制;25 ℃时河流弧菌的AWCD是腐败希瓦氏菌的2.3 倍,生长繁殖快。
表1 2 种腐败菌的动力学参数及其拟合优度Table 1 Kinetic parameters and goodness of fit for the spoilage bacteria
通过Gompertz方程计算得出能源利用的动力学参数。由表1可知,2 种腐败菌在5 ℃碳源条件下的最大比生长速率均小于25 ℃,延滞期均大于25 ℃时。在5 ℃时腐败希瓦氏菌较早进入指数期增长,最大比生长速率是河流弧菌的4 倍;25 ℃时,腐败希瓦氏菌的最大比生长速率较大,为(0.074±0.014)h-1,河流弧菌为(0.029±0.002)h-1。证明了在25 ℃条件下,腐败菌最大比生长速率逐渐增加,延滞期缩短,促进了腐败菌的生长,从而加速了大黄鱼的腐败。在5 ℃时腐败希瓦氏菌能更好地利用碳源,25 ℃时河流弧菌能更好地利用碳源,碳源利用的结果与5、25 ℃分离出的优势腐败菌结果相符,说明温度是影响碳源利用的因素,碳源利用率受限,生长繁殖也受到抑制。
2.3.2 腐败菌碳源利用的种类分析
图5 腐败菌在不同温度下总体能源利用种类Fig. 5 Carbon source utilization profiles of the spoilage bacteria at 5 and 25 ℃
由图5可知,在5 ℃与25 ℃时,河流弧菌都能较好地利用单糖、多糖、羧酸和氨基酸,其对单糖(27.50%、27.78%)、多糖(26.32%、24.45%)的利用率相对稳定,25 ℃时对氨基酸的利用率下降到16.13%,对羧酸的利用率上升到14.02%,碳源利用种类没有发生改变;腐败希瓦氏菌在5 ℃条件下主要利用单糖(17.22%)、多糖(22.57%)、羧酸(33.53%)和酯类(15.67%),在25 ℃时,利用的碳源为单醣、多糖、羧酸和氨基酸,其中氨基酸的利用率相较5 ℃的4.22%上升到18.09%,酯类的利用率明显减少到4.19%。2 种腐败菌各类碳源在相同温度下利用率差异显著(P<0.05)。
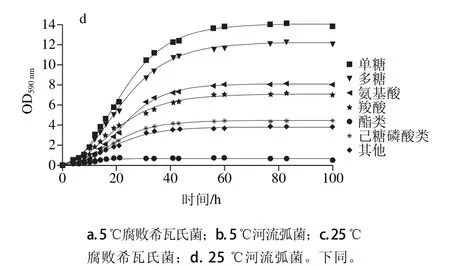
图6 腐败菌在不同温度下各类碳源的利用曲线Fig. 6 Carbon source utilization curves at different temperatures
由图6可知,在5 ℃条件下,腐败希瓦氏菌在各碳源条件下的最大比生长速率从大到小为多糖(0.31 h-1)、酯类(0.19 h-1)、羧酸(0.16 h-1)、单糖(0.12 h-1)和氨基酸(0.079 h-1);河流弧菌各种碳源条件下的最大比生长速率从大到小为多糖(0.027 h-1)、单糖(0.024 h-1)、氨基酸(0.022 h-1)和羧酸(0.019 h-1);腐败希瓦氏菌各类碳源下的最大比生长速率均高于河流弧菌,说明河流弧菌的各类碳源利用在5 ℃受到抑制。25 ℃时腐败希瓦氏菌在单糖、多糖、氨基酸和羧酸下的最大比生长速率均大于河流弧菌,其中在羧酸下的最大比生长速率最大(1.24 h-1),腐败希瓦氏菌利用碳源的速率大于河流弧菌,但对各类能源的利用量少于河流弧菌。
郭全友等[11]对轻腌青鱼货架期终点葡萄球菌的碳源利用情况进行了研究,结果显示该种腐败菌主要利用单糖、多糖、氨基酸及羧酸,与本研究中河流弧菌利用的碳源种类相似,与腐败希瓦氏菌的主要利用能源不同,表明不同腐败菌的碳源利用种类存在差异,同种腐败菌不同温度下的利用种类、比生长速率、延滞期都存在差异。
2.3.3 腐败菌对各类碳源利用的差异性
2.3.3.1 多糖利用
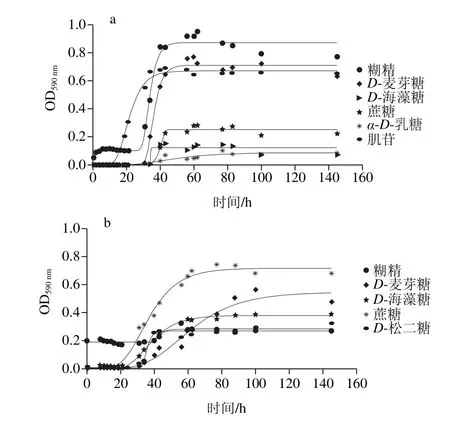
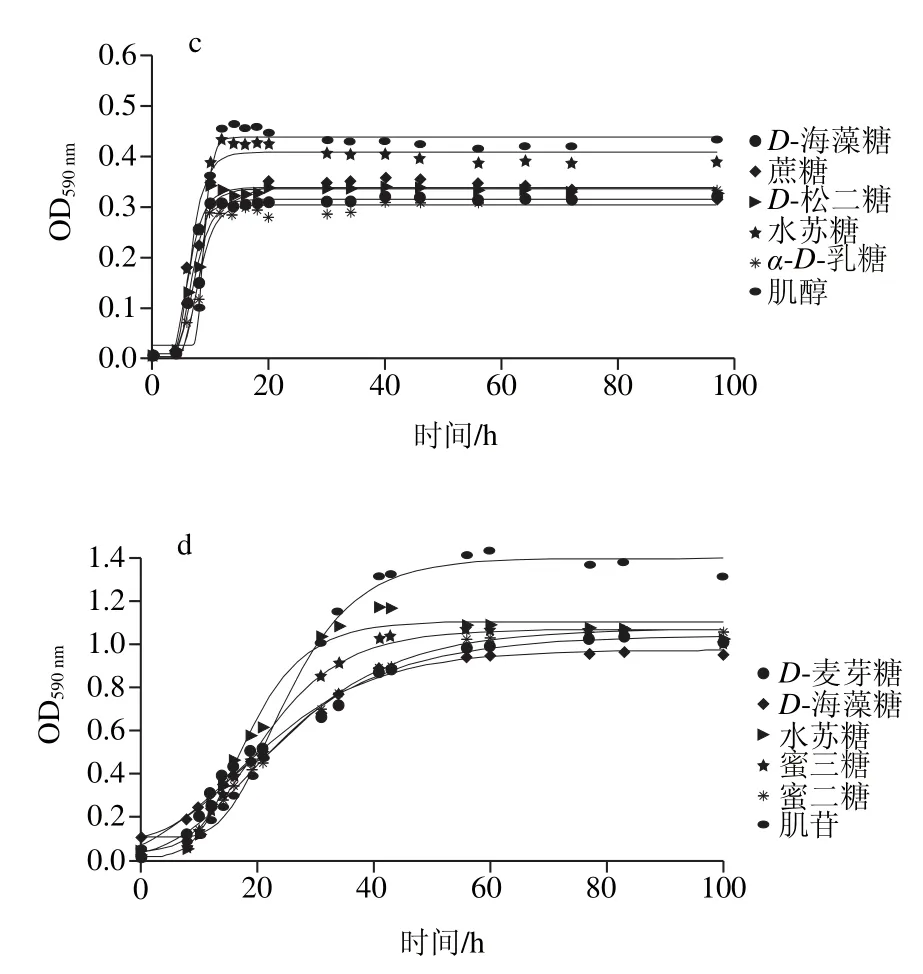
图7 腐败菌在不同温度下对多糖利用的曲线Fig. 7 Polysaccharide utilization curves of the dominant spoilage bacteria at different temperatures
从图7可知,在5 ℃条件下,2 种腐败菌都能利用肌苷和D-海藻糖;其中,腐败希瓦氏菌能利用蔗糖、糊精和D-乳糖,河流弧菌还能利用D-麦芽糖、水苏糖、蜜二糖和蜜三糖。在25 ℃条件下,2 种腐败菌都能利用蔗糖、D-海藻糖、D-麦芽糖;其中,腐败希瓦氏菌还能利用D-乳糖、水苏糖和肌醇;河流弧菌还能利用糊精、D-松二糖。D-海藻糖是2 种腐败菌都能利用的多糖,有研究表明[28]海藻糖能够提高酵母菌的抗冻性,高浓度的海藻糖能够使酵母菌在低温时仍然保持活性,同样低温时D-海藻糖也可以给腐败菌提供部分能量。
通过Gompertz模型拟合图7曲线,得到的动力学参数比较显示,5 ℃条件下,腐败希瓦氏菌在糊精中的最大比生长速率最大((0.087±0.016)h-1)且利用量最大,在肌苷中的延滞期最短((13.778±0.649)h);河流弧菌在蔗糖中的最大比生长速率最大((0.024±0.010)h-1)且延滞期最短((20.8±1.85)h)。说明糊精和蔗糖分别为2 种腐败菌在5 ℃条件下最容易利用的多糖。在25 ℃条件下,腐败希瓦氏菌在肌醇中的最大比生长速率最大((0.1698±0.031)h-1),且利用量最大,对蔗糖利用延滞期最短((3.63±0.61)h);河流弧菌在水苏糖中的最大比生长速率最大((0.059±0.006)h-1),在D-麦芽糖中的延滞期最短((0.024±0.001)h)。说明肌醇和水苏糖是2 种腐败菌在25 ℃条件下最容易利用的多糖。同种腐败菌不同温度下对多糖利用的种类大致相同,室温时能利用的种类更多,最大比生长速率更大;不同腐败菌相同温度下能利用的多糖种类有所不同,2 种温度条件下腐败希瓦氏菌多糖利用的速率均大于河流弧菌。
2.3.3.2 单糖利用
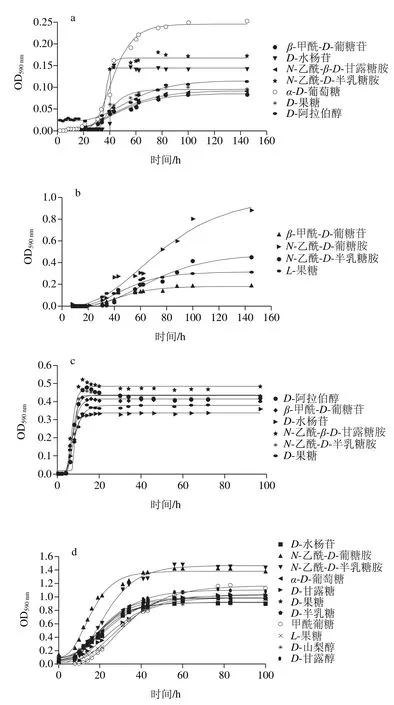
图8 腐败菌在不同温度下对单糖利用生长曲线Fig. 8 Monosaccharide utilization curves of the dominant spoilage bacteria at different temperatures
由图8可知,在5、25 ℃条件条件下,腐败希瓦氏菌都能利用D-阿拉伯醇、β-甲酰-D-葡糖苷、D-水杨苷、N-乙酰-β-D-甘露糖胺、N-乙酰-D-半乳糖胺、D-果糖;5 ℃条件下还能利用α-D-葡萄糖。
在5 ℃条件下,河流弧菌能利用的单糖有:N-乙酰-D-葡糖胺、N-乙酰-D-半乳糖胺、L-果糖,在25 ℃条件下,还能利用D-水杨苷、α-D-葡萄糖、D-甘露糖、D-果糖、D-甘露醇。2 种腐败菌能共同利用的多糖为D-果糖、N-乙酰-D-半乳糖胺。
拟合得到图8曲线,动力学参数比较显示,在5 ℃条件下,腐败希瓦氏菌在D-水杨苷中的最大比生长速率最大((0.37±0.000 3)h-1),在N-乙酰-β-D-甘露糖胺中的延滞期最短((17.319±3.141)h);河流弧菌在N-乙酰-D-葡糖胺中的最大比生长速率最大((0.010 4±0.001 1)h-1)且延滞期最短((22.538±4.03)h)。说明腐败希瓦氏菌生长初期受N-乙酰-β-D-甘露糖胺作用,生长过程中D-水杨苷更容易被利用,而N-乙酰-D-葡糖胺则是河流弧菌生长繁殖中最容易利用的单糖。
在25 ℃条件下,腐败希瓦氏菌在D-阿拉伯醇中的最大比生长速率最大((0.180±0.063)h-1),在D-果糖中的延滞期最小((3.98±0.892)h);河流弧菌在N-乙酰-D-葡糖胺中的最大比生长速率最大((0.064±0.005)h-1)且延滞期最短((5.46±1.13)h)。说明腐败希瓦氏菌生长初期最先利用D-果糖,生长过程中D-阿拉伯醇更易被利用。
腐败希瓦氏菌在5 ℃条件下单糖利用的种类与25 ℃大致相同,但利用效率较25 ℃低;河流弧菌在5 ℃条件下单糖的利用种类少于25 ℃,5 ℃时能利用的单糖在25 ℃时的利用效率占前几位。腐败希瓦氏菌在2 种温度条件下利用速率最大、延滞期最短的单糖均不相同。
2.3.3.3 腐败菌对氨基酸的利用
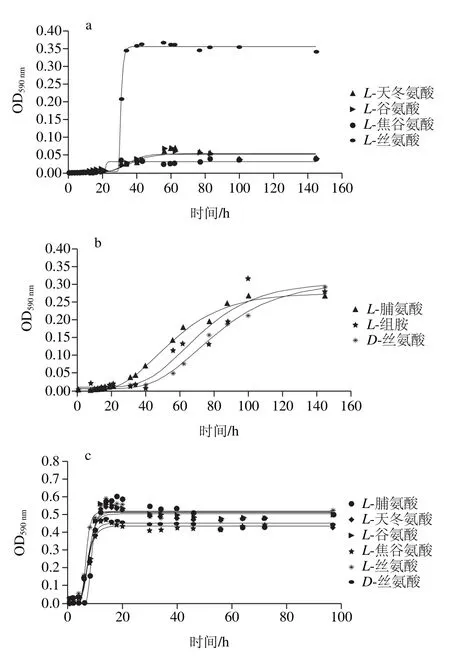
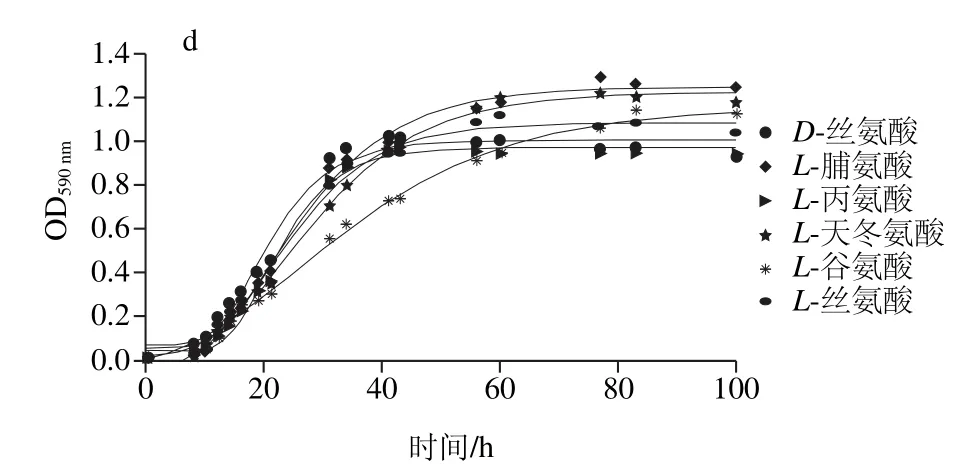
图9 腐败菌在不同温度下对氨基酸利用生长曲线Fig. 9 Amino acid utilization curves of the spoilage bacteria at different temperatures
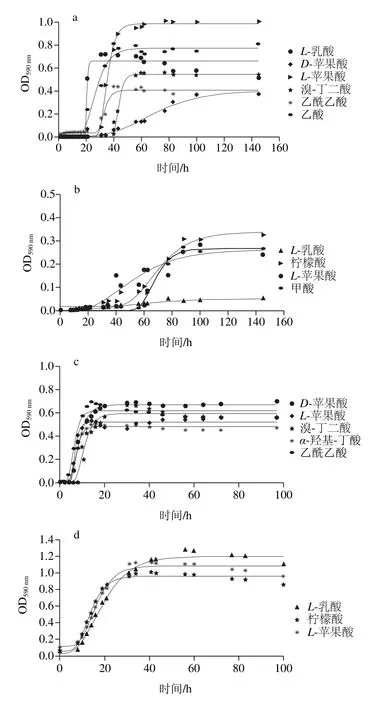
图10 腐败菌在不同温度下对羧酸利用生长曲线Fig. 10 Carboxylic acid utilization curves of the spoilage bacteria at different temperatures
由图9可知,在5 ℃条件下,腐败希瓦氏菌能够利用L-天冬氨酸、L-谷氨酸、L-丝氨酸、L-焦谷氨酸;在25 ℃条件下,还能利用D-丝氨酸、L-脯氨酸;在低温环境中,腐败希瓦氏菌氨基酸的利用效率比25 ℃时显著下降。在5 ℃条件下,河流弧菌能利用的氨基酸为L-脯氨酸、D-丝氨酸和L-组胺;在25 ℃条件下,还能利用L-丙氨酸、L-天冬氨酸、L-谷氨酸。
拟合得到图9曲线,动力学参数比较显示,在5 ℃条件下,腐败希瓦氏菌在L-丝氨酸中最大比生长速率最大((0.013 6±0.005 0)h-1),在L-焦谷氨酸中延滞期最短((20.96±1.601)h);河流弧菌在L-脯氨酸中的最大比生长速率最大((0.004 6±0.001)h-1),且延滞期最短((25.20±2.14)h)。说明腐败希瓦氏菌生长初期先利用L-焦谷氨酸,L-丝氨酸在生长过程中更容易被利用。L-脯氨酸为5 ℃条件下河流弧菌最容易利用的氨基酸。
在25 ℃条件下,腐败希瓦氏菌在L-脯氨酸中最大比生长速率最大((0.117 2±0.064)h-1),在L-焦谷氨酸中延滞期最短((0.67±0.006)h);河流弧菌在D-丝氨酸中最大比生长速率最大((0.049±0.005)h-1),在L-谷氨酸中延滞期最短((5.39±2.03)h)。2 种温度下,腐败希瓦氏菌对L-焦谷氨酸的延滞期均最短,说明L-焦谷氨酸在腐败希瓦氏菌生长繁殖初期为主要氨基酸供给。
2 种腐败菌都能利用丝氨酸,研究显示丝氨酸在使细菌适应厌氧环境时起重要作用[29]。据研究表明[30]养殖大黄鱼肌肉中的氨基酸含量较多的为谷氨酸(9.67 mg/100 mg)、天冬氨酸(5.68 mg/100 mg)、赖氨酸(4.76 mg/100 mg),由此可知并非氨基酸含量越高,腐败菌就利用的越多,腐败菌对于氨基酸的利用,还受到其自身性质的影响。
2.3.3.4 腐败菌对羧酸的利用
由图10可知,在5 ℃条件下,腐败希瓦氏菌能够利用L-苹果酸、D-苹果酸、溴-丁二酸和乙酰乙酸;在25 ℃条件下,腐败希瓦氏菌能够利用L-苹果酸、D-苹果酸、溴-丁二酸、乙酰乙酸和乙酸。在5 ℃条件下,河流弧菌能够利用L-乳酸、柠檬酸、L-苹果酸和甲酸;在25 ℃条件下,河流弧菌能够利用L-乳酸、柠檬酸、L-苹果酸。在2 种温度条件下,2 种腐败菌都能利用的羧酸为L-苹果酸。
通过Gompertz模型拟合图10曲线,得到的动力学参数比较显示,在5 ℃条件下,腐败希瓦氏菌在L-苹果酸中最大比生长速率最大((0.090±0.006)h-1),在乙酸中延滞期最短((18.10±1.360)h);河流弧菌在甲酸中最大比生长速率最大((0.012±0.001)h-1),在L-乳酸中延滞期最短((13.23±3.31)h)。说明在5 ℃时腐败希瓦氏菌的生长初期先利用乙酸,之后L-苹果酸最容易被利用;河流弧菌的生长先利用L-乳酸,在生长过程中甲酸更容易被利用。
在25 ℃条件下,腐败希瓦氏菌在L-苹果酸中的最大比生长速率最大((0.140±0.02)h-1)且延滞期最短((3.801±0.735)h);河流弧菌在柠檬酸中的最大比生长速率最大((0.073±0.006)h-1),且延滞期最短((7.42±0.78)h)。说明25 ℃时L-苹果酸和柠檬酸分别为2 种腐败菌最容易利用的羧酸。
2.3.3.5 腐败菌对酯类的利用
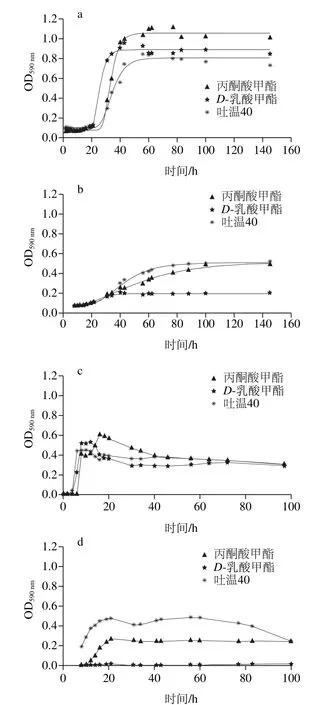
图11 腐败菌在不同温度下对酯类利用生长曲线Fig. 11 Ester utilization curves of the spoilage bacteria at different temperatures
由图11可知,在5 ℃条件下,腐败希瓦氏菌能较好地利用丙酮酸甲酯、D-乳酸甲酯和吐温40,最大比生长速率分别为(0.088±0.001 2)、(0.089±0.002 3)h-1和(0.043±0.002 2)h-1,说明D-乳酸甲酯为腐败希瓦氏菌生长过程中最容易被利用的酯类。而河流弧菌对酯类的利用很低,酯类并非河流弧菌生长主要利用的碳源。曾有学者[31-32]利用月桂酸单甘油酯微乳液制成复合保鲜剂;利用油酸乙酯、吐温80、戊醇制备O/W型微乳液抑制腐败菌的生长。为此,可通过腐败菌对酯类的利用情况,为进一步研究O/W型复合保鲜剂提供了科学依据。
3 结 论
本实验研究了新鲜大黄鱼在不同温度下,其优势腐败菌对碳源利用、动力学的差异性,得到结论为:温度影响了大黄鱼的货架期,5 ℃时货架期为(9.0±1.0)d,25 ℃时货架期为(1.0±0.11)d。
5 ℃货架期终点时的优势腐败菌为腐败希瓦氏菌,25 ℃时货架期终点的优势腐败菌为河流弧菌。
腐败希瓦氏菌在5 ℃时能更好地利用碳源,河流弧菌在25 ℃时能更好地利用碳源,碳源利用的结果与5、25 ℃分离出的优势腐败菌结果相符。低温使碳源利用率受限,生长繁殖受到抑制。
5 ℃时腐败希瓦氏菌主要利用的碳源种类为单醣、多糖、羧酸和酯类,河流弧菌为单醣、多糖、羧酸和氨基酸。25 ℃时腐败希瓦氏菌和河流弧菌都主要利用单糖、多糖、羧酸和氨基酸。5 ℃条件下糊精和蔗糖分别为腐败希瓦氏菌和河流弧菌最容易利用的多糖;25 ℃时肌醇和水苏糖是腐败希瓦氏菌和河流弧菌最容易利用的多糖。2 种腐败菌能够共同利用的单糖为D-果糖、N-乙酰-D-半乳糖胺。5 ℃时腐败希瓦氏菌对氨基酸的利用率明显下降,25 ℃时2 种腐败菌能够共同利用的氨基酸为L-脯氨酸、L-天冬氨酸、L-谷氨酸和D-丝氨酸。5、25 ℃时2 种腐败菌能共同利用的羧酸种类较少,为L-苹果酸。在5 ℃条件下,腐败希瓦氏菌能较好地利用丙酮酸甲酯、D-乳酸甲酯和吐温40。
本研究通过2 种温度环境条件下,腐败希瓦氏菌、河流弧菌对碳源利用的差异性分析,研究了2 种腐败菌的生长、底物利用及其动力学模型,以期在今后可以通过调节共同利用的底物碳源因子,或通过研制复合保鲜剂抑制腐败菌的生长,适当延长大黄鱼产品的货架期。

