纳升液相色谱-高分辨串联质谱研究不同分离方法对唾液外泌体蛋白质组的影响
曾琼兰 吴 利 李水明 王 勇*
1(深圳大学生命科学学院,深圳市海洋生物资源与生态环境重点实验室,深圳518060)2(深圳大学生命科学学院,深圳市微生物基因工程重点实验室,深圳518060)
1 引 言
外泌体是一种直径为30~100 nm的脂质包裹体结构,在透射电子显微镜下呈现杯状[1],存在于血液、尿液和唾液等多种体液中[2],包含DNA片段、蛋白质、mRNA和microRNA等物质[3]。越来越多的证据表明,宿主细胞或肿瘤细胞分泌的外泌体参与了肿瘤发生、生长、侵袭和转移,可以作为生物指标进行研究[4~6]。Rabinowits等[7]基于全基因组表达检测,提出外泌体miRNA可以作为肺癌的诊断标记之一。另外,有研究者认为外泌体功能包括细胞信号传导、移除不需要的蛋白质以及细胞间病原体的转移,利用这一途径的一种病原体是朊病毒,它是一种传染性颗粒,负责传染性神经退行性疾病[8]。Street等[9]在人脑脊液中鉴定到外泌体,并且认为其可能是一些脑神经失调疾病扩散发展的病因,例如阿尔茨海默病(Alzheimer′s disease, AD)。
唾液外泌体的分离方式包括超高速离心法[10]、密度梯度离心法[11]、凝胶过滤法[12,13]、免疫亲和捕获法[14]和基于聚合物的沉淀方法[15]等。其中凝胶过滤、密度梯度离心法耗时长,过程繁琐; 免疫亲和捕获法由于有些标记还未知,会导致外泌体产量较低; Zlotogorski-Hurvitz等[15]发现超高速离心(Ultracentrifugation,UC)和唾液外泌体试剂盒(ExoQuick,EQ)方法均能够有效分离唾液外泌体。
外泌体分析目前多采用酶联免疫吸附(ELISA)方法,而采用蛋白质组学方法分析的报道较少[14,16,17],Gonazale-Begne等较早开展了唾液外泌体蛋白质的质谱分析工作[10,13],但所使用的唾液体积分别为30、35 mL,样品需求量大,在临床上难以实现。本研究组曾采用纳升液相色谱-高分辨率串联质谱对唾液的多肽组学开展研究[18]。本研究采用Nano LC-MS探究唾液外泌体试剂盒(EQ)和超高速离心(UC)分离外泌体的效果及尿素缓冲液、RIPA裂解液、SDS裂解液提取外泌体蛋白质的效果。
2 实验部分
2.1 仪器与试剂
EksigentnanoLC-UltraTM2D系统、TripleTOF 5600 plus 高分辨质谱仪、Protein Pilot 4.5软件(美国 AB SCIEX公司); 真空冷冻干燥机、超纯水仪(美国Thermo Scientific公司); C18反相色谱捕集柱(100 μm×3 cm, 3 μm, 15 nm, 美国Eksigent公司); C18反相色谱分析柱(75 μm ×15 cm, 3 μm, 12 nm, 美国Eksigent公司)。ekspertTMnanoLC 400纳升级液相色谱(美国 AB SCIEX公司),流动相A为0.1%甲酸-2%乙腈,流动相B为0.1%甲酸-98%乙腈; 所用试剂为质谱纯或优级纯,均购自美国Thermo Fisher公司; 唾液外泌体试剂盒(美国Invent Biotechnologies公司); BCA蛋白定量试剂盒和考马斯亮蓝法蛋白试剂盒(江苏海门碧云天公司); RIPA裂解液(北京博凌科为生物科技有限公司)。
2.2 实验方法
2.2.1外泌体的分离将健康人的全唾液样品在4℃以2600 g离心30 min,取上清液。(1)唾液外泌体试剂盒(EQ)方法 取0.6 mL唾液上清液置于管柱中, 室温14000 g离心2 min,高粘度唾液样品通过离心柱即可转化为非粘稠样品。取0.5 mL的上清液与外泌体沉淀试剂以2∶1的比例混合,4℃孵育过夜。然后在4℃,10000 g离心1 h。除去上清液,可见白色外泌体沉淀。使用高效非PEG配方的外泌体沉淀试剂,可从最少100 μL的唾液样品中有效沉淀外泌体。(2)超高速离心(UC)方法 取2 mL的唾液上清液,用PBS以1∶1的比例稀释唾液样品,加入蛋白酶抑制剂混合物(Roche complete tablet,Roche Diagnostics GmbH,Roche Applied Science,Mannheim,德国)。在4℃下10000 g离心70 min。用PBS重悬沉淀,4℃下100000 g离心70 min,底部沉淀即为外泌体。
2.2.2透射电子显微镜表征EQ、UC方法得到的沉淀用PBS重悬,各取10 μL外泌体,置于铜网上,用乙酸双氧铀染色,干燥后用透射电子显微镜观察。
2.2.3外泌体的破碎将EQ、UC方法得到的外泌体,分别用100 μL尿素缓冲液(50 mmol/L Tris-HCl, 8 mol/L UREA,2 mol/L硫脲,1 mmol/L DTT,pH=7.5)、100 μL RIPA裂解液、100 μL SDS裂解液(4% SDS,100 mmol/L Tris,pH=7.6)重悬,分别加上5 μL的蛋白质酶抑制剂混合物。RIPA裂解液重悬外泌体沉淀后,置于冰上10 min。尿素缓冲液重悬外泌体后,超声处理5 min。SDS裂解液重悬外泌体后,95℃加热10 min,超声处理5 min,16500 g离心10 min,取上清液。
2.2.4一维SDS-PAGE电泳将外泌体蛋白质与上样缓冲液以一定的比例混匀,沸水浴5 min。加载到配制好的十二烷基磺酸钠-聚丙烯酰胺凝胶中,电泳,使用预染色的蛋白质标准品追踪蛋白质迁移,所得凝胶用考马斯亮蓝R250染色。
2.2.5唾液外泌体蛋白质的定量使用BCA试剂盒测量用SDS裂解液和RIPA裂解液重悬的外泌体蛋白质浓度。尿素缓冲液重悬的外泌体使用考马斯亮蓝染色Brodford法测定蛋白质浓度。
2.2.6唾液外泌体蛋白质酶切步骤分别取10 μg外泌体蛋白质,采用Filter-aided proteome preparation (FASP)方法[19],经还原烷基化,按照蛋白质-胰酶(40∶1,m/m)的比例加胰酶,在37℃水浴中放置过夜,酶切溶液冷冻干燥。
2.2.7纳升液相色谱-TripleTOF质谱分析将冻干的多肽样品用流动相A 溶解。在线 Nano-RPLC 液相色谱在EksigentnanoLC-UltraTM2D 系统上进行,样品以2 μL/min的流速上样到C18预柱上(100 μm ×3 cm, 3 μm, 15 nm),以2 μL/min流速冲洗脱盐10 min。分析柱为C18反相色谱柱(75 μm×15 cm, 3 μm, 12 nm),梯度洗脱: 0~42 min, 5%~25% B; 42~56 min, 25%~40% B; 56~64 min, 80% B; 64~70 min, 5% B。质谱分析采用TripleTOF 5600系统(AB SCIEX) 结合纳升喷雾Ⅲ离子源(AB SCIEX),喷雾电压2. 4 kV,气帘气压30 psi,雾化气压5 psi,加热温度150℃,一级TOF-MS单张图谱扫描时间为250 ms,每次IDA循环下最多采集35个电荷为2+~8+,且单秒计数大于100的二级图谱,每张二级图谱的累积时间为80 ms。每次循环时间固定为2.5 s。
2.2.8数据分析采集到的质谱原始wiff图谱文件,采用Protein Pilot Software v.4.5(AB SCIEX,USA)软件进行数据加工处理和检索分析,数据库为uniprot库中的Homo sapiens人种专一数据库(包含20210条蛋白质序列,2015年1月2日下载),检索参数设置为胰蛋白酶酶切、磷酸化强调和生物学修饰,检索方式为彻底分析,假阳性率控制为1% FDR。
2.2.9生物信息学分析蛋白质聚类分析在FunRich(http://www.funrich.org/)软件进行分析,可以分析蛋白质参与的通路、细胞功能和细胞成分等。
3 结果与讨论
3.1 唾液外泌体的形态特征
使用透射电子显微镜观察UC和EQ方法所富集到的外泌体的形状。如图1所示,A图和B图视野中的外泌体直径为30~100 nm,呈现杯状的脂质包裹体结构,说明UC和EQ这两种方法分离的外泌体形态无明显差异。
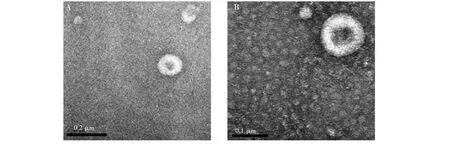
图1 使用UC方法从唾液中分离的外泌体(A)和使用EQ方法从唾液中分离的外泌体 (B) 的透射电镜图Fig.1 Transmission electron micrographs of exosomes isolated from saliva by ultracentrifugation (UC) (A) and ExoQuick (EQ) method (B)
3.2 一维 SDS-PAGE分离唾液和外泌体蛋白质的电泳条带分析
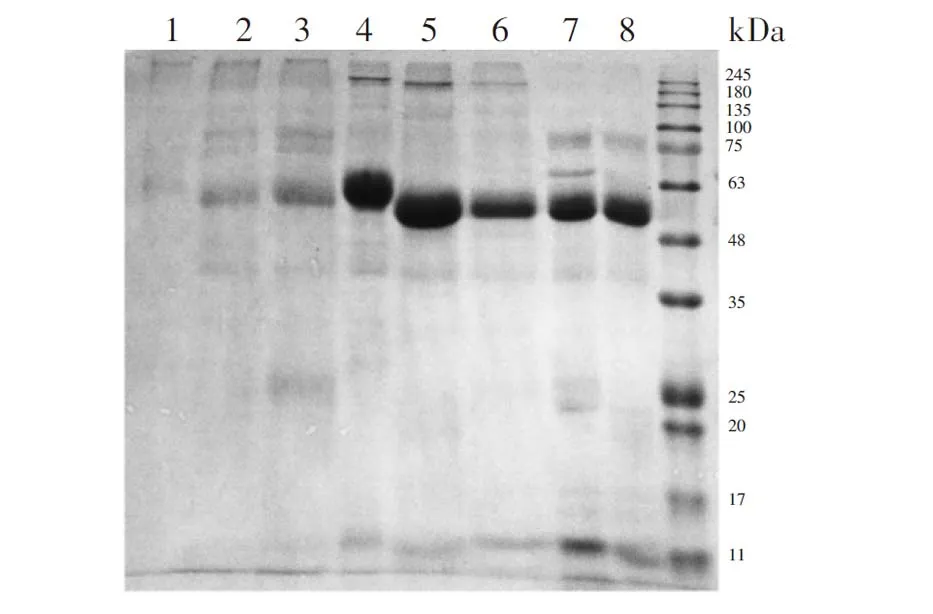
图2 一维SDS-PAGE分离唾液和外泌体蛋白质条带Fig.2 Saliva and exosome protein bands with one dimensional sodium dodecyl sulfate-polyacrylamide gel electrophoresis (SDS-PAGE)(1)UC+UREA方法; (2)UC+SDS方法; (3)UC+RIPA方法; (4)EQ+UREA方法; (5)EQ+SDS方法; (6)EQ+RIPA方法; (7)全唾液; (8)EQ唾液(1) UC+UREA method; (2) UC+SDS method; (3) UC+RIPA method; (4) EQ+UREA method; (5)EQ+SDS method; (6)EQ+RIPA method; (7) Whole saliva; (8) EQ saliva
比较了UC和EQ方法对唾液外泌体的分离效果以及尿素缓冲液、RIPA裂解液、SDS裂解液对外泌体蛋白质的提取效果,每种方法重复3次,尿素缓冲液破碎外泌体的方法用“UREA”表示,“RIPA”表示RIPA裂解液,“SDS”表示SDS裂解液。本研究的6种方法组合分别是:UC+UREA、UC+RIPA、UC+SDS、EQ+UREA、EQ+RIPA、EQ+SDS。
唾液和外泌体蛋白质的1D SDS-PAGE如图2所示,泳道1~6分别为UC+UREA、UC+SDS、UC+RIPA、EQ+UREA、EQ+SDS和EQ+RIPA方法所富集的外泌体蛋白; 泳道7为唾液分离的蛋白; 泳道8为唾液外泌体试剂盒方法富集外泌体步骤(2)离心所得的不粘稠唾液分离的蛋白,标记为EQ唾液。在49~63 kDa范围内发现,泳道1、2、3和泳道4、5、6、7、8的条带有显著的明暗度差异,该范围主要是唾液淀粉酶[20],即UC和EQ方法均未能除去唾液淀粉酶; 前者经过差速离心,去除唾液淀粉酶的效果优于后者,但UC法特异性减少唾液淀粉酶,且所有蛋白质的回收率均较低,均需进一步分析。
3.3 蛋白质含量和数目的重现性分析
根据Brodford法和BCA定量分析结果与质谱分析结果分析UC+UREA、UC+RIPA、UC+SDS、EQ+UREA、EQ+RIPA和EQ+SDS方法提取到的外泌体蛋白质含量和数目,如表1所示,蛋白质含量为Brodford法或BCA定量结果,蛋白质数目是质谱鉴定结果。这6种方法蛋白质含量的RSD(n=3)分别为9.7%、1.8%、6.5%、1.7%、3.7%和4.8%,蛋白质数目的RSD(n=3)分别为7.0%、2.1%、71.7%、1.4%、9.0%和15.8%。EQ+UREA的RSD值均最低,分别是1.7%、1.4%,重复性最佳。
表1 6种方法提取的外泌体蛋白质含量和数目
Table 1 Detection results of protein content and number of exosomes by six methods
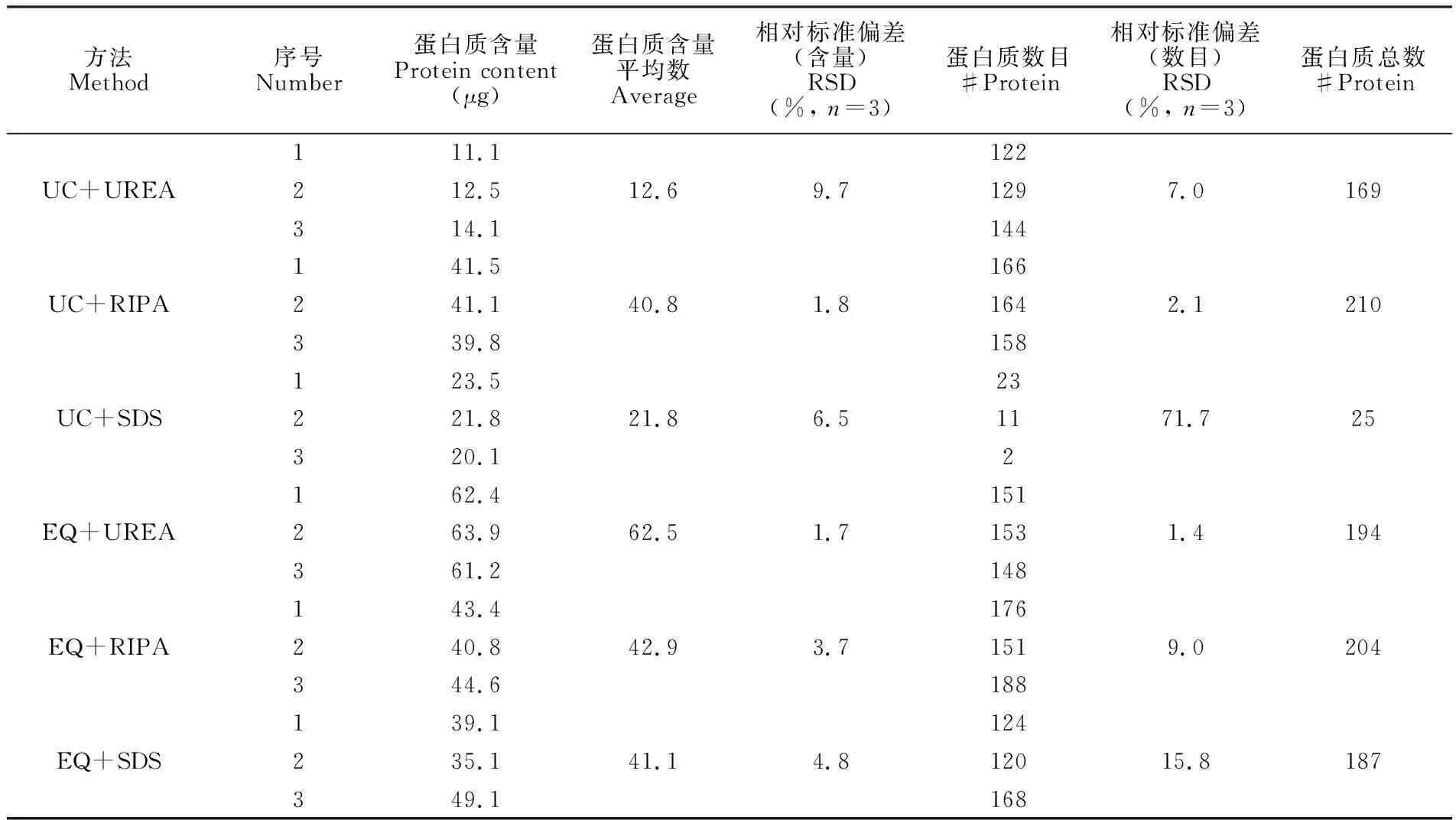
方法Method序号Number蛋白质含量Protein content(μg)蛋白质含量平均数Average相对标准偏差(含量)RSD(%, n=3)蛋白质数目#Protein相对标准偏差(数目)RSD(%, n=3)蛋白质总数#Protein111.1122UC+UREA212.512.69.71297.0169314.1144141.5166UC+RIPA241.140.81.81642.1210339.8158123.523UC+SDS221.821.86.51171.725320.12162.4151EQ+UREA263.962.51.71531.4194361.2148143.4176EQ+RIPA240.842.93.71519.0204344.6188139.1124EQ+SDS235.141.14.812015.8187349.1168
由1D SDS-PAGE分离唾液和外泌体蛋白质的电泳条带图(图2)可见,6种方法均提取到了蛋白质。从表2可知,UC+SDS方法的3次重复实验的蛋白质数目分别是23、12和2,RSD为71.7%,EQ+SDS方法的为124、120和168,RSD为15.8%,说明使用SDS裂解液提取外泌体蛋白质对后续的质谱分析结果影响很大。Wišniewski等[19]使用SDS裂解液处理培养的细胞、小鼠肝脏和脑组织,结合FASP法,能够有效使用液相色谱-电喷雾串联质谱进行分析,但本研究提示SDS裂解法不适于外泌体蛋白质的分析。
表2 6种方法的外泌体蛋白质的LC-MS/MS鉴定结果
Table 2 Liquid chromatography-tandem mass spectrometry (LC-MS/MS) analysis of proteins of exosomes by six methods
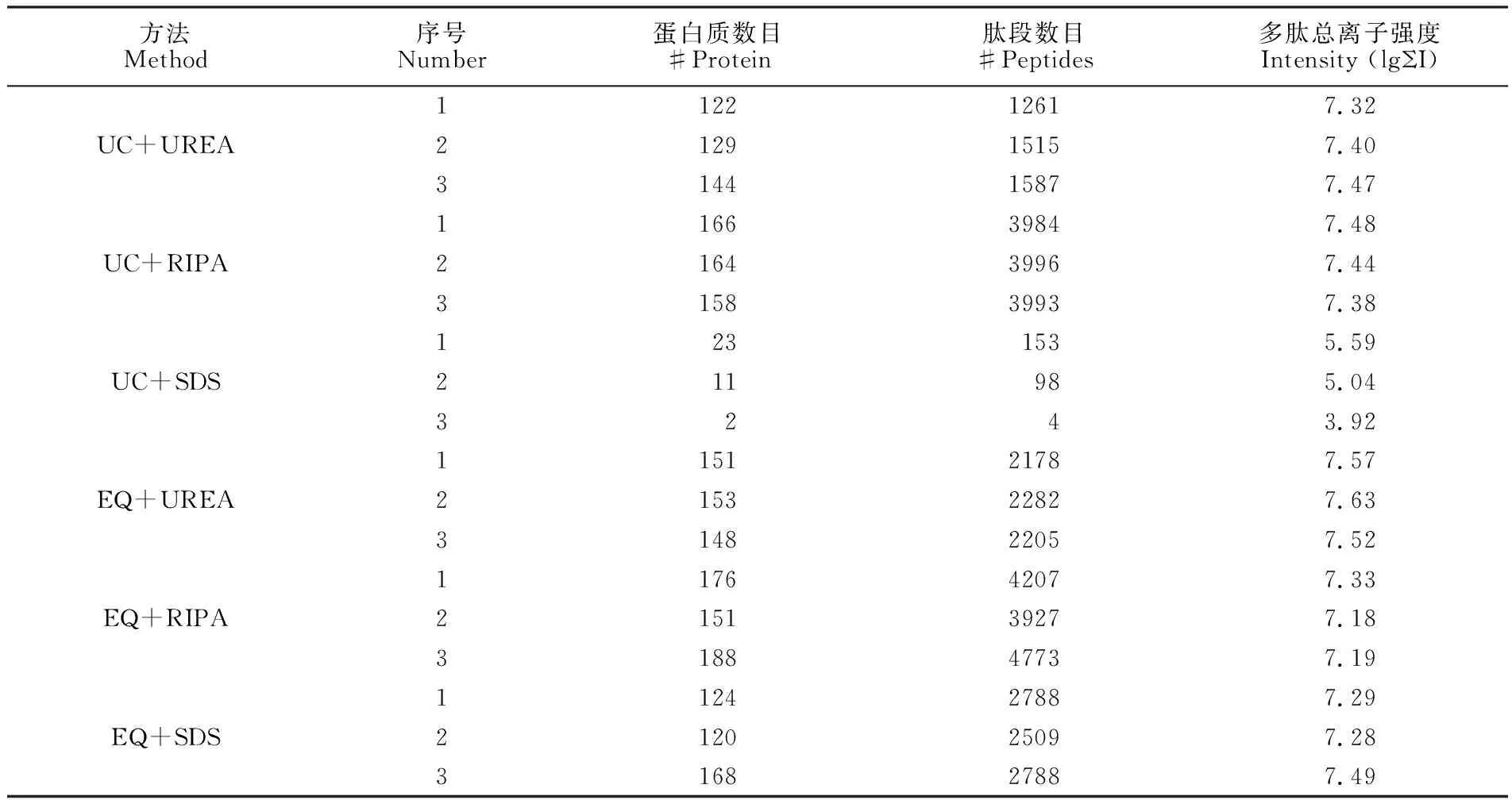
方法Method序号Number蛋白质数目#Protein肽段数目#Peptides多肽总离子强度Intensity (lgΣI)UC+UREAUC+RIPAUC+SDSEQ+UREAEQ+RIPAEQ+SDS112212617.32212915157.40314415877.47116639847.48216439967.44315839937.381231535.59211985.043243.92115121787.57215322827.63314822057.52117642077.33215139277.18318847737.19112427887.29212025097.28316827887.49
3.4 6种方法的蛋白质含量、蛋白质数目、肽段数目和多肽总离子强度的显著性分析
EQ和UC方法处理的唾液样品体积分别为0.5和2.0 mL。蛋白质定量分析结果如图3A所示, EQ方法的蛋白质含量均比UC高,UREA和SDS方法均存在显著差异。从表1和图3A可知,EQ+UREA方法得到的蛋白质含量最高(62.5 μg),与EQ+RIPA和EQ+SDS相比均存在显著差异。
分析6种方法的蛋白质数目和肽段数目,如表2和图3所示,EQ方法的蛋白质数目和肽段数目均高于UC方法。EQ+RIPA和UC+RIPA方法在蛋白质数目和肽段数目上无显著差异,EQ+UREA和UC+UREA、EQ+SDS和UC+SDS存在显著差异。表明EQ富集外泌体的效果优于UC。
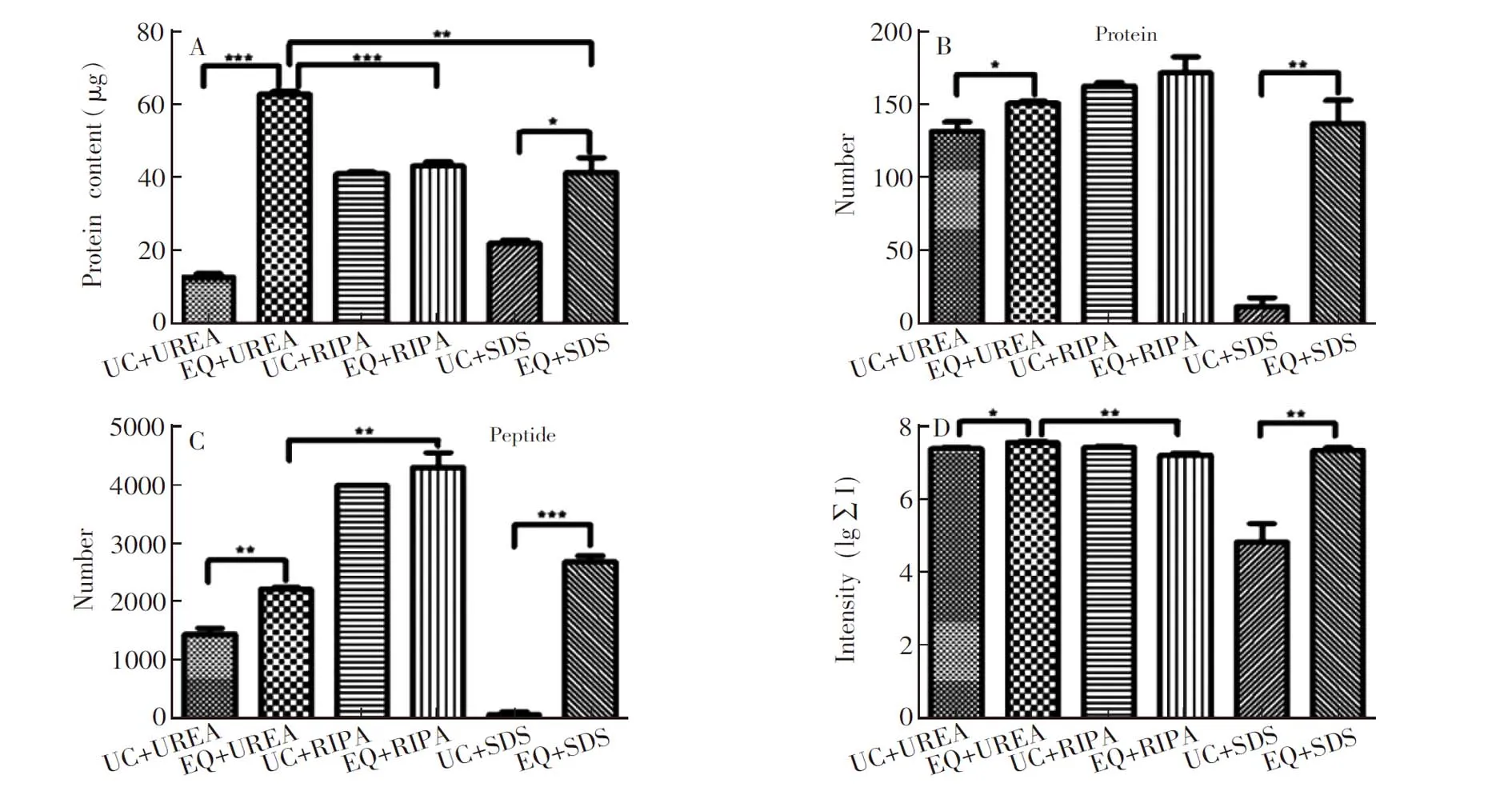
图3 6种方法分离提取的蛋白质含量、蛋白质数目、肽段数目和多肽总离子强度的显著性分析Fig.3 Significant analysis of protein content, number of protein and peptides, total peptide ionic intensity by six methods (***p<0.001,**p<0.01,*p<0.5)
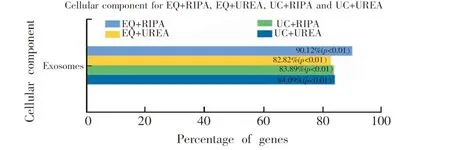
图4 UC+UREA、UC+RIPA、EQ+UREA、EQ+RIPA 4种方法的外泌体来源的蛋白质的基因比率Fig.4 Genetic ratio of exosome-derived proteins of UC+UREA、UC+RIPA、EQ+UREA、EQ+RIPA methods
比较EQ+UREA和EQ+RIPA的结果,EQ+UREA和EQ+RIPA的蛋白质数目不存在显著差异,但肽段数目存在显著差异。EQ+UREA和EQ+RIPA的3次重复测定的肽段数的平均值分别为2222和4302; 在RIPA裂解液提取的外泌体蛋白质中,蛋白质Alpha-amylase 1、Ig alpha-1 chain C、Ig alpha-2 chain C region、Deleted in malignant brain tumors 1 protein、Polymeric immunoglobulin receptor、Mucin-5B所对应的肽段数目较多,EQ+RIPA和EQ+UREA方法中属于以上7种蛋白质的肽段数目分别为56.82%和44.33%。即在EQ+RIPA中约1857个多肽属于除以上7种蛋白质的其它蛋白质,在EQ+UREA中约1237个多肽属于其它蛋白质。结果表明,EQ+RIPA方法虽然检测的肽段数目多,但并未增加蛋白质数目。从表2和图3D可知,EQ+UREA方法的多肽总离子强度最强,与EQ+RIPA存在显著性差异。
3.5 UC+UREA、UC+RIPA、EQ+UREA、EQ+RIPA方法检测到的蛋白质的GO分析
如图4所示,UC+UREA、UC+RIPA、EQ+UREA、EQ+RIPA方法的唾液外泌体来源的蛋白质的基因比分别为84.09%、83.89%、82.82%、90.12%。 这4种方法均能够很好地富集到外泌体蛋白质。Ogawa等[12]鉴定到唾液外泌体的蛋白质有187种, 用FunRich软件对187种蛋白质进行GO富集分析发现,起源于外泌体的蛋白质有130种,基因比为69.52%。
使用RIPA裂解液提取外泌体蛋白质有优点,亦存在不足,其操作方便,重悬外泌体后,置于冰上10 min即可。 试剂盒分离唾液外泌体与RIPA裂解液破碎外泌体的方法联用,鉴定到的蛋白质数目为204,90.12%的蛋白质来源于唾液外泌体,优于EQ+UREA方法。蛋白质定量结果表明,EQ+RIPA方法的蛋白质含量为42.9 μg,EQ+UREA方法为62.5 μg。EQ+RIPA方法的蛋白质含量和蛋白质数目的RSD值分别为3.7%和8.9%,EQ+UREA方法分别为1.7%和1.4%。因此,EQ+UREA方法的实验可重复性优于EQ+RIPA方法。目前尚未有报道使用RIPA裂解液提取外泌体蛋白质。在以往的研究中发现,RIPA裂解液用于样品蛋白质的提取,使某些蛋白质丢失,Ngoka等[21]采用质谱平行对比了乳腺癌 RIPA 可溶组分和不可溶组分的蛋白质图谱,发现不溶于RIPA的蛋白质可溶于UREA,蛋白质平均分子量比RIPA可溶性组分高 60%,即许多高分子量蛋白质被丢失在 RIPA 不可溶组分中。
本研究中所有实验均平行进行3次,UC+UREA、UC+RIPA、UC+SDS、EQ+UREA、EQ+RIPA、EQ+SDS的3次重复实验检测到的蛋白质数目分别是122、129、144; 166、164、158; 23、12、2; 151、153、148; 176、151、188; 124、120、168。UC+RIPA、EQ+UREA、EQ+RIPA得到的外泌体蛋白质种类无显著差异,但显著高于其它方法。外泌体蛋白质含量平均值分别为12.6、40.8、21.8、62.5、42.9和41.1 μg。EQ+UREA方法处理0.5 mL 唾液样品得到的外泌体蛋白含量最高。综上可知,EQ+UREA方法是富集外泌体和提取外泌体蛋白质的最佳方案。
4 结 论
采用纳升液相色谱-高分辨串联质谱方法对唾液外泌体进行蛋白质组学分析,建立了一种快速、样品用量少、 重复性好的唾液外泌体蛋白质组学分析方法。实验结果表明,唾液外泌体试剂盒富集外泌体的效果优于超高速离心方法,尿素缓冲溶液使得外泌体破膜后的实验更加稳定, 重复性更好,是筛选疾病外泌体生物标志物有效方法。
致谢: 感谢深圳大学西丽校区测试中心的支持。

