扶脾柔肝方对肝纤维化大鼠肝脏过氧化物酶体增殖物激活受体-γ与转化生长因子-β1表达的影响
安祯祥 何远利 王 敏 黄 丹 陈昱江
(贵阳中医学院第一附属医院,贵州 贵阳 550001)
肝纤维化(HF)是细胞外基质(ECM)在肝内过量沉积,是慢性肝病发展成为肝硬化的枢纽。而肝星状细胞(HSC)的表型转化和ECM的异常分泌在HF的发生发展进程中起着关键作用。过氧化物酶体增殖物激活受体(PPAR)-γ在HF过程中发挥重要的调控作用,是一种HSC里的配体激活转录因子,通过调控转化生长因子(TGF)-β/Smads信号通路,使ECM合成减少,以减缓HF发展,从而发挥拮抗HF作用〔1,2〕,是潜在的治疗HF的作用靶点〔3〕。扶脾柔肝方(FRF)是治疗肝硬化腹水的临床经验方,依据“肝脾相关”理论拟定,具有健脾柔肝,益气活血作用,在临床运用多年,有较好的疗效〔4~7〕。研究表明,FRF具有调节TGF-β1/Smads信号通路表达水平,降低α-平滑肌肌动蛋白(SMA),拮抗HF作用〔8,9〕。本文探讨FRF对HF大鼠肝组织PPAR-γ及TGF-β1表达的影响,进一步探讨其抗HF的可能作用机制。
1 材料与方法
1.1药物 FRF药物组成:黄芪30 g、麸炒白术30 g、苍术15 g、苡仁30 g、当归15 g、牛膝15 g、丹参30 g、莪术15 g、枳壳15 g(华润三九医药股份有限公司配方颗粒制剂,批号分别为1504001w,1502001w,1502001w,1502001s,1502002w,1502001w,1503002s,1503001w,1410001w),由我院中药房提供。扶正化瘀胶囊(上海黄海制药,国药准字Z200220073)。秋水仙碱片(云南玉溪制药,国药准字H53021904)。
1.2动物 SPF级SD大鼠,雌雄各半,5周龄,体重(180±20)g,许可证号:SCXK(渝)2012-005,动物及饲料均购自重庆腾鑫比尔实验动物销售有限公司。
1.3试剂 四氯化碳(CCl4,天津市光复科技发展有限公司,批号20120506);透明质酸(HA)、层黏连蛋白(LN)、Ⅳ型胶原(Ⅳ-C)、Ⅲ型前胶原N端肽(PⅢNP)(郑州安图生物技术有限公司,批号分别为20140709,20140720,20140816,20140702);SP试剂(河南赛诺特生物);十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶(PAGE)制备试剂盒(北京康为世纪 CW0022);PPAR-γ一抗(Santa公司,批号L0114);TGF-β1一抗(Immuno Way公司,批号YM3438);β-actin一抗、ECL荧光显影剂(康为世纪,批号分别为CW0096A,CW0048A);RNA提取试剂(北京天根生化,DP405-02)。
1.4仪器 HF指标检测仪器,ADC CLIA 400型(山东艾德康公司);涡旋振荡仪,QL-902型(江苏其林贝尔公司);qPCR仪,ABI 7500型(美国ABI公司);电泳仪,164-5050型(美国Bio-Rad公司);紫外分光光度计,NANODROP 2000型(美国Therno scientific公司)。
1.5动物分组、造模及给药 大鼠随机分为7组:正常对照组12只,模型组12只,秋水仙碱(0.2 mg/kg)组11只,扶正化瘀组(0.415 g/kg)11只,FRF大剂量(80 g/kg)组12只,FRF中剂量(40 g/kg)组11只,FRF小剂量(20 g/kg)组11只。造模方法参考文献〔10〕。HF标准参照文献〔11〕。50%CCl4橄榄油溶液背部皮下注射,剂量3 ml/kg,每周2次,实验第2周起按10 ml/kg灌胃30%乙醇,隔天1次。正常对照组予等量橄榄油背部皮下注射和生理盐水灌胃。造模10 w,第11~14周连续灌胃相应药物,剂量10 ml/kg。正常对照组及模型组灌胃生理盐水。实验结束后,禁食12 h,称重,腹主动脉采血,取血清,动物处死,留取肝脏组织备检测。
1.6血清HF指标检测 全自动化学发光免疫分析仪检测HA、LN、Ⅳ-C、PⅢNP。
1.7病理学检测 标本予甲醛固定,石蜡包埋,切片,苏木素-伊红(HE)染色,光镜下观察HF程度。
1.8免疫组化法检测肝组织中PPAR-γ的表达 操作按照免疫组化方法说明书进行。肝组织固定,切片,脱蜡,修复抗原,加羊血清工作液,加PPAR-γ一抗(1∶100),4℃孵育过夜,加二抗,二氨基联苯胺(DAB)显色,苏木素复染,封片,显微镜观察。阳性表达为有棕黄色着色。采用YPS-2000病理图文系统进行分析,每张切片随机取5个视野(×400),计数阳性百分率,取平均值进行分析。
1.9qRT-PCR法检测PPAR-γ、TGF-β1 mRNA的表达 引物由Invitrogen(北京)公司合成。内参GAPDH(131 bp)上游引物:5′-CCTTCCGTGTTCCTACCCC-3′;下游引物:5′-GCCCAGGATGCCCTTTAGTG-3′。PPAR-γ(134 bp)上游引物:5′-TACCACGGTTGATTTCTC-3′,下游引物:5′-GCTCTACTTTGATCGCACT-3′。TGF-β1(182 bp)上游引物:5′-CTGGATACCAACTACTGCTTCA-3′,下游引物:5′-AGGACCTTGCTGTACTGTGT-3′。Trizol法提取肝组织总RNA,检测RNA纯度和浓度。扩增程序:95°30 s,(95℃ 5 s,60℃ 40 s)×45个循环。RealTime反应体系:2×mix 10 μl,上游引物0.5 μl,下游引物0.5 μl,模板2 μl,加入灭菌蒸馏水至20 μl。2-△△CT法计算PPAR-γ、TGF-β1的相对表达。
1.10Western印迹法检测PPAR-γ、TGF-β1蛋白的表达 提取蛋白并定量,凝胶电泳,转膜,室温封闭10 min,将一抗(1∶500),二抗(1∶200)按比例加入4 ml离心管中,反应5 min,加入4 ml抗体稀释液,将封闭好的膜转移到装有抗体混合液的盒子中,室温孵育,4℃过夜,洗涤,ECL曝光显影。以β-actin作为内参,目标蛋白相对表达量用目标蛋白与内参蛋白灰度值的比值相对于对照组的比值表示。
1.11统计学方法 采用SPSS20.0软件进行单因素方差分析,两两比较采用LSD检验,等级资料比较采用非参数检验。
2 结 果
2.1一般情况 实验中处死正常对照组大鼠2只,处死模型组和FRF小剂量组各1只,秋水仙碱组死亡2只,FRF大剂量组死亡1只。正常对照组大鼠行为及饮食正常,体重逐渐增加。其余各组有皮肤溃烂现象。模型组大鼠皮毛干涩无光泽,反应迟钝,饮食、活动减少,体重增长缓慢。各药物组较模型组有所改善。
2.2血清HF指标比较 与正常对照组比较,模型组指标显著升高(P<0.01),与模型组比较,各药物干预组HA、Ⅳ-C、PⅢNP均有降低(P<0.05),其中扶正化瘀组、FRF中、大剂量组降低明显(P<0.01),LN除外FRF小剂量组外,其余各组降低差异有统计学意义(P<0.05),与秋水仙碱组、扶正化瘀组比较,FRF各剂量组HF水平差异无统计学意义(P>0.05)。见表1。
2.3病理学变化比较 HE染色光镜下可见模型组肝细胞变性坏死,肝小叶结构破坏,纤维组织增生,部分有假小叶形成,各药物干预组较模型组有明显减轻。与模型组比较,各药物干预组HF分期有明显改善(P<0.01,P<0.05)。见表2。
2.4免疫组化检测肝组织PPAR-γ的表达 PPAR-γ阳性颗粒主要分布于细胞质内,呈棕黄色颗粒,与正常对照组〔(36.86±7.77)%〕比较,模型组PPAR-γ表达明显减少〔(7.55±2.86)%,P<0.01〕;与模型组比较,秋水仙碱组〔(12.31±4.57)%〕、扶正化瘀组〔(13.27±4.75)%〕、FRF小剂量组〔(11.82±3.27)%〕、FRF中剂量组〔(13.75±4.09)%〕及FRF大剂量组〔(25.07±6.97)%〕均有效增加PPAR-γ表达,其中尤以FRF大剂量明显(P<0.01);与秋水仙碱组、扶正化瘀组比较,FRF大剂量组表达增加(P<0.05)。见图1。

表1 FRF对HF大鼠血清肝纤维化指标的影响
与正常对照组比较:1)P<0.01;与模型组比较:2)P<0.01,3)P<0.05

表2 FRF对大鼠HF分期的影响(n)
与模型组比较:1)P<0.01,2)P<0.05

图1 FRF对HF大鼠肝组织PPAR-γ蛋白表达的影响(DAB,×400)
2.5各组大鼠肝组织PPAR-γ、TGF-β1 mRNA的表达 与正常对照组比较,模型组PPAR-γ mRNA表达显著下调(P<0.01);与模型组比较,各药物干预组肝组织中PPAR-γ mRNA表达上调,其中扶正化瘀组、FRF大、中剂量组差异有统计学意义(P<0.05,P<0.01);与秋水仙碱组、扶正化瘀组比较,FRF各剂量组表达差异无统计学意义(P>0.05)。见表3。
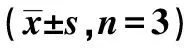
表3 FRF对HF大鼠肝组织PPAR-γ、TGF-β1 mRNA表达的影响
与对照组比较:1)P<0.01;与模型组比较:2)P<0.01,3)P<0.05
2.6Western印迹检测各组肝组织PPAR-γ、TGF-β1蛋白的表达 与正常对照组比较,模型组PPAR-γ蛋白表达明显减少(P<0.01),TGF-β1蛋白表达明显上调(P<0.01);与模型组比较,各药物干预组PPAR-γ蛋白表达均有增加,其中以扶正化瘀组、FRF中、大剂量组较为明显(P<0.01),与模型组比较,各药物干预组TGF-β1蛋白表达均有明显下调(P<0.01,P<0.05)。见表4、图2。
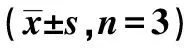
表4 FRF对HF大鼠肝组织PPAR-γ、TGF-β1蛋白表达的影响
与对照组比较:1)P<0.01;与模型组比较:2)P<0.01

1~7:正常对照组、模型组、秋水仙碱组、扶正化瘀组、FRF小剂量组、FRF中剂量组、FRF大剂量组图2 FRF对HF大鼠肝组织PPAR-γ、TGF-β1蛋白表达的影响
3 讨 论
HF实质是ECM在肝内过量沉积。HA是ECM的主要成分,可较准确地反映HF的程度、活动性,HA水平是反映HF最具价值的血清学指标〔12〕。血清LN增高与其纤维化程度呈正相关,纤维化后期增高尤为明显〔13〕。本研究结果显示,肝组织中胶原代谢异常,经FRF干预后HA、LN、Ⅳ-C、PⅢNP的含量均有降低,其中FRF中、大剂量组降低明显,说明该方具有减少HF肝组织细胞外基质异常增生的作用,推测其调节胶原代谢是其抗肝纤维化的机制之一。
HF的进行性发展与PPAR-γ的表达量减少和功能异常有关〔14〕。HF程度越重,PPAR-γ表达越低,而α-SMA表达越高,PPAR-γ表达的下降可能使α-SMA的数量增加,加速HF的形成〔15〕。HF的关键节点是HSC的表型转化。PPAR-γ参与HSC静止表型的维持,静止状态的HSC特征性表达PPAR-γ,HSC激活后,PPAR-γ表达急剧下降,过量表达α-SMA,HSC由静止向活化表型转化〔16~19〕。PPAR-γ过量表达能使活化的HSC细胞向静止表型转变,降低Ⅰ型胶原蛋白、α-SMA水平,抑制HSC增殖、活化及迁移,从而达到抗HF的作用〔20,21〕。TGF-β1在HSC 活化中起着重要作用,可以促进ECM的合成,抑制其降解。PPAR-γ的变化与TGF-β1的表达存在相关性,PPAR-γ的激活可能通过TGF-β1途径调节HF的进程〔22〕。PPAR-γ活化可以抑制TGF-β1/Smad信号通路表达,抑制HSC的活化,促进HSC凋亡,抑制ECM生成,有效地抑制HF的发生发展〔23〕。本研究表明,FRF上调纤维组织PPAR-γ表达水平,降低TGF-β1表达,可能是其抗HF作用机制之一。

