游泳运动通过TGF-β1/Smad3通路改善自发性高血压大鼠心肌间质纤维化研究*
曹 姣
(广东第二师范学院 体育学院,广东 广州 510303)
长期的高血压可引起心脏发生病理性心肌肥大,出现心肌纤维化,包括间质和心肌内冠状动脉血管周围纤维化[1]。心肌纤维化可通过加剧心肌和脉管的生物力学硬度,干扰生物电耦合,损害心脏的正常结构和功能,导致心衰,成为导致高血压患者死亡的重要原因。
转化生长因子β1(transforming growth factor β1,TGF-β1)/Smad3为细胞内典型的纤维化通路。Yu YS等研究显示,20周龄SHR大鼠心肌AngII水平、NOX4表达均增加[2]。Chen M等研究显示,TGF-β1相关的信号通路参与16周龄自发性高血压大鼠心肌间质纤维化[3]。在TGF-β1转基因小鼠研究显示,心肌AT1受体(AngII的受体)阻滞剂不足以抑制肥大反应,而TGF-β1敲除大鼠抵抗了血管紧张素II(angiotensin II,AngII)介导的心肌肥大[4],以上提示AngII可能通过TGF-β1介导心肌肥大和纤维化[5]。然而其所介导的相关信号通路是如何参与自发性高血压心肌纤维化过程?尚不清楚。有氧运动作为一种非药理学手段来改善高血压心肌间质纤维化,TGF-β1/smad3通路是否在其中发挥作用?具体的作用机制如何? 尚未被研究。本研究选取自发性高血压大鼠为研究对象,通过对其实施游泳运动干预,探讨高血压心肌纤维化改善过程中起关键作用的信号通路,以期探寻运动保护高血压新的作用靶点,为高血压心肌间质纤维化运动疗法的开展提供新的理论基础。
1 材料与方法
1.1 实验动物
选取4月龄SPF级雄性SHR大鼠20只和WKY组大鼠8只,体重为250~300g,由北京维通利华实验动物中心提供,许可证号:SCXK(京)2012-0001。常规分笼喂养,自然光照,饲养环境温度(23±2)℃,适应期自由饮水进食。饲料选用国家标准啮齿类动物混合饲料的普通饲料,由广州中医药大学实验动物中心提供。
1.2 大鼠实验分组
所有大鼠于15周龄购进,经适应性喂养一周后随机分为三组,分别为:WKY组(正常对照组)(8只);SHR组大鼠分成模型组(10只)和SHR+运动组(10只)。
1.3 运动方案
运动组大鼠进行为期12周不负重游泳训练(有氧运动),第1周为适应性训练。第1天运动时间为10 min,以后每天递增10 min逐步增加到60 min/d,从第2周开始维持此运动时间至12周结束[6],水温控制为30℃。
1.4 取材与保存
大鼠腹腔注射10%水合氯醛(剂量:0.35~0.40 ml/kg bw)麻醉,腹主动脉取血,静置、处理,用于血液学指标测试。取大鼠部分心尖组织置于10%甲醛溶液固定24~48 h,用于制备心肌组织病理切片;另取部分心尖组织用锡纸包裹迅速置于液氮冻存,并最后转入-80 ℃冰箱待测心肌中各生化指标。
1.5 测试指标及检测方法
Olymplus显微镜每张切片随机选出6个视野,在400倍光镜视野下获取图像,采用Image-Pro Plus Version 6.0 图像分析系统分析,测量每个视野中蓝色胶原纤维染色的面积,计算胶原面积与心肌组织总面积的比值(%),取其平均值作为每只大鼠的胶原容积分数(CVF%)。
大鼠血压选用ALC-NIBP无创血压测量分析系统测定;大鼠心肌间质纤维化形态学采用Masson染色;col I、col III表达采用免疫组织化学法;血浆和心肌AngII采用放免法,心肌Smad3mRNA采用QRT-PCR法,心肌NOX2、TGF-β1、HSP90蛋白采用Western-blot方法。
1.5.1 血压测定
选用ALC-NIBP无创血压测量分析系统测定各组大鼠安静清醒状态的尾动脉收缩压(SBP)。于实验前、干预期间的每周测量,每只大鼠间隔1min测量共5次,取其中结果相差控制在5~10mmHg内的测定次数,从中取3次,求平均值作为大鼠尾动脉收缩压。
1.5.2 Masson染色测试大鼠心肌间质纤维化形态学
常规脱水包埋;切片脱蜡后于0.5%碘酒中作用10min;水洗,5%的硫代硫酸钠作用5min;流水冲洗10min,weigert氏铁苏木素染5~10min;水洗,1%硫酸酒精分化;水洗,丽春红酸性品红液染5~10min;水洗,1%磷酸水溶液处理约5min;苯胺蓝液或亮绿液复染5min;冰醋酸处理1min;95%酒精脱水多次;无水酒精脱水,二甲苯透明,中兴树胶封固。
1.5.3 免疫组织化学法测试col I、col III表达
组织固定、脱水、浸蜡、包埋、切片;脱蜡,水化;PBS冲洗3次×5min;3%H2O2封闭,室温10min;抗原微波修复;10%山羊血清(0.1 Mpbs 配制,加Triton-100工作液浓度0.1%)孵育,室温20min~1h;滴加一抗(0.1 Mpbs 配制,加Triton-100工作液浓度0.1% ),4℃过夜;室温负温1h,回收一抗;加二抗,室温孵育3h,回收二抗;DAB显色;PBS冲洗;苏木精复染,盐酸酒精分化;自来水冲洗10~15min;脱水,透明,封片,镜检。
1.5.4 放免法测试血浆和心肌AngII
血浆和心肌AngII采用放免法,具体操作严格按照试剂盒说明书进行。
1.5.5 荧光实时定量RT-PCR(QRT-PCR)法测定Smad3基因表达
取肝脏组织50~100 mg组织,采用经典方法经Trizol裂解液、氯仿、异丙醇提取总RNA。准备1.5mL EP管,加入约4μg模板RNA,1μL Oligo(dT)18引物,1μL (10 mmol)dNTP mix, DEPC水定容至12μL,离心;65℃水浴5min后离心,加入4μL 5×First-Strand Buffer、1 μL RibolockTMRibonuclease Inhibitor、2 μL0.1MDTT;离心,37℃水浴2min,加入1μL (200U/μL)ReverAid M-MuLV反转录酶(总反应体积20 μL); 37℃水浴50 min进行反转录;70℃水浴15 min灭活逆转录酶;立即进行PCR。反应体系组成为0.5μL cDNA模板、10μL GoTaq?qPCR Master Mix (2×)、0.4μL引物-1(10uM)、0.4μL引物-2(10uM)、0.2μL CXR、
8.5μL ddH2O,总体积20μL。反应条件为95℃预变性2min;变性95℃ 15s、退火60℃1 min,共40个循环;Melt。引物序列见表1。
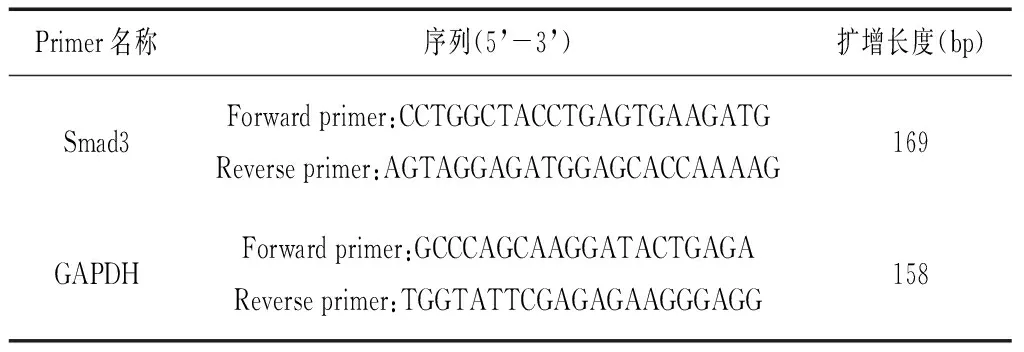
表1 引物序列一览
1.5.6 心肌NOX2、TGF-β1、HSP90蛋白采用Western-blot法
称取100mg组织,加入1 mL RIPA和10μL 100 mM 的PMSF、10 μL磷酸酶抑制剂,匀浆;4℃12000 g/min高速离心30 min;转移上清;BCA试剂盒总蛋白定量;加电泳上样缓冲液;沸水浴5 min,12000 r/min离心3min,上样;电泳;转膜;取膜,洗涤,室温封闭30 min,4 ℃过夜;加已稀释好的兔抗体NOX2、TGF-β1、HSP90 (1: 200) (稀释液含2%的BSA),4℃过夜;TBST洗膜;加5 mL 1:5000稀释(稀释液含2%的脱脂奶粉)的羊抗兔二抗,37 ℃反应1 h;洗膜;加入ECL化学发光试剂;浸透晃洗,水洗,自然晾干。
1.6 统计学处理
所有数据应用SPSS 22.0 和Excel 2007统计软件进行处理,采用单因素方差分析和配对样本t检验进行统计学分析,结果以“平均数±标准差”(±s)表示,显著性水平为P<0.05,非常显著性水平为P<0.01。
2 结果
2.1 各组大鼠血压的变化
表2干预期间各组大鼠收缩压(SBP)的变化

组别干预前第4周第8周第12周C组136.99±0.58137.54±0.88136.73±0.82139.92±0.81H组174.59±0.67△△182.60±0.49△△200.24±1.45△△208.75±1.29△△EH组173.55±1.25△△178.21±1.46△△188.58±0.94△△$196.85±1.53△△$$
注:△△P < 0.01,与C组比较;¥P < 0.05,¥¥P < 0.01,与H组比较。
如表2所示,与C组对应周比较,H组大鼠收缩压各对应周均非常显著性升高(P < 0.01),与H组对应周比较,EH组大鼠第8周收缩压显著性降低(P < 0.05),而第12周非常显著性降低(P < 0.01)。
2.2 各组大鼠心肌间质纤维化形态学的变化
2.2.1 各组大鼠心肌CVF%、col I、col III蛋白表达的变化
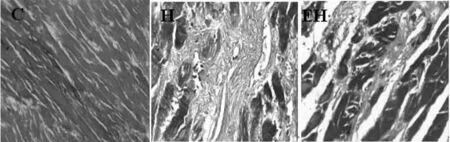
图1 各组大鼠心肌Masson染色结果(Masson,×400)
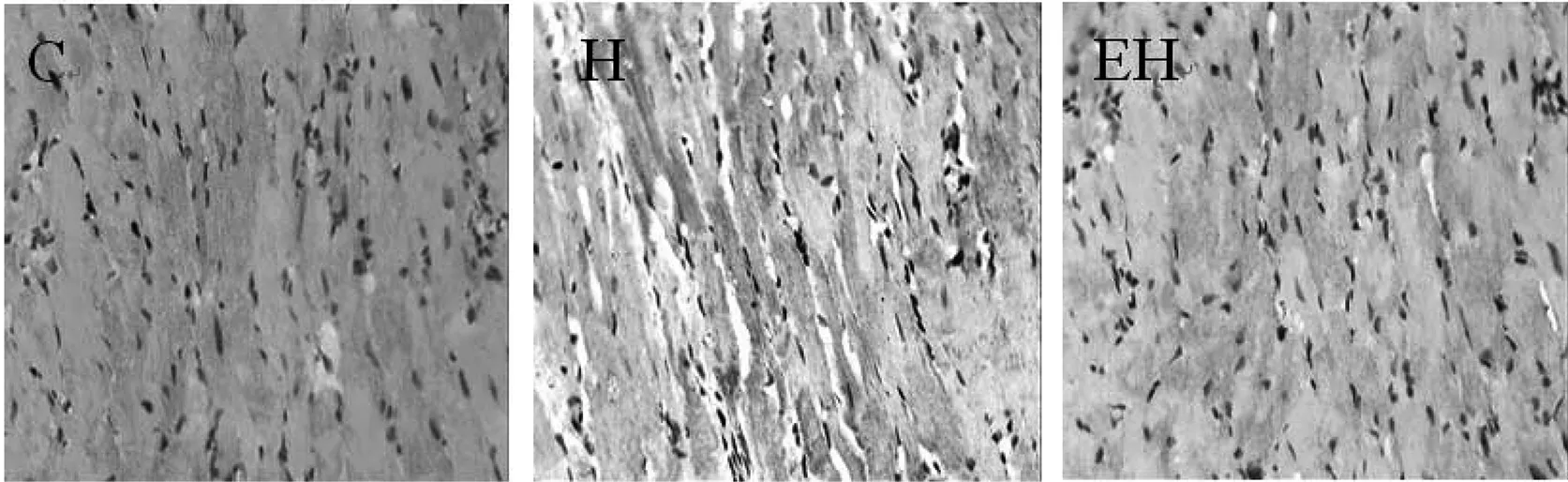
图2 各组大鼠心肌col I免疫组化染色结果(DAB显色,×400)
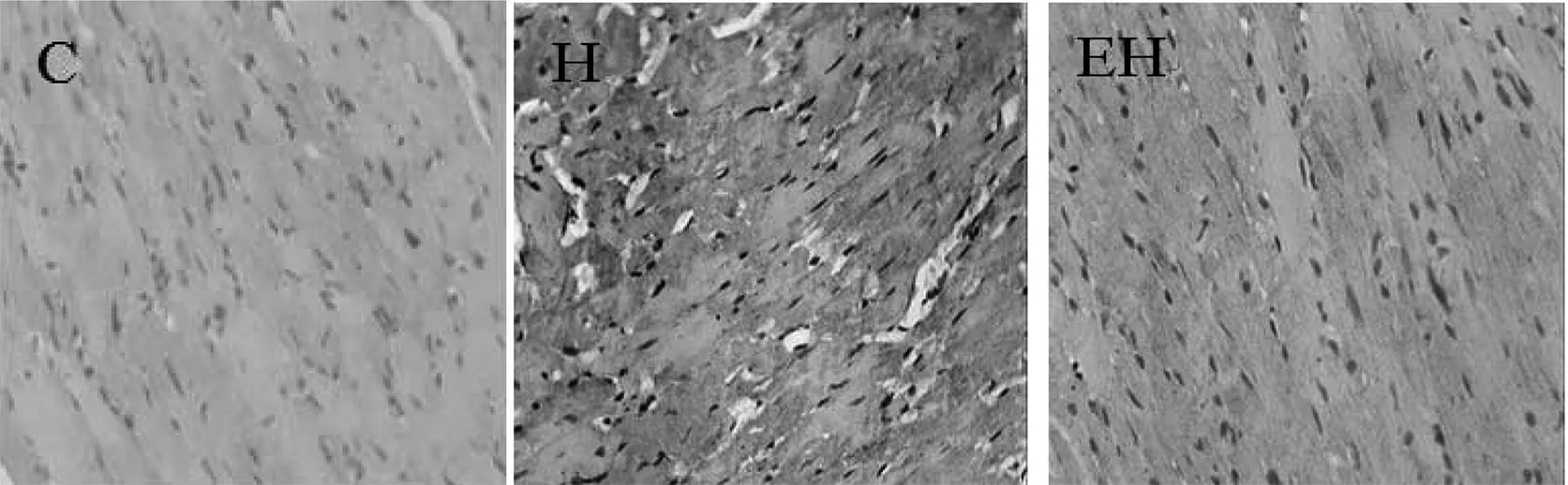
图3 各组大鼠心肌col III免疫组化染色结果(DAB显色,×400)

注:△△P < 0.01,与C组比较;¥P < 0.05,与H组比较。图4 各组大鼠心肌中CVF%、col I、col III蛋白表达的变化
如图4所示,与C组比较,H组大鼠心肌CVF%、col I、col III蛋白表达均非常显著性增加(P<0.01),与H组比较,EH组心肌CVF%、col I、col III蛋白表达均显著性降低(P < 0.05)。
2.3 各组大鼠血浆和心肌AngII含量的变化
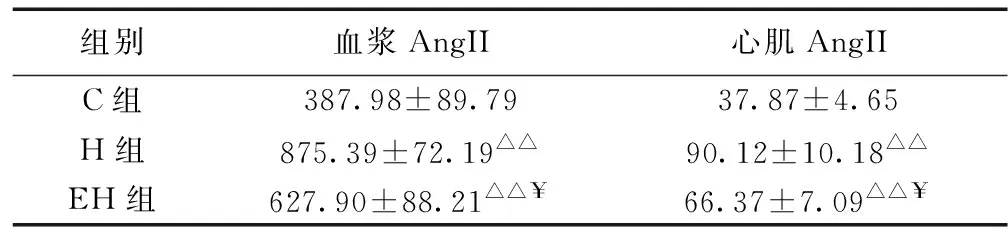
表3 各组大鼠血浆和心肌AngII含量的变化(pg/ml)
注:△△P < 0.01,与C组比较;¥P < 0.05,与H组比较
如表3所示,与C组比较,H组大鼠血浆AngII和心肌AngII含量均非常显著性增加(P < 0.01),与H组比较,EH组血浆AngII和心肌AngII含量均显著性降低(P < 0.05)。
2.4 各组大鼠心肌NOX2蛋白表达的变化
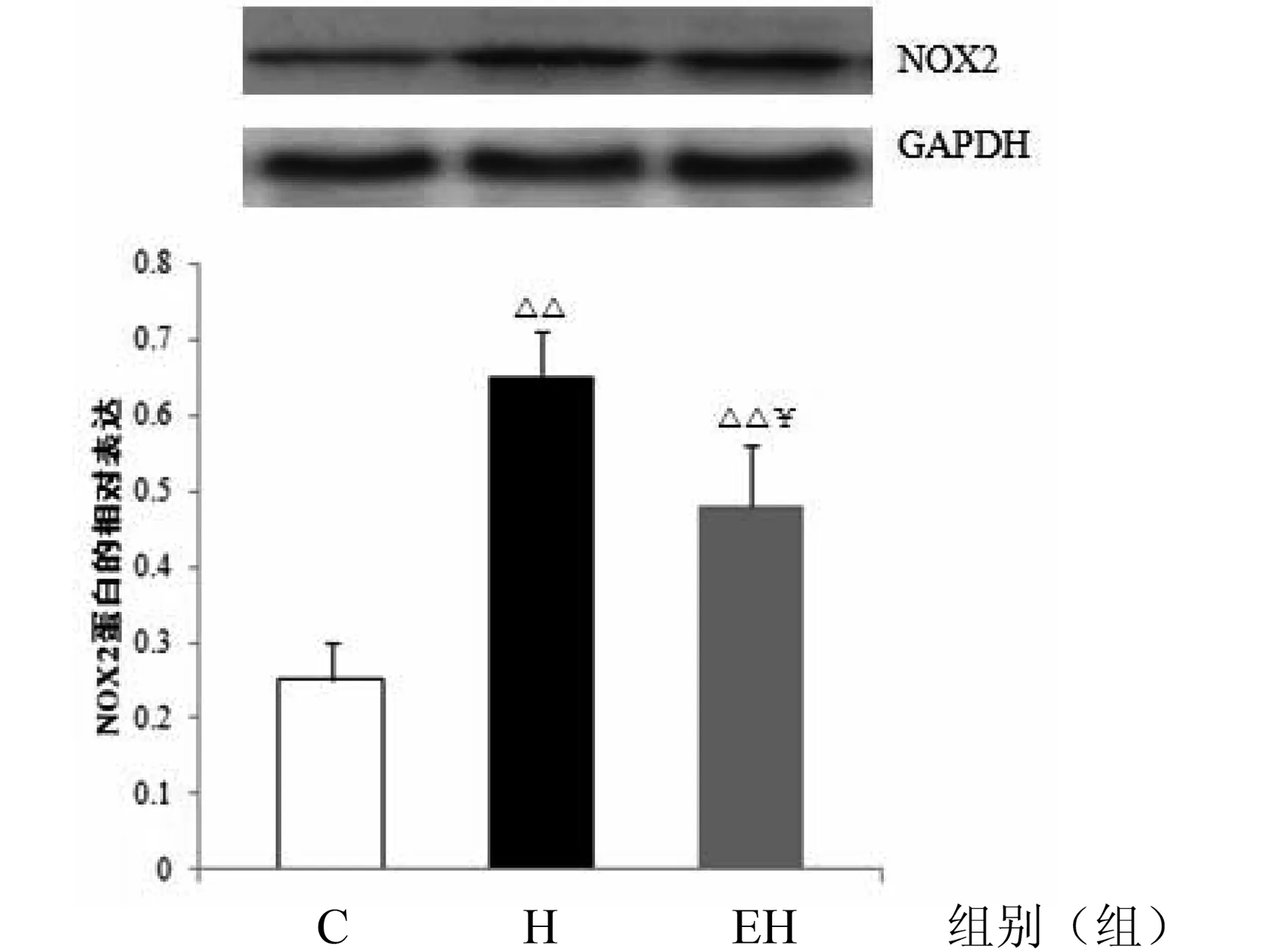
图5 各组大鼠心肌NOX2蛋白表达的变化(NOX2 /GAPDH)注:△△P < 0.01,与C组比较;¥P < 0.05,与H组比较。
如图5所示,与C组比较,H组大鼠心肌NOX2蛋白表达非常显著性增加(P < 0.01),与H组比较,EH组NOX2蛋白表达显著性降低(P < 0.05)。
2.5 各组大鼠心肌TGF-β1、Smad3表达的变化
2.5.1 各组大鼠心肌TGF-β1表达的变化
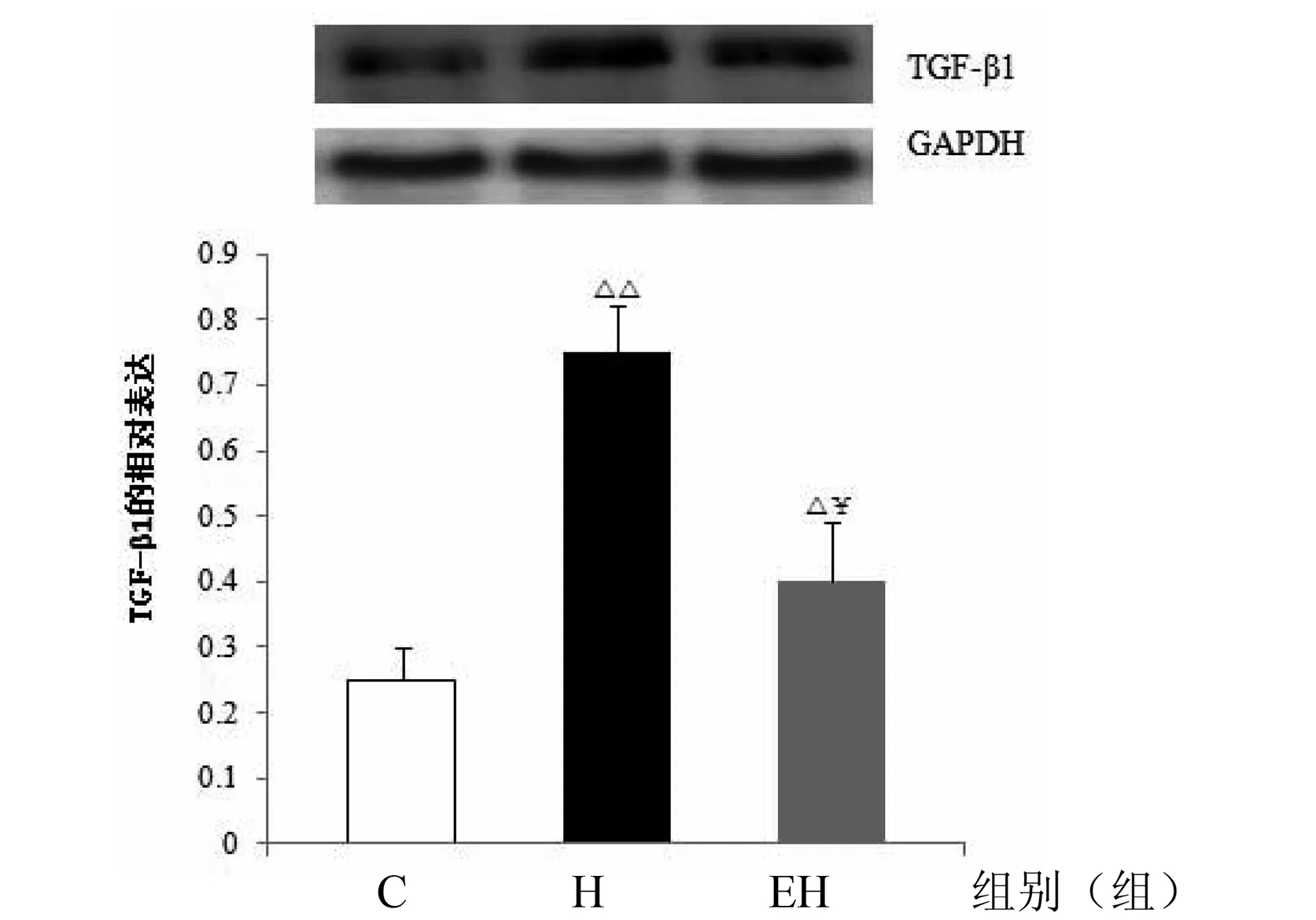
图6 各组大鼠心肌TGF-β1蛋白表达的变化(TGF-β1 /GAPDH)注:△P < 0.05,△△P < 0.01,与C组比较;¥P < 0.05,与H组比较。
如图6所示,与C组比较,H组大鼠心肌TGF-β1蛋白表达非常显著性增加(P < 0.01);与H组比较,EH组TGF-β1蛋白表达显著性降低(P < 0.05)。
2.5.2 各组大鼠心肌Smad3基因表达的变化
图7 各组大鼠心肌Smad3基因PCR扩增曲线和溶解曲线
图7为各组大鼠心肌中Smad3基因PCR扩增曲线和溶解曲线,由图7可见,心肌组织以Smad3 cDNA为模版扩增的特异性产物峰值到来之前的曲线平滑、无杂峰,显示实验结果特异性强,且其熔解曲线峰值集中、熔解温度均一、峰形锐利。对Smad3的QRT-PCR的实验结果进行准确的判断和分析,其结果如表4所示。
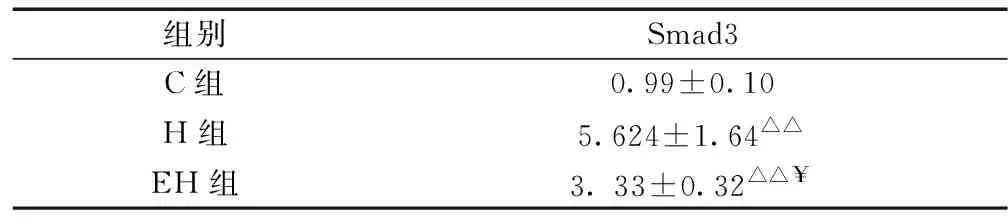
表4 各组大鼠Smad3 mRNA表达
注:△△P < 0.01,与C组比较;¥P < 0.05,与H组比较。
由表4可知,与C组比较,H组大鼠心肌Smad3基因表达非常显著性增加(P< 0.01),与H组比较, EH组Smad3基因表达均显著性降低(P < 0.05)。
2.6 各组大鼠心肌HSP90蛋白表达的变化
如图8所示,与C组比较,H组大鼠心肌HSP90蛋白表达显著性增加(P < 0.05),与H组比较,EH组大鼠心肌HSP90蛋白表达显著性升高(P<0.05)。
3 分析与讨论
3.1 游泳运动对自发性高血压大鼠收缩压、心肌间质纤维化及I、III型胶原的影响
高血压的长期高压力负荷状态可使心肌产生过度的纤维化,包括间质和心肌内冠状动脉血管周围纤维化,损害心脏功能[7]。心肌胶原蛋白主要包括胶原I型(80%)和III型(20%)[1]。心肌纤维化是胶原合成和降解失衡的结果,以过量的纤维状胶原沉积以及沉积胶原比例失常(I/III型胶原比值增加)为特征。既往研究显示,24周龄SHR大鼠心肌中过量胶原沉积和col I、colIII显著增加,基质金属蛋白酶(matrix metallo preteinases,MMP9)活性减少,而激活蛋白1(activator protein -1,AP-1)和核转录因子B(nuclear factor kappa B,NF-κB)激活,左心室射血分数降低[8]。Pei Z等研究显示,成年雄性SHR大鼠心肌ANP、β肌球蛋白重链(β myosin heavy chain,β-MHC)、胶原含量(col I和col III)、心肌纤维化增加[6]。本研究结果显示,与正常血压对照组(C组)比较,SHR模型组大鼠(H组)心肌中胶原容积分数、col I、col III非常显著性高于C组(P < 0.01),与前人研究相一致[8]。

图8 各组大鼠心肌组织HSP90蛋白表达的变化 (HSP90 /GAPDH)
注:△P < 0.05,△△P < 0.01,与C组比较;¥P < 0.05,与H组比较。
Hyo-Bum Kwak等研究显示,12周有氧运动能下调MMP-1、MMP-2、MMP-3和MMP-14,增加抗MMP的因子金属蛋白酶组织抑制剂1水平,显著改善衰老大鼠心肌纤维化[9]。Thomas, D P等研究显示,长期运动训练能减少青中年大鼠心肌col ImRNA水平,对老年大鼠col I mRNA水平影响不明显[10]。而对高血压大鼠的研究中,仅尹懿等研究显示,8周跑台运动能显著降低16月龄雄性SHR大鼠心肌胶原容积分数、I型、III型胶原蛋白表达[11]。本实验选取游泳运动方式进行干预,12周干预后,与SHR模型组(H组)比较,运动组(EH组)大鼠收缩压、心肌胶原容积分数、col I和col III蛋白表达值均减少(P < 0.05或P<0.01),提示12周游泳运动能显著降低16周龄SHR大鼠血压、心肌间质纤维化。
3.2 游泳运动对自发性高血压大鼠AngII/TGF-β1/Smad3的影响
SHR大鼠心肌纤维化可能与多种原因有关,包括交感神经过度激活[12]、促炎症细胞因子如IL-1β促炎症机制[13]以及肾素-血管紧张素(AngII)-醛固酮系统(RAS)[14]、TGFβ1途径[15]等。AngII是肾素-血管紧张素-醛固酮系统(RAS)一个组分,在维持心血管稳态中起关键调节作用,与进展性心功能障碍、不良重塑和心衰有关。然而其在高血压心肌纤维化中起作用的具体机制是怎样?运动能有效改善高血压心肌间质纤维化,是否通过RAS途径实现?其作用机制是什么?目前研究尚不明确。
TGF-β是潜在的促纤维化因子,在哺乳动物中,存在三种亚型:TGF-β1、TGF-β2和TGF-β3。其中TGF-β1是最主要的、分布最广泛,可通过多种机制介导细胞外基质(extracellular matrix,ECM)稳态,包括经典型和非经典型信号途径合成ECM,减少了调节ECM降解的蛋白酶MMPs的产生,促进了蛋白酶体抑制子TIMPs、干扰素的表达,增加细胞粘附到基质。异常的TGF-β1信号可引起大量与心衰有关的病理变化,如膨大的心肌病、心肌纤维化和梗死后心肌重塑等[15,16]。细胞内的Smads途径在调节细胞内TGF-β1和相关因子的信号中起主要作用。Smads包括三个家族:受体激活型Smads(R-Smads)、一般型Smads和抑制型Smads(I-Smads)。Smad3是一种R-Smad,一旦受到TGF-β1磷酸化,激活的TGF-β1 可连接到I型和II型受体(TβR-II)受体,通过磷酸化TβR-I相关的Smads介导胞内信号[17]。
AngII作为细胞内的活性分子,其发挥效应需要与受体结合[18]。在心肌,AngII 连接到AT1诱发NADPH氧化酶(NOX)依赖的过氧化物生成,激活多条下游信号转导通路。心肌细胞可表达两种NOX家族成员,分别为NOX2和NOX4[19]。在AngII处理的新生大鼠心肌细胞研究显示,AngII激活产生超氧化物依赖于AT1和NOX2作用[20]。Yu YS等研究显示,20周龄SHR大鼠心肌AngII水平、NOX4表达均增加[21]。
AngII已知介导了驱药性炎症细胞如巨噬细胞聚集,巨噬细胞异常积累在局部组织可增加TGF-β1水平,激活Smad3介导的信号通路[22]。Lijun Wang等通过研究糖尿病心肌病机制的研究发现,细胞因子AngII能激活JAK/STAT信号通路,促进TGF-β1蛋白表达,增加心肌中胶原的含量[23]。因此,在本实验中我们同时测定了AngII、NOX2、TGF-β1、Smad3mRNA,结果显示,与C组比较,28周龄SHR大鼠模型组(H组)大鼠以上各指标均呈现非常显著性增加(P<0.01),提示AngII可能通过作用于NOX2介导TGF-β1/Smad3信号参与高血压心肌间质纤维化。已知长期有规律的运动能改善高血压心肌间质纤维化,在此之前的研究中,仅对其中某单一指标进行了测定研究,如Xu X等研究显示,8周运动训练能减少左冠状动脉结扎引起梗死的左心室重塑大鼠心肌的胶原容积分数、AngII I型受体蛋白表达,增加金属蛋白酶组织抑制剂1(tissue inhibitor of metalloproteinase-1,TIMP-1)[24]。Agarwal 等研究显示,16周有氧运动能有效降低7周龄SHR大鼠血压,降低其大脑(下丘脑室旁核和延髓头端腹外侧区)中促炎因子和抗炎因子之间的平衡以及RAS成分(血浆AngII)[25]。Filho AG等研究显示,8周游泳运动训练能显著降低SHR大鼠血浆AngII水平,参与心肌重塑的改善[26]。相关的研究还显示,12周运动训练能较好的减少衰老大鼠心肌中的细胞外基质沉积,改善年龄相关的心脏细胞外基质,表现为心肌中TIMP、TGF-β表达下调而MMPs上调[27]。Serra A J等研究显示,运动训练能显著降低由β-肾上腺素所介导的大鼠心肌中促炎因子TGF-β1mRNA,改善心功能[28]。而有氧运动能否通过该通路改善高血压心肌纤维化尚未被研究。为此,我们测定了高血压大鼠AngII、NOX2、TGF-β1、Smad3mRNA,首次研究AngII/TGF-β1/Smad3在运动改善高血压心肌间质纤维化中的作用,结果显示,运动组大鼠AngII、NOX2、TGF-β1、Smad3mRNA均显著低于高血压模型对照组,表明AngII/TGF-β1/Smad3通路参与其中。
3.3 游泳运动对自发性高血压大鼠心肌HSP90蛋白表达的影响
HSPs是一组强大的分子伴侣,在受到各种生理和环境攻击时被介导。HSP90占到细胞质蛋白的1~2%,控制细胞内多种蛋白的折叠和胞内运输。研究显示,HSP90还能与细胞内许多蛋白质形成复合物,参与细胞生长、存活和分化,如HSP 90能调控NF-κB、Raf-1和JNK的活性,参与细胞凋亡[29,30]。Jun-ichi O研究发现,在4周高盐饮食介导的高血压心肌肥大模型中,心肌间质和血管周纤维化增加的同时,伴有HSP 90蛋白表达显著性升高,提示HSP 90蛋白可能通过直接或间接形式参与对高血压心肌间质纤维化的调控[31]。我们的研究对象为自发性高血压大鼠,结果显示,与正常血压对照组比较,SHR模型组大鼠心肌中HSP 90蛋白表达显著性升高。
关于有氧运动对心肌HSP90的研究尚未见到。而骨骼肌和主动脉的相关研究显示,有氧运动能增加HSP90活性,参与eNOS的活性增加,因为eNOS产生NO的能力部分是由其与HSP 90之间的相互作用决定,最终参与骨骼肌和主动脉氧化还原平衡以及对血管稳态的调节[32,33]。在本研究中,我们首次探讨HSP90在高血压心肌纤维化重塑中的改善作用,结果显示,与高血压模型对照组,运动组大鼠心肌中HSP90蛋白表达水平增加,分析这种变化的原因可能与HSP90对内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)的活性增加的调节作用有关。
在本研究中,HSP 90在高血压心肌中表达增加,而在游泳运动会出现继续增加。分析这两种不同的状态下的可能原因是,在高血压病理性心肌重塑状态下,氧化应激激活了热休克反应,在游泳运动的热休克反应的增加是减少了心肌中的脂质过氧化水平状态[34],这在本实验的NOX2蛋白表达的变化可得到一定的验证。此外,在前人的相关研究中,谈到在病理性心肌重塑的状态下HSP 90蛋白增加,这是一种补偿机制来促进eNOS活性增加NO,但是这种补偿机制最终无法阻止病理性心肌重塑(包括心肌肥大和心肌间质纤维化等)的进展,而通过运动干预后,可进一步促进HSP 90蛋白的表达,再次建立起来的HSP90与eNOS之间的相互作用可能促进了内源性eNOS产生NO的能力,这种代偿作用在一定程度上改善了心肌间质纤维化[35],这种机制是否存在于本研究的高血压心肌间质纤维化中,对此还有待进一步研究。
4 结论
游泳运动能较好地改善SHR大鼠心肌间质纤维化,降低colI、colIII蛋白表达,主要通过降低AngII介导NOX2表达,抑制下游TGF-β1/Smad3通路激活,其中HSP90作为其上游因子,在其中可能起着重要的调节作用。

