海藻酸钠微胶囊对乳酸菌产乙醛脱氢酶在体外胃肠消化环境中保护作用
万茵,罗成,张鸿婷,3,郭帅玲,3,皮潇文,3,童火艳,3,付桂明,3*
1(南昌大学,食品科学与技术国家重点实验室,江西 南昌,330047) 2(南昌大学 食品学院,江西 南昌,330047) 3(南昌大学 中徳食品工程中心,江西 南昌,330047)
乙醛脱氢酶(aldehyde dehydrogenase,ALDH)是广泛存在于动植物和微生物线粒体中的一种氧化还原酶类,可在NAD+存在的条件下,催化醇、醛和酮的脱氢反应[1],尤其是参与乙醇及其代谢产物乙醛的转化,故其在乙醇的解毒研究中受到了高度关注[2-3]。乙醛脱氢酶对热、酸的抗逆性较差[4],啤酒酵母线粒体乙醛脱氢酶最适pH值为9,在pH值8.0弱碱性环境下稳定性较好[5]。因此乙醛脱氢酶要在人体内发挥作用,如何经受住高酸性胃酸、多种消化酶和胆汁的作用,保持在人体消化道中其酶活性是关键。
目前,工业化的乙醛脱氢酶来自动物的胰腺、肝脏或肝细胞线粒体中,来源的局限性致其价格居高不下。研究表明微生物乙醛脱氢酶来源丰富,可从酿酒酵母、醋酸菌、乳酸菌等微生物中分离得到。微生物乙醛脱氢酶是一种胞内酶[6],微生物的细胞内环境可有效保护乙醛脱氢酶不受外部环境的影响。因此,若将产乙醛脱氢酶的益生菌直接进行微胶囊包埋,利用微胶囊和益生菌的细胞内环境为乙醛脱氢酶提供双重保护作用,可增强其抗逆性效果。海藻酸钠由于具有良好的生物相容性、生物粘附性和温和的凝胶条件已被广泛应用于医药、农药、食品、化妆品等许多领域。海藻酸钠作为壁材不仅可以包埋乳酸菌[7],还可以包埋酶[8]等生物活性物质。
本研究通过前期实验筛选得到的高产乙醛脱氢酶植物乳杆菌(LactobacillusplantarumFCJX 102)和嗜酸乳杆菌(LactobacillusacidophiluFCJX 104),通过混合发酵培养菌体,采用微胶囊包埋乳酸菌活菌体,提高所含乙醛脱氢酶耐受胃液及肠液的能力,为高产乙醛脱氢酶乳酸菌及乙醛脱氢酶在调节酒后的肠道微环、解酒益生等领域的应用提供研究基础。
1 材料与方法
1.1 材料与试剂
EDTA,盐酸,Tris,乙醛,β-巯基乙醇:分析纯,国产试剂;海藻糖,海藻酸钠,VC,甘油:生物试剂,国产试剂;NAD:生物试剂,Roche公司;胃蛋白酶,胰蛋白酶,胆盐:生物试剂,SIGMA公司;伊利牌脱脂奶粉:市售;大豆分离蛋白:哈高科大豆食品有限责任公司;耐高温α淀粉酶:山东苏柯汉生物工程股份有限公司;山楂:湖北蕲春中药材公司;葛根:江西横峰皇同有机葛开发有限公司。
植物乳杆菌(L.plantarumFCJX 102),嗜酸乳杆菌(L.acidophiluFCJX 104):南昌大学食品科学与技术国家重点实验室保藏。
1.2 培养基
种子培养基:蛋白胨10.0 g,牛肉粉5.0 g,酵母浸粉4.0 g,葡萄糖20.0 g,乙酸钠5.0 g,柠檬酸氢二铵2.0 g,K2HPO42.0 g,七水硫酸0.2 g,MnSO40.05 g,吐温-80 1.0 mL,加水至1 000 mL,pH 6.2~6.4,115 ℃灭菌30 min。
发酵培养基:将葛根粉碎至20目,加入5倍质量的水,并添加0.1%(v/m葛根质量)的耐高温α-淀粉酶,于100 ℃下酶解液化50 min,100目过滤,收集滤液作为葛根汁;将鲜山楂按1∶1的比例加水榨浆,向山楂原浆中加入0.5 g/L果胶酶(10万U/g),在温度50 ℃、pH 为3.5的条件下酶解4 h,加入0.5 g/L壳聚糖沉淀,再经过硅藻土过滤,得山楂原料汁(质量分数为50%)。按山楂汁∶葛根汁按1∶2质量比混合,调pH值至6.2~6.4,115 ℃灭菌30 min,即得发酵培养基。
1.3 实验仪器
游标卡尺,任丘市桂量量具有限公司;FA2004分析天平,上海舜宇恒平科学仪器有限公司;T6型紫外-可见光分光光度计,北京普析通用仪器有限责任公司;SORVALL高速冷冻离心机,Thermo Fisher公司;DKS-24型不锈钢新型电热恒温水浴锅,嘉兴市中新医疗仪器有限公司;PHS-3C型pH计,上海精密仪器雷磁仪器厂;HJ-4A型数显四联磁力加热搅拌器,常州国华电器有限公司;LDZX-50KBS型高压蒸汽灭菌锅,上海申安医疗器械有限公司;HWS-250型恒温恒湿培养箱,上海森信实验仪器有限公司;冷冻干燥机,美国LABCONCO公司。
1.4 方法
1.4.1 双乳杆菌的混合培养
取筛选获得产乙醛脱氢酶的植物乳杆菌(L.plantarumFCJX 102)和嗜酸乳杆菌(L.acidophiluFCJX 104)2个菌种,用种子培养基活化培养16 h,后按照两者活菌数比例2∶1接种到发酵培养基中,接种量为5%,37 ℃培养16 h,收获含乙醛脱氢酶活力高的混合菌体发酵液。
1.4.2 双乳杆菌海藻酸钠微胶囊的制备
采用海藻酸钠挤压法[9]。将1.4.1中混合发酵液在4 ℃、4 500 r/min离心10 min,去上清,无菌生理盐水清洗菌体2次,离心后得到双乳杆菌菌泥,按1∶5(w/v)加入保护剂(海藻糖8%,VC0.2%,乳糖8%,甘油3%),混匀后再加4.0%脱脂乳和灭菌的2.68%海藻酸钠溶液,充分混合均匀。用无菌滴管(直径0.45 mm)将混合菌滴加到0.2 mol/L的灭菌CaCl2溶液中,搅拌速度600 r/min,固化30 min,无菌生理盐水清洗后过滤,即得双乳酸杆菌湿微胶囊。将之于-80 ℃预冻24 h,再冷冻干燥48 h,得到双乳杆菌海藻酸钠微胶囊成品。
1.4.3 微胶囊包埋率测定
采用平板计数法测定制备微胶囊前乳酸菌菌落数及上清液中未被包埋的乳酸菌菌落数,根据下列公式计算包埋率:

(1)
1.4.4 微胶囊粒径测定
用游标卡尺测量随机取样的微胶囊颗粒粒径若干,取平均值。
1.4.5 双乳杆菌及其微胶囊的体外模拟胃消化研究
于100 mL具塞锥形瓶中加入质量浓度为9 g/L的NaCl溶液25 mL、0.1 mol/L HCl溶液4 mL、40 mg/mL胃蛋白酶溶液2 mL(用0.1 mol/L HCl配制),混合均匀后,调pH值在1.5~2.0之间,制备人工胃液。加入0.200 g双乳杆菌菌泥或含有等菌落数的微胶囊,放置于37 ℃ 160 r/min水浴振荡180 min,其间,于0、10、20、30、40、50、60、90、120、150、180 min时,依次取出消化液测定其ALDH酶活。以等质量未经消化的菌泥或微胶囊作对照,将其活性视作100%。
1.4.6 双乳杆菌海藻酸钠微胶囊体外模拟肠溶性研究
于100 mL具塞锥形瓶中加入0.9 g/100 mL NaCl溶液25 mL,加入9 mL胰液胆汁混合液(2 mg/mL胰液,12 mg/mL胆汁均用0.1 mol/L NaHCO3溶液配制),用0.5 mol/L NaHCO3调节pH在7.0~7.5,制备人工肠液。将经体外模拟胃消化后的微胶囊继续于模拟肠液中消化60 min,每10 min取一次样,于600 nm处测定透光率,以等质量未经消化的微胶囊作对照,将其透光率视作100%,测定双乳杆菌海藻酸钠微胶囊体外肠溶性。
1.4.7 双乳杆菌及其微胶囊体外模拟肠消化研究
向34 mL人工肠液中加入0.200 g菌泥或含有等菌落数的微胶囊,放置于37 ℃、160 r/min水浴振荡60 min,其间,于0、10、20、30、40、50 min时,依次取出消化液测定其ALDH酶活。以等质量未经消化的菌泥或微胶囊作对照,将其活性视作100%。
1.4.8 乙醛脱氢酶粗酶活力测定
将微胶囊颗粒重悬于5倍质量的磷酸缓冲盐(pH值8.0、20 mmol/L)中,制成菌悬液,以200 W功率超声破碎15 min(冰水浴),再于6 000 r/min、4 ℃离心15 min,收集上清液,得到沉淀按上述处理重复1次,合并2次上清液即得乙醛脱氢酶粗酶液。
向试管中加入2.52 mL Tris-HCl缓冲液(0.05 mol/L,pH=8.0)、0.1 mL EDTA溶液(0.05 mol/L)、0.1 mL KCl溶液(3 mol/L)、0.1 mL NAD+溶液(0.02 mol/L)、0.05 mL乙醛溶液(0.1 mol/L)、0.03 mLβ-巯基乙醇溶液(0.05 mol/L),混匀后,加入0.1 mL粗酶液,迅速混匀后,于340 nm波长下测吸光值,计算5 min内吸光值的变化ΔA340[10]。
酶活力单位定义:25 ℃下,每分钟催化还原1 μmol NAD+的所需要的酶量为1个酶活力单位。
2 结果与讨论
2.1 双乳酸杆菌微胶囊制备
测得双乳酸杆菌菌悬液活菌数为4.4×1010CFU/mL,制备过程中滤液和洗涤液中活菌数仅为7.5×106CFU/mL,包埋率达99.8%以上,微胶囊制备包埋效果好。与KRASAEKOOPT等[11]用海藻酸钠对嗜酸乳杆菌等益生菌微胶囊化的结果一致。
如图1所示,经挤压法制成的双乳酸杆菌湿微胶囊呈乳白色,颗粒均匀、圆润饱满。冻干后,干微胶囊颗粒粒径变化不大,表面稍有内陷,多为球状,表观颜色变为嫩黄色。这是冷冻干燥过程中,微胶囊含的水分由固态直接升华,固形物形态基本得以保持。而表观颜色的变化,是由于壁材海藻酸钠和脱脂乳干燥后呈现出来。

图1 双乳杆菌海藻酸钠微胶囊Fig.1 Microcapsules of dual Lactobacillus
随机挑取25粒已冻干的双乳杆菌海藻酸钠微胶囊,用游标卡尺测量其粒径,数据如表1所示,本实验制得的双乳杆菌海藻酸钠微胶囊平均粒径为(1.14±0.08)mm。
2.2 双乳杆菌及其微胶囊体外模拟胃消化研究
食物在胃中消化需历经4个阶段,大约2~3 h,微胶囊在这段时间内应不溶解或囊体不破碎,方可保证双乳杆菌耐受高酸性环境和胃消化酶消解,从而顺利到达肠道发挥其益生功效[12]。故在本实验中,微胶囊在人工胃液中的最长消化时间定为180 min。
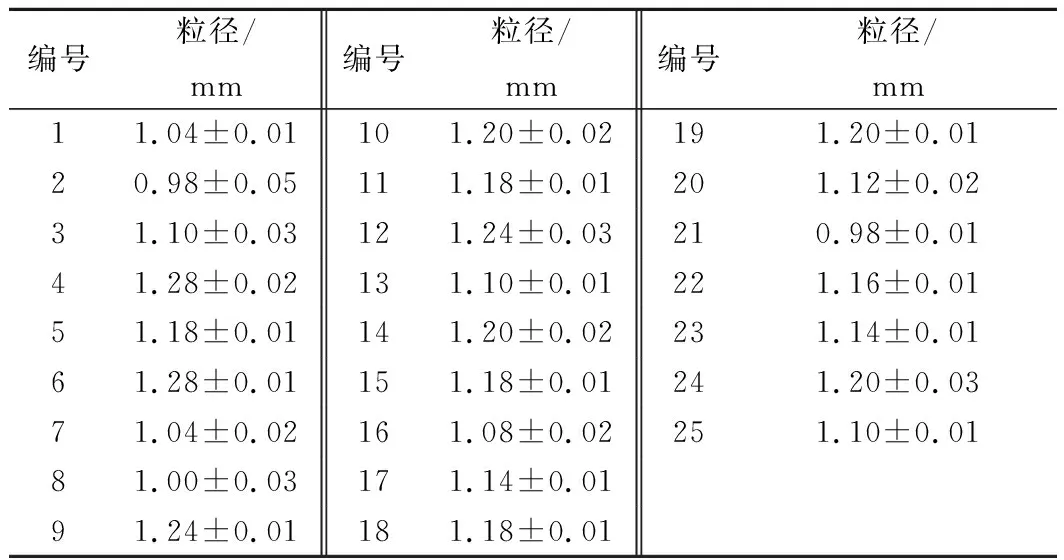
表1 双乳杆菌海藻酸钠微胶囊粒径Table 1 Diameters of microcapsules of dual Lactobacillus
L.plantarumFCJX 102与L.acidophiluFCJX 104混合菌及其微胶囊按照1.4.8方法测定乙醛脱氢酶的酶活,如图2所示,在模拟胃液中,未包埋的双乳杆菌中乙醛脱氢酶活性在30 min内急剧下降,在10 min时存活53.2%,到20 min时存活25.6%,至30 min时存活率仅为0,说明乙醛脱氢酶在pH值为1.5~2的高酸性条件下极易失活,其活力会迅速降低。这与李鑫[4]的研究一致,在人工胃液环境中,8 min时乙醛脱氢酶活性损失近50%相近。而微胶囊包埋后双乳杆菌在体外模拟胃液环境中,前90 min内酶活性下降不明显,均能保持在95%以上;模拟胃消化90 min后,乙醛脱氢酶活性开始下降,至180 min时,微胶囊包埋菌体乙醛脱氢酶活性仍存留73.4%。说明海藻酸钠和脱脂乳等保护剂制成的双乳酸杆菌微胶囊对低pH值环境有良好的抵御作用[13],很好地保护了双乳杆菌体中的乙醛脱氢酶活性。
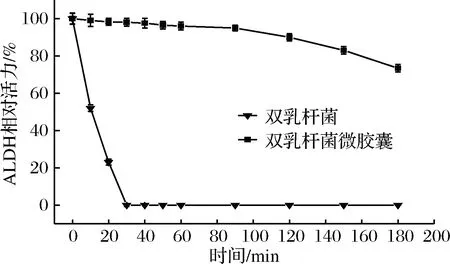
图2 双乳杆菌及其微胶囊体外模拟胃消化ALDH活性变化Fig.2 ALDH activity of entrapped dual Lactobacillus cells following exposure to simulated gastric juice and microencapsulation
2.3 双乳杆菌海藻酸钠微胶囊制剂体外模拟肠溶解性试验
将0.100 g经模拟胃消化后的微胶囊继续于模拟肠液中消化60 min,每10 min测一次透光率,结果如图3所示。双乳杆菌海藻酸钠微胶囊在体外模拟的肠液环境中,随着消化时间延长,透光率下降,即双乳酸杆菌渐渐从胶囊颗粒中释出。40 min后,透光率不再继续呈较大幅度下降,曲线接近平缓,而在此时溶液中已观察不到成型固体小颗粒,表明溶解彻底。该结果也符合《中华人民共和国药典》(2010年版二部)中对肠溶衣片崩解时限的规定[14]。说明双乳杆菌海藻酸钠微胶囊有较好的肠溶性,可在消化40 min后可完全崩解释放菌体,有利于乙醛脱氢酶发挥催化作用。
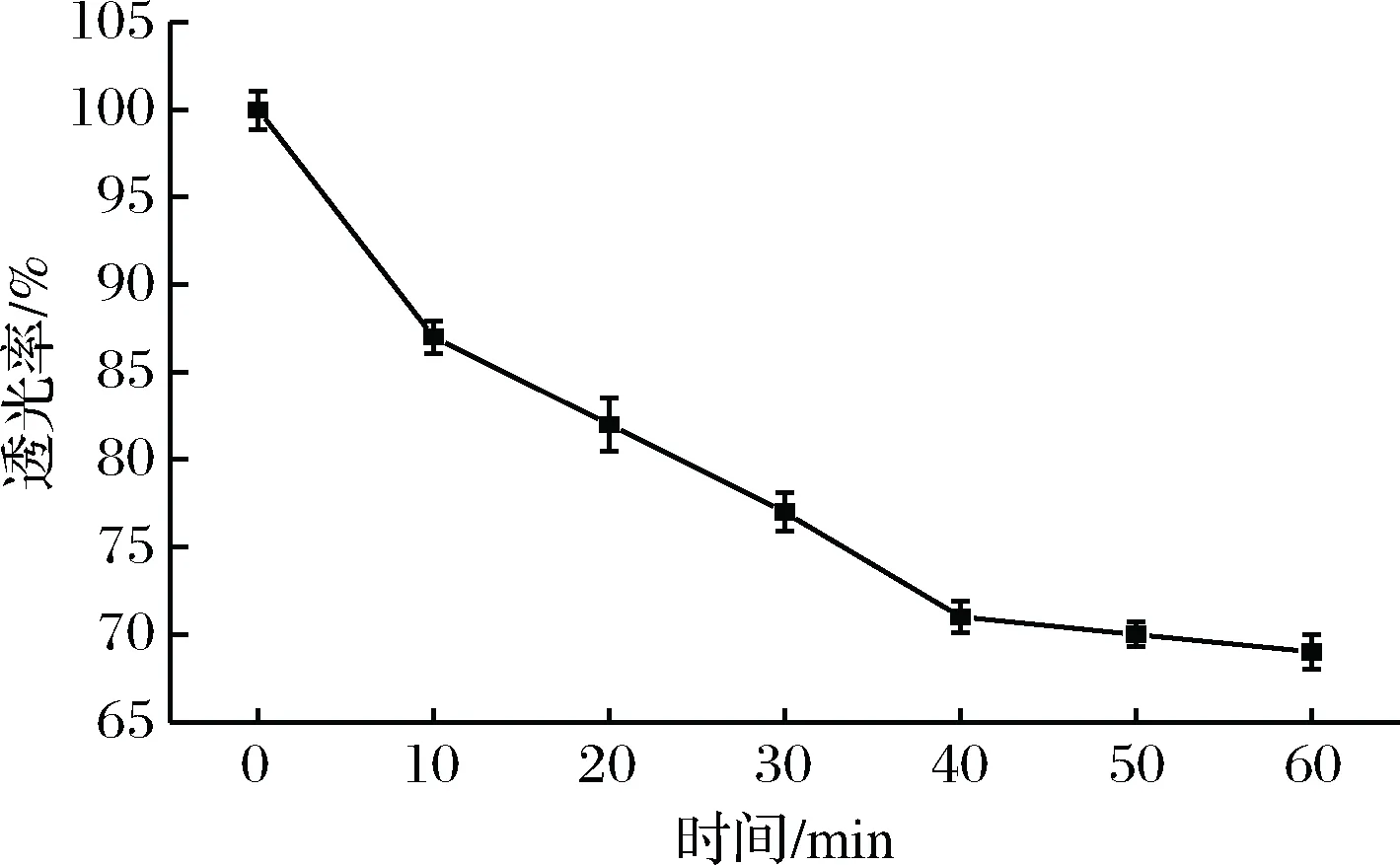
图3 双乳杆菌海藻酸钠微胶囊体外模拟肠溶解性Fig.3 Release of encapsulated dual Lactobacillus from microspheres in simulated intestine juice
2.4 双乳杆菌及其微胶囊体外模拟肠消化研究
L.plantarumFCJX 102与L.acidophiluFCJX 104混合菌及其微胶囊模拟肠消化ALDH活性变化结果如图4所示。
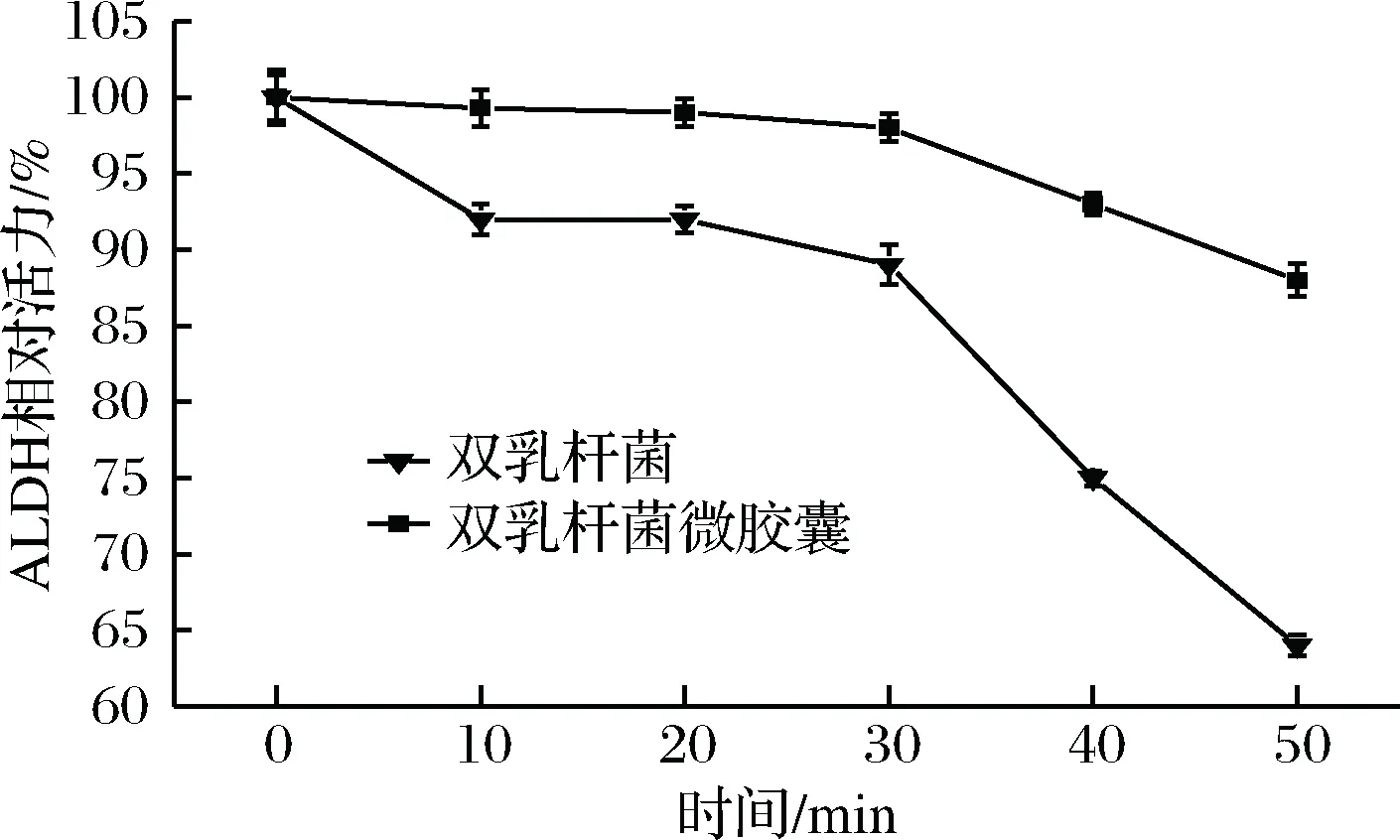
图4 双乳杆菌及其微胶囊体外模拟肠消化ALDH活性变化Fig.4 ALDH activity of entrapped dual Lactobacillus cells following exposure to simulated intestinal juice and microencapsulation
在模拟肠液中,前30 min内混合菌菌体中ALDH活性均能保持在85%以上,消化50 min后仍能保持63.7%以上活力,说明乙醛脱氢酶在弱碱性条件下较稳定。在陈贵佺[15]、刘清利[7]、李文[16]等学者的研究中,pH 6.0~8.0的环境中,乙醛脱氢酶反应活性最高,故小肠是乙醛脱氢酶发挥分解乙醛作用的主要器官。双乳杆菌海藻酸钠微胶囊在模拟体外肠消化的前30 min内,微胶囊颗粒尚未完全崩解,由于海藻酸钠等壁材对菌体和乙醛脱氢酶的保护,消化30 min酶活保存率仍达97.8%;40 min以后,随着微胶囊颗粒崩解,双乳酸杆菌直接暴露于人工肠液中,乙醛脱氢酶活性较之前开始下降,但消化50 min,相对活性仍能保留86.5%。
3 结论
本文研究了L.plantarumFCJX 102和L.acidophiluFCJX 104混合菌及其微胶囊在体外模拟胃肠消化中乙醛脱氢酶活性的变化。利用脱脂乳和海藻酸钠制备的双乳杆菌海藻酸钠微胶囊,其包埋率为99.8%,粒径为(1.14±0.08) mm。在体外模拟的胃液环境中,消化90 min后双乳杆菌海藻酸钠微胶囊乙醛脱氢酶活性能保留在95%以上,至消化180 min后微胶囊包埋菌体乙醛脱氢酶活保留率仍然达73.4%;而未经包埋的双乳杆菌,其乙醛脱氢酶在胃液消化30 min时就已完全失去活性;体外模拟肠消化前40 min,由于微胶囊壁材的保护作用,菌体乙醛脱氢酶均能保持95%以上的活性;40 min以后,随着微胶囊颗粒崩解,乙醛脱氢酶开始下降,至消化50 min,乙醛脱氢酶相对活性仍能保留86.5%。
乙醇在被人体吸收后,首先在乙醇脱氢酶(ADH)的催化下脱氢氧化转化为乙醛。生成的乙醛在乙醛脱氢酶(ALDH)的催化下氧化生成乙酸[17],最终进入三羧酸循环分解成水和二氧化碳排出体外[18-19]。由于乙醛具有强烈的毒理作用,若体内缺少ALDH或ALDH活性较低,饮酒后容易造成乙醛在体内累积而导致中毒[20-21];乙醛脱氢酶加速乙醛在体内的氧化分解,降低体内乙醛的浓度,缩短醉酒时间及缓解人们因醉酒产生的不适应,减少因乙醛中毒而导致各种疾病的诱发率[22]。双乳杆菌海藻酸钠微胶囊产品在包埋率及乙醛脱氢酶酶活保存率高,在降低饮酒后人体乙醛含量、缓解乙醇中毒症状具有较好的潜在的应用前景。

