固定化马来酸顺反异构酶合成富马酸
刘文茂 , 周 丽 , 周哲敏 *
(1.江南大学 生物工程学院,江苏 无锡 214122;2.江南大学 工业生物技术教育部重点实验室,江苏 无锡214122)
富马酸(Fumaric acid)是一种天然存在的四碳平台有机酸,又称为反丁烯二酸、延胡索酸,在医药、食品、日用化工等领域有着重要的价值[1]。马来酸 顺 反 异 构 酶 (EC 5.2.1.1,Maleate cis-trans Isomerase,MaiA)属于天冬氨酸、谷氨酸消旋酶超家族[2],能够催化马来酸在碳碳双键不断裂的情况下异构化生成富马酸。其中,粘质沙雷氏菌株来源的马来酸顺反异构酶具有转化率高、pH范围宽泛、Km值较低等特点,被认为是有望用于工业生产富马酸的生物催化剂之一[3]。游离酶在用于生物催化反应时,具有稳定性低、回收利用困难、分离成本高等问题;而固定化酶则具有可重复利用,能控制反应过程,热稳定性好,酶与底物和产物易分离,产物纯度高,能降低分离纯化成本等优点[4-5]。然而,目前尚无马来酸顺反异构酶固定化以及用固定化马来酸顺反异构酶合成富马酸的研究报道。
交联酶聚集体(Cross-linked enzyme aggregates,CLEAs)[6]是一种新型无载体固定化技术,通过在溶液中使酶蛋白分子发生物理聚集,随后利用常规交联剂戊二醛[7]对聚集体进行化学交联,该方法制备过程简单,但是由于固定化酶全部由酶蛋白组成,其机械强度较差,在实际应用中会暴露出很多问题。一方面,CLEAs的粒径一般都在10 μm以下,这样就很难通过简单地离心或过滤从反应体系中分离和回收CLEAs。另外,CLEAs压缩阻力很低,离心和过滤后很难重新均匀地分散到反应体系中,使其催化效率下降。
传统包埋法具有随机性、包埋效率低、制备过程条件苛刻、时间长、制得的固定化酶颗粒较大导致转化时传质阻力大等缺点[8]。通过对硅藻沉淀硅的机理进行研究,发现了硅蛋白(silaffins),并筛选出硅蛋白中可以高效沉淀硅的R5短肽[9],R5肽段在中性pH及常温条件下,几秒钟内即可体外诱导硅沉淀,形成自包埋结构[10]。 Lai[11]、Chien[12]、Marner[13]等人应用R5肽段在温和的条件下高效、快速地制备出酶活回收率高、操作稳定性好、热稳定性好的固定化酶。但是,本研究前期发现R5肽段与酶融合后,直接包埋制得的固定化酶颗粒较小不易回收,并且热稳定性也较差。而将交联酶聚集体技术与R5肽段自包埋两种方法相结合,即可以解决CLEAs机械强度差、易分散等问题,又可以解决R5肽段直接包埋不易回收、热稳定性差的问题,但目前尚未见类似研究。
本研究利用马来酸顺反异构酶合成菌株E.coli BL21(DE3)/pET-24a(+)-maiA[14]高效表达马来酸顺反异构酶,采用交联酶聚集体技术与R5肽段自包埋技术相结合的方法,制备热稳定性好、操作稳定性高的固定化马来酸顺反异构酶(Si-CLEAs);进一步研究固定化马来酸顺反异构酶的酶学性质,并将其装入填充床反应器应用于富马酸的合成。该研究为固定化马来酸顺反异构酶合成富马酸的工业化应用提供了借鉴。
1 材料与方法
1.1 菌株与引物
基因工程菌株 E.coli BL21(DE3)/pET-24a(+)-maiA、重组质粒 pET-24a(+)-maiA 由本实验室构建、保藏。
本文所用引物如下:
primer F:
5'-CCATATGTCCTCCAAGAAATCGGGATCCT ACTCGGGATCCAAGGGTTCCAAGCGTCGCATCTTG ATGAGCAACCACTACCGCATCGGCCAGATC-3';
primer R:
5'-GCTGTCCACCAGTCATGCTAGCCATATGTA TATCTCC-3'。
1.2 主要试剂
Primer star DNA聚合酶,NdeⅠ限制性内切酶,T4 DNA连接酶等:日本宝生物工程(大连)有限公司产品;马来酸,富马酸,25%戊二醛:BBI Life Sciences;正硅烷甲酯,磷酸二氢钾,硅藻土:国药化学试剂有限公司。
1.3 实验方法
1.3.1 重组菌株诱导表达及纯化方法 将菌株E.coli BL21(DE3)/pET-24a(+)-R5-maiA 在 LB 固体平板上划线活化,挑取LB平板上单菌落,接种至5 mL含 50 μg/mL卡那霉素的 LB培养基中,37℃200 r/min振荡培养8 h,取500 μL上述培养物接种至50 mL含50 μg/mL卡那霉素的LB培养基中,37℃ 200 r/min振荡培养至菌液OD600达到0.8,加入IPTG至终浓度为0.2 mmol/L,20℃诱导20 h。
收集菌体超声破碎,12 000 r/min离心10 min获得粗酶液,粗酶液经0.45 μm的滤膜过滤后用1 mL的His Trap FF crude柱对重组蛋白进行纯化。
1.3.2 马来酸顺反异构酶酶活测定方法 取100 μL游离马来酸顺反异构酶溶液 (或固定化酶悬浮液),加入50 μL浓度为1 mol/L的马来酸(KOH调至8.0)溶液,用Na2HPO4-KH2PO4缓冲液将反应体系补加到500 μL,于40℃(固定化酶最适温度为50℃)保温10 min。100℃煮沸10 min,离心,取上清液稀释50倍,测定生成的富马酸含量。
酶活力单位定义:在上述反应条件下,每分钟转化1 μmol底物所需的酶量定义为1 U。

蛋白质定量采用常规的Bradford法[15]。
Na2HPO4-KH2PO4缓冲液:由1/15 M Na2HPO4母液和1/15 M KH2PO4母液按比例配制不同pH缓冲液。
1.3.3 马来酸和富马酸的测定方法 马来酸和富马酸浓度用高效液相色谱法测定。HPLC检测条件:色谱柱 Prevail Organic Acid (250×4.6 mm,5 μm ;GraceDavisonDiscoverySciences),流动相为 25mmol/L的K2HPO4溶液pH=2.5,流速 1 mL/min,柱温40℃,紫外检测器,波长210 nm,进样量10 μL。
1.3.4 固定化酶的制备方法 将马来酸顺反异构酶融合酶重组菌株的发酵液离心,获得菌体,用Na2HPO4-KH2PO4缓冲液清洗,加入适量Na2HPO4-KH2PO4缓冲液重悬菌体至菌悬液的OD600值为35,超声破碎后离心取上清液,用硫酸铵聚集马来酸顺反异构酶融合酶、戊二醛交联并用正硅酸甲酯包埋制备固定化酶。具体过程如下:
(1)聚集条件的优化。细胞破碎液中逐步添加硫酸铵粉末,分别至饱和浓度为0~20%、20%~40%、40%~60%、60%~80%、80%~100%,置于 4℃下缓慢搅拌30 min,4℃ 10 000 r/min离心10 min,将每个饱和浓度下的沉淀蛋白均用NaHPO4-KH2PO4缓冲液溶解并透析,通过SDS-PAGE判断每一浓度梯度下目的蛋白含量,确定最佳硫酸铵添加量。
(2)交联条件的优化。交联pH的优化:调节硫酸铵沉淀后蛋白液 pH 分别至 6.5、7、7.5、8、8.7,滴加戊二醛溶液至终体积分数为0.1%,在室温下搅拌交联1 h,获得交联酶聚集体,对交联酶聚集体酶活进行检测,确定最优交联pH值。
交联剂戊二醛浓度的优化:调节硫酸铵沉淀后蛋白液pH至7.5,分别加入戊二醛至终体积分数为0.025% 、0.05% 、0.075% 、0.1% 、0.125% 、0.18% 、0.3%、0.5%、0.7%、1%,在室温下搅拌交联 1 h,获得交联酶聚集体,对交联酶聚集体酶活进行检测,确定最优戊二醛添加浓度。
交联时间的优化:调节硫酸铵沉淀后蛋白液pH至7.5,滴加戊二醛溶液至终体积分数为0.1%,分别在室温下缓慢搅拌交联 0.5 h、1 h、1.5 h、2 h、2.5 h,获得交联酶聚集体,对交联酶聚集体酶活进行检测,确定最佳交联时间。
(3)包埋条件[11]。上述最优条件下获得的交联酶聚集体用Na2HPO4-KH2PO4缓冲液洗涤3次,重悬于Na2HPO4-KH2PO4缓冲液中,并且按照硅化反应液∶交联酶聚集体∶正硅酸甲酯=1∶8∶1 的比例混合(硅化反应液为pH=8的0.1 mol/L磷酸氢二钾和0.1 mol/L氢氧化钠的混合溶液;正硅酸甲酯浓度为1 mol/L,用 1 mmol/L 的盐酸配置)[11],剧烈搅拌 30 s,静置离心收集固定化酶Si-CLEAs,并用与细胞破碎液等体积的Na2HPO4-KH2PO4缓冲液重悬。
1.3.5 马来酸顺反异构酶固定化酶活力的测定将100 μL Si-CLEAs(用粗酶液作为对照)加入到含有100 mmol/L马来酸钾的Na2HPO4-KH2PO4缓冲液中,反应液总体积为0.5 mL,于40℃反应10 min后立即用100℃煮沸10 min终止反应,适当稀释并用0.22 μm有机滤膜过滤后用高效液相色谱检测马来酸和富马酸的含量,计算出固定化酶的酶活力。

1.3.6 Si-CLEAs的酶学性质 酶促反应最适温度的测定:Si-CLEAs和游离酶分别在 30、35、40、45、50、55、60 ℃、pH 8.04条件下, 反应 10 min后测定富马酸含量,并计算酶活。
酶促反应温度稳定性的测定:Si-CLEAs和游离酶分别在55℃、pH 8.04条件下处理,每小时均取样品测定测定富马酸含量,并计算酶活。
酶促反应最适pH的测定:Si-CLEAs和游离酶分别在 pH 为 5.91、6.47、6.98、7.38、7.73、8.04、8.34、9.18以及反应温度分别为55℃或40℃的条件下,反应10 min后测定富马酸含量,并计算酶活。
Si-CLEAs的操作稳定性的测定:Si-CLEAs在最适反应温度和最适反应pH下连续反应8次,测定富马酸含量并计算酶活力,以第一次反应的酶活力为100%,分别计算相对酶活力。
1.3.7 固定化酶填充床反应器操作过程优化及操作稳定性 将100 mL的固定化酶悬浊液与200 g硅藻土充分混合后填入玻璃柱反应床 (25 cm×3.6 cm,450 mL),利用蠕动泵将底物由下向上泵入反应床中,控制催化温度40℃。
停留时间对富马酸生产的影响:将浓度为0.6 mol/L马来酸钾作为底物,泵入填充床反应器中反应,并分别控制底物停留时间为0.55、0.67、0.83、1.1、1.67 h,测定富马酸的产量,计算出富马酸转化率和体积转化速率,确定最适停留时间。
底物浓度对富马酸生产的影响:在停留时间为0.83 h 的条件下,分别用浓度为 0.2、0.4、0.6、0.8、1 mol/L的马来酸钾进行转化,测定富马酸的产量,计算出富马酸的转化率和体积转化速率,确定最佳底物浓度。
固定化酶填充床反应器操作稳定性:以优化后的停留时间和底物浓度进行富马酸连续生产,运行15批次,计算每个批次的底物转化率,由转化率的降低程度评估反应器的操作稳定性。

2 结果与讨论
2.1 马来酸顺反异构酶融合酶R5-MaiA的克隆、表达
对文献[9]报道的R5短肽的氨基酸序列进行密码子优化,获得适合于大肠杆菌表达的R5短肽基因序列,并根据该基因序列设计引物。用primer F和primer R引物,以携带编码马来酸顺反异构酶基因的重组质粒pET-24a-maiA[14]为模板,反向PCR扩增。将PCR产物用NdeⅠ酶切后自身连接,获得重组质粒pET-24a-R5-MaiA。重组质粒用NdeⅠ和HindⅢ双酶切,电泳图谱获得5 300 bp和850 bp大小两条带;用NdeⅠ和HindⅢ分别单酶切,获得6 150 bp一条带 (图1),表明R5肽段已经成功插入,进一步经DNA测序验证表明成功构建了重组质粒pET-24a-R5-MaiA。
将重组质粒pET-24a-R5-MaiA转入E.coli BL21(DE3)中,经诱导表达后,SDS-PAGE 电泳获得分子量29 000 Da左右的电泳条带,如图2所示。
利用重组蛋白C端的His标签[14],经1 mL的His Trap FF crude镍柱纯化后 (SDS-PAGE电泳分析结果见图2),在40℃pH=8.0的条件下测定重组酶R5-MaiA的比酶活为42 U/mg与MaiA的比酶活(48 U/mg)相差不大,表明融合表达R5短肽对MaiA酶活性无显著影响。
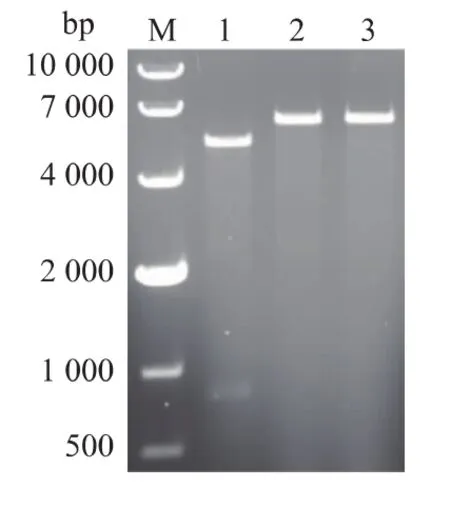
图1 pET-24a-R5-MaiA质粒酶切验证电泳图Fig.1 Identification of pET-24a-R5-MaiA by enzyme digestion

图2R5-MaiA融合酶表达与纯化SDS-PAGE图谱Fig.2 Expression and purification of R5-MaiA in E.coli
2.2 融合马来酸顺反异构酶固定化酶(Si-CLEAs)的制备
2.2.1 不同硫酸铵饱和度对融合酶(R5-MaiA)沉淀能力的影响 分别用不同体积分数的硫酸铵分级沉淀细胞破碎上清中的游离酶,从图3可以看出,在0~20%,20%~40%两个梯度的饱和硫酸铵体积分数下都有大量的R5-MaiA沉淀聚集;当饱和硫酸铵浓度在40%~60%时沉淀聚集的蛋白质中几乎不再含有R5-MaiA,并且含有大量的杂蛋白;在60%~80%和80%~100%饱和硫酸铵体积分数下R5-MaiA和杂蛋白都很少有聚集沉淀。因此选择40%的硫酸铵作为聚集沉淀的体积分数。

图3 硫酸铵分级沉淀SDS-PAGE电泳图Fig.3 Effect of ammonium sulfate concentration on R5-MaiA precipitation
2.2.2 交联pH对R5-MaiA交联酶聚集体(CLEAs)酶活的影响 交联pH对交联酶聚集体CLEAs酶活的影响如图4所示。在磷酸盐缓冲液pH 7.5的时候CLEAs的酶活最高,这是因为R5-MaiA预测的等电点在7.5附近,在此pH条件下R5-MaiA沉淀较为完全,交联反应也较充分,所以交联后酶活回收率也较高,因此选择7.5作为交联时的pH值[l1]。

图4 交联时pH对CLEAs酶活的影响Fig.4 Effect of cross-linking pH on the relative activity of CLEAs
2.2.3 交联剂戊二醛的浓度对CLEAs酶活的影响交联剂戊二醛的体积分数对CLEAs酶活的影响如图5所示。低体积分数的戊二醛使得反应液中的酶分子交联程度低,部分游离酶损失且形成的交联颗粒小导致酶活偏低;随着戊二醛体积分数的增大,CLEAs的酶活回收率不断增加,当戊二醛体积分数增加到0.1%时CLEAs的酶活最高;继续提高戊二醛的体积分数,过度的交联,导致酶活回收率不断下降。因此确定交联时戊二醛的最佳添加体积分数为0.1%。

图5 戊二醛体积分数对CLEAs酶活的影响Fig.5 Effect of concentration of glutaraldehyde on the relative activity of CLEAs
2.2.4 交联时间对CLEAs酶活的影响 交联时间对CLEAs酶活的影响如图6所示。当交联时间小于1 h时,随交联时间的增加酶活保留逐渐增大,交联时间过短不能使得酶分子充分交联,离心沉淀后使得部分游离酶损失;当交联时间为1 h时,CLEAs的酶活保留达到最高值;当交联时间大于1 h后,随着交联时间的增加,酶活保留逐渐下降,这是由于交联时间过长导致戊二醛与酶分子过分交联,破坏了酶分子的构象从而影响了酶活。因此,确定1 h为较适合的交联时间。
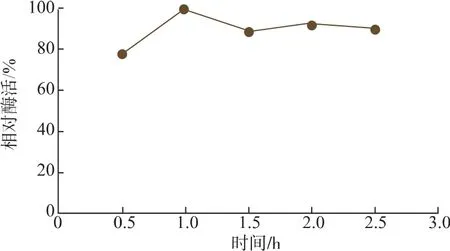
图6 交联时间对CLEAs酶活的影响Fig.6 Effect of cross-linking time on the relative activity of CLEAs
在上述最优硫酸铵沉淀条件和戊二醛交联条件下制备CLEAs的基础上,进一步利用正硅酸甲酯与R5肽段作用的特性,完成对CLEAs的包埋,即获得固定化酶Si-CLEAs,并考察该固定化酶的性质。
2.3 马来酸顺反异构酶固定化酶Si-CLEAs的性质
2.3.1 固定化酶最适酶促反应温度 图7比较了游离酶与Si-CLEAs固定化酶的最适催化温度,可见游离酶的最适酶促反应温度为40℃,而固定化酶的最适酶促反应温度为55℃。这是由于Si-CLEAs中酶分子是以共价键的形式连接在一起,使得CLEAs中的酶分子比游离酶的刚性更强,而在CLEAs外围包埋的硅也进一步增加了传热阻力,因此酶促反应的发生就需要更多的能量,才可以使酶分子活性中心与底物结合发挥催化作用。

图7 固定化酶与游离酶最适反应温度Fig.7 Optimun reaction temperature of Si-CLEAs and R5-MaiA
2.3.2 固定化酶热稳定性 游离酶经过固定化后热稳定性通常会有所提高[16],实验比较了游离酶和3种固定化酶在相同温度下的热稳定性,结果如图8所示。随着储存时间的延长,游离酶和固定化酶的酶活性均呈现下降的趋势,并且可以看出游离酶活性下降的速度要明显比固定化酶快,游离酶在55℃下的半衰期为0.5 h,直接包埋的固定化酶Si-R5-MaiA和交联酶聚集体CLEAs在55℃下的热稳定性均有提高,而固定化酶Si-CLEAs在55℃下的热稳定性最好,半衰期为4 h,因此,Si-CLEAs这种固定化方法有效提高了马来酸顺反异构酶的热稳定性。
2.3.3 固定化酶最适酶促反应pH 固定化酶的最适pH除与载体和产物性质有关外,还会受到其他因素的影响。游离酶经过固定化后其最适酶促反应pH值通常发生变化,且很难预测。由图9所示,在经过固定化后,固定化酶的最适酶促反应pH为7.3,与游离酶相比(最适反应pH为8.0)略向酸性方向偏移。

图8 3种固定化酶与游离酶热稳定性的比较Fig.8 Stability of CLEAs,Si-R5-MaiA,Si-CLEAs and free R5-MaiA at 55℃
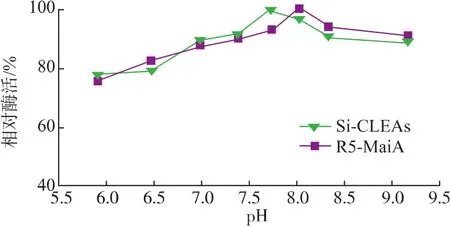
图9 固定化酶与游离酶的最适反应pHFig.9 Optimun pH of Si-CLEAs and R5-MaiA
2.3.4 固定化酶Si-CLEAs的重复使用性 固定化酶这一技术的主要目标就是制备能够重复多次使用的生物催化剂,所以固定化酶的操作稳定性是评判固定化方法的一个重要指标,并且能够影响生产成本。对3种固定化酶 Si-CLEAs,Si-R5-MaiA,CLEAs进行操作稳定性实验,结果如图10所示,Si-CLEAs在经过8个批次的重复使用后依然保留78%的酶活,其酶活保留高于CLEAs和Si-R5-MaiA,固定化酶Si-CLEAs具有良好的重复使用性。

图10 固定化酶的重复使用性Fig.10 Effect of reusability on relative activity of Si-R5-MaiA,CLEAs and Si-CLEAs
2.4 固定化酶Si-CLEAs在富马酸合成中的应用
进一步将马来酸顺反异构酶固定化酶装入填充床反应器,以马来酸为底物合成富马酸,并对反应条件进行优化。
2.4.1 停留时间对填充床反应器生产富马酸的影响停留时间是底物催化的一个重要参数,停留时间由泵入底物的流速和反应器体积大小决定,本实验通过调节底物的流速来控制停留时间。由图11可知,富马酸的转化率随停留时间的增加而增加,体积转化速率随时间的增加先增加后减少。低的停留时间虽然节约了时间但是不利于底物转化,而高的停留时间则会导致生产周期长、增加生产成本。因此综合考虑,选择50 min作为最佳停留时间。
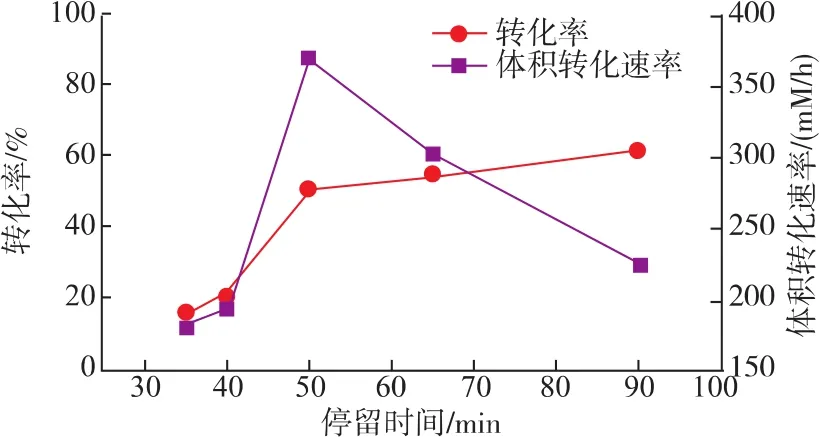
图11 停留时间对填充床反应器生产富马酸的影响Fig.11 Effect of residence time on the production of fumarate in a packed-bed reactor
2.4.2 底物浓度对填充床反应器生产富马酸的影响 底物浓度对富马酸生产的影响如图12所示,在最佳停留时间下,转化率随底物浓度的增加而降低,体积转化速率在较低浓度下很低,在中高浓度下体积转化速率维持在较稳定的水平;停留时间为50 min的条件下,此固定化酶填充床反应器可完全转化的最佳底物浓度为0.3 mol/L,此时填充床反应器的催化效率最高。

图12 底物浓度对填充床反应器生产富马酸的影响Fig.12 Effect of substrate concentration on the production of fumarate in a packed-bed reactor
2.4.3 填充床反应器生产富马酸的能力 在实际生产中,为保证富马酸工业生产的需要,富马酸的转化率要保持在95%以上,根据填充床反应器的操作稳定性,需调节底物浓度和保留时间以达到工业生产富马酸的需要,选择最佳底物浓度为0.3 mol/L,初始转化率为99%,在生产10个批次后,富马酸转化率依然保持在95%以上(图13),表明固定化酶反应器能较好的满足工业化酶法生产富马酸的需求。
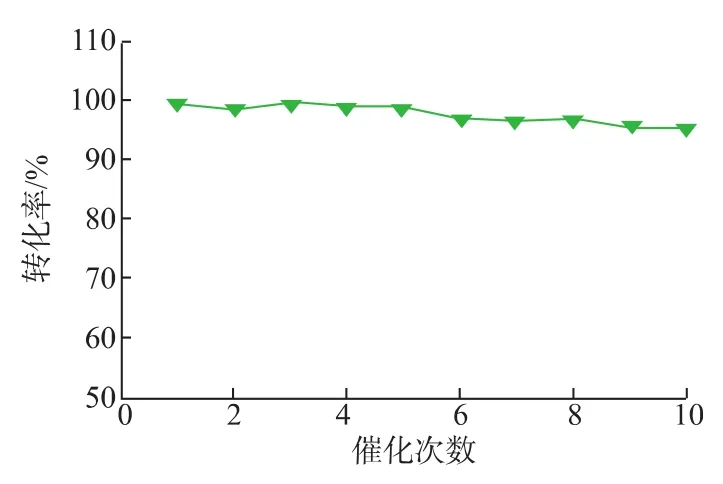
图13 填充床反应器重复生产富马酸的能力Fig.13 Reusability of Si-CLEAs in a packed-bed reactor for fumarate production
3 结 语
马来酸顺反异构酶与R5肽端融合表达后,比酶活无显著降低。以40%的硫酸铵作为沉淀剂,体积分数0.1%的戊二醛作为交联剂制得的融合马来酸顺反异构酶交联酶聚集体CLEAs,在经过自包埋处理之后形成固定化酶Si-CLEAs,其酶活回收率为60%。固定化酶的催化最适温度为55℃比游离酶提高了15℃,有利于实现马来酸顺反异构酶在极端条件下的催化应用;在55℃条件下的半衰期由原来的0.5 h提高到4 h,其热稳定性有了明显的提高;在分批进行8个批次的重复催化反应后,保留了78%的初始酶活,显示出良好的操作稳定性。Si-CLEAs固定化酶装入填充床反应器以马来酸为底物生产富马酸,重复生产10个批次后,仍可保留95%的转化率。该研究为应用固定化酶Si-CLEAs工业化生产富马酸提供了借鉴。

