靶向前列腺特异性膜抗原的核医学精准诊疗进展
王静楠 臧 洁 李 方 朱朝晖
中国医学科学院北京协和医学院北京协和医院核医学科,核医学分子靶向诊疗北京市重点实验室,核医学精准诊疗技术创新北京市国际科技合作基地,北京 100730
前列腺癌是男性最常见的恶性肿瘤,世界范围内男性癌症相关死亡原因的第三位[1]。据统计,目前约有1~2%的男性死于前列腺癌[2]。随着人类进入老龄化社会,这一威胁全球男性健康的疾病将日益严重。虽然近年来前列腺癌的早期诊断和治疗技术发展迅速,仍有较多的患者经初次治疗后再次出现血清前列腺特异性抗原(prostate specific antigen, PSA)升高或影像学进展。对于此类去势难治性前列腺癌(Castrate-resistant prostate cancer,CRPC),传统的诊疗方案已无法满足临床需要,促使核医学精准诊疗一体化(theranostics)技术迅速发展[3]。
近年来,前列腺特异性膜抗原(prostate-specific membrane antigen, PSMA)受到广泛关注。PSMA高表达于前列腺癌上皮细胞膜,其表达量与肿瘤细胞的数量及侵袭性呈正相关[4]。将与PSMA具有高亲和力的分子进行核素标记,对于难治型前列腺癌的诊断、分期、再分期和治疗正日益成为前列腺癌显像和治疗的新策略。在中国科学院发布的《2017研究前沿》中,“放射性核素标记PSMA PET显像在前列腺癌诊疗中的应用”成为临床医学领域排位第一的国际热点前沿[5]。这种针对PSMA的诊疗策略为前列腺癌患者的一体化精准诊疗提供了全新思路和里程碑式的发展[6]。目前,国内外的研究热点主要集中在研发与PSMA具有高亲和力的核素标记分子,评估其用于核医学显像和放射性核素靶向治疗等方面的价值。本文将围绕靶向PSMA的分子影像精准诊断和核素靶向治疗研究的最新进展进行综述。
1 PSMA
PSMA是一种II型跨膜蛋白,以单体或二聚体形式高表达于前列腺癌上皮细胞膜表面。与其他跨膜蛋白类似,PSMA包括三个部分:胞外段由707个氨基酸构成,跨膜段含有24个氨基酸,胞内段有19个氨基酸。胞外段具有叶酸水解酶活性及谷氨酸酶活性[7],但其在前列腺癌细胞中的酶活性尚未阐明。与特异性分子结合后,PSMA及其结合分子通过网格蛋白途径内吞进入细胞,在胞质或溶酶体中存留,部分PSMA可以再次向细胞膜转运而被重复利用[7]。
PSMA不仅仅表达于前列腺癌上皮细胞膜,在其他实体肿瘤,如膀胱癌、胰腺癌、肺癌、肾癌等的新生血管内皮细胞膜,以及正常组织器官,如唾液腺、泪腺、近端肾小管、附睾、卵巢、空回肠的管腔侧、星形胶质细胞及中枢神经系统中也有PSMA的表达[8]。在正常的前列腺上皮细胞中,PSMA仅微量表达于胞浆内及细胞顶端膜侧,而不是基底膜侧,因此不能被靶向分子结合[9]。位于胞浆内的PSMA是该跨膜蛋白N端截断后的产物,称为PSM’,其作用尚未阐明。不典型增生的前列腺组织内可见PSMA从顶端膜侧向基底膜侧转运,随着不典型增生及肿瘤侵袭性的进展,基底膜侧PSMA的表达量显著增加。研究表明,Gleason评分越高的肿瘤,PSMA/PSM’比值越高[10]。因而,PSMA可能促进了肿瘤的浸润与转移,但现有的研究仍未阐明其作用机制。
由于PSMA具有上述特性,可以研发特异性核素标记分子用于显像和治疗,对于难治性前列腺癌的诊疗具有重要意义。
2 靶向PSMA的核素标记分子
近年来,靶向PSMA的核素标记分子发展迅速,主要分为三类:单克隆抗体、适配体(aptamer)及小分子抑制剂(见表1)。
2.1 单克隆抗体
放射性核素标记的单克隆抗体是最早应用于显像的PSMA靶向分子。7E11或卡罗单抗与偶联剂连接并被放射性核素111In标记后,与PSMA的胞内段结合,可用于单光子发射计算机辅助断层扫描(single photon emission computed tomography, SPECT)显像。111In标记的7E11(111In-CYT-356, ProstaScint)是目前唯一被美国食品和药物监督管理局(Food and Drug Administration, FDA)批准的前列腺癌显像剂,并已投入商业化生产[11]。然而,7E11只能与PSMA的胞内段结合,因此只能被凋亡或坏死的细胞摄取。另外,7E11是鼠源型单抗,存在人抗鼠抗体反应。这些缺点限制了其临床应用。J591是近期被研发的人源型单克隆抗体[12],与PSMA胞外段特异性结合,克服了7E11的诸多缺点。DOTA(1,4,7,10-四氮杂十二烷-N,N,N,N-乙二胺四乙酸, 1,4,7,10-Tetraazacyclododecane-N,N’,N”,N”’-tetraacetic acid)偶联的J591可以被多种放射性核素标记:111In及99mTc标记用于SPECT显像,90Y及177Lu标记用于治疗。89Zr及64Cu标记的3/A12、3/F11、3/E7抗体用于PET显像的研究也在进行[13]。然而,单克隆抗体的局限性是不可避免的:其具有潜在的免疫原性;抗体的大分子量导致较差的肿瘤组织渗透性;较低的摄取率使得体内本底高,需要延迟显像才能达到足够的病灶/本底对比,图像质量并不理想。上述缺点限制了其临床应用。
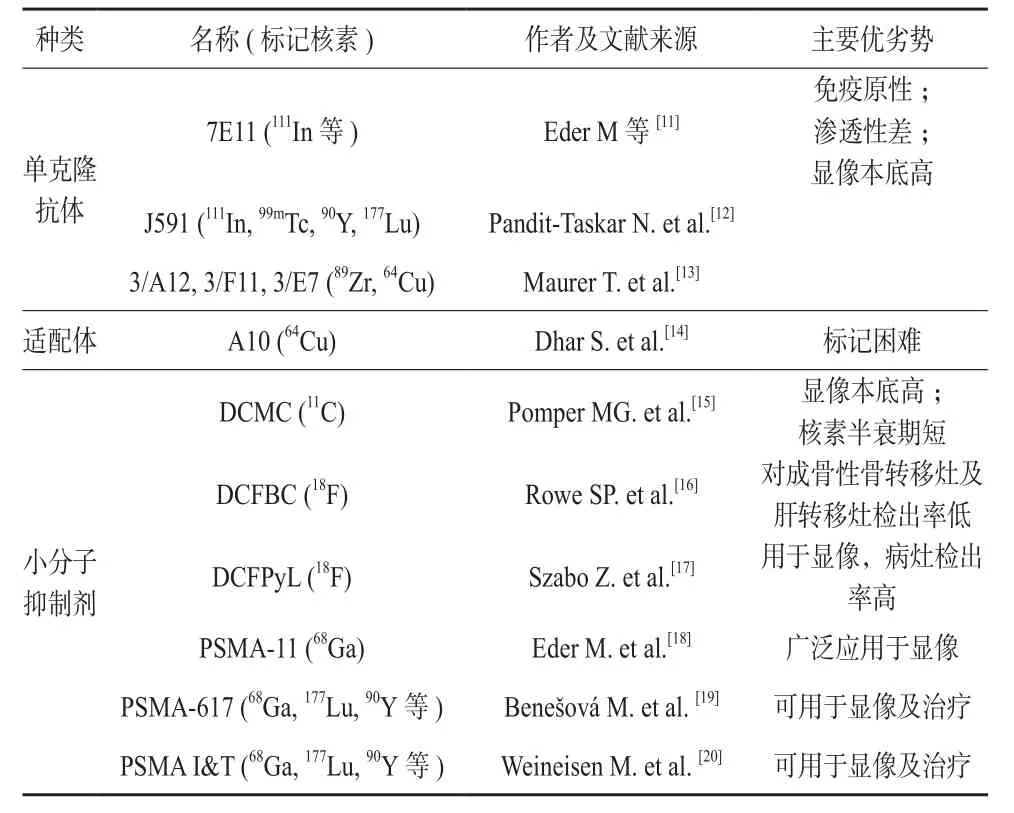
表1 靶向PSMA的核素标记分子
2.2 适配体
适配体A10是PSMA的特异性适配体。体外实验证实,携带阿霉素及顺铂的适配体A10可以协助转运这些化疗药物进入前列腺癌细胞,以达到抑制肿瘤细胞生长的作用[14]。然而,作为寡核苷酸或寡肽类物质,适配体对温度和pH变化敏感,使得核素的标记较为困难。近期,64Cu标记的DOTA偶联适配体A10已被成功合成,但是仍未见体内药代动力学及临床应用的相关报道[21]。
2.3 小分子抑制剂
PSMA的胞外段具有谷氨酸酶活性,其催化位点含有两个锌离子。PSMA的小分子抑制剂大多数为含有锌离子结合位点的谷氨酸化合物,主要分为三类:磷酸基类;巯基类;脲基类[22]。早期的研究发现,磷酸基类分子抑制剂如2-PMPA(2-磷酰基甲基酸, 2-phosphonomethyl pentanedoic acid)及巯基类分子抑制剂在肿瘤组织的摄取率低,因此后续的研究主要集中在脲基类分子抑制剂的研发[3]。
首先被研发的为11C-DCMC(N-[N-[(S)-1,3-二羧酸丙烷基]氨甲酰基]-S-[11C]甲基-L-半胱氨酸(N-[N- [(S)-1,3-dicarboxypropyl]carbamoyl]-S-[11C]methyl-L- cysteine), 该分子抑制剂的病灶摄取率及病灶/本底比并不高,且核素11C半衰期较短[15]。另一种正电子发射型显像剂18F-DCFBC(N-[N-[(S)-1,3-二羧酸丙烷基]氨甲酰基]-4[18F]氟代苄基-L-半胱氨酸,N-[N-[(S)-1,3-dicarboxypropyl]carbamoyl]-4- [18F]fluorobenzyl-L-cysteine)克服了11C-DCMC短半衰期的缺点,然而其血池分布较高,病灶/本底比仍不高,且对成骨性骨转移灶及肝转移灶的检出率低于其他影像学检查[16]。第二代18F显像剂18F-DCFPyL(2-{3-[1-carboxy-5-[[6-[18F]fluoropyridine-3-carbonyl]-amino]-pentyl]-ureido}-pentanedioic acid,2-{3-[1-羧基-5-[(6- [18F]氟代吡啶-3-羰基)氨基]-戊基]-脲基}-戊二酸)可快速在血浆中清除,注射2小时后即可显像,病灶/本底对比为18F-DCFBC的7倍以上,对病灶检出率高[17]。该显像剂的研发已较为成熟,目前正在等待FDA批准上市[3]。由于其化学属性,与18F连接的PSMA分子抑制剂不能螯合177Lu、90Y等治疗性核素,只能用于显像。
另一类脲基分子抑制剂为螯合68Ga的化合物,同样可用于正电子发射计算机辅助断层扫描(positron emission tom ography computed tomography, PET)显像。最早合成的68Ga标记的显像剂为以DOTA作为螯合剂的小分子抑制剂[23]。后续的研究发现,HBED-CC(N,N’-双[2-羟基-5-(羧乙基)苄基]乙二胺-N,N’-二乙酸(N,N’- bis[2-hydroxy-5-(carboxyethyl)-benzyl]ethylenediamine-N,N’-diacetic acid)的亲和力较DOTA高,室温下即可完成标记反应,热力学更为稳定[18]。用其作为螯合剂的显像剂68Ga-PSMA-HBEDCC(68Ga PSMA-11)得到了迅速发展,在欧洲国家被广泛应用于临床。然而,HBED-CC不能螯合177Lu、90Y。另一广泛应用的显像剂为68Ga-PSMA-DKFZ-617,该显像剂以DOTA作为螯合剂,可螯合177Lu、90Y等核素用于前列腺癌患者的核素靶向治疗。在欧洲国家,68Ga/177Lu-PSMA-DKFZ-617虽未被正式批准,但在专科医生的指导下,可以将该药物应用于前列腺癌患者的显像及核素靶向治疗[19]。另一类似的显像剂68Ga-PSMA I&T(imaging and therapy)于同时期被研发,其螯合剂为DOTAGA,同样也可螯合177Lu、90Y而用于前列腺癌的核素靶向治疗[20]。另外,64Cu[24]、123I[25]标记的显像剂亦有所报道。
PSMA小分子抑制剂克服了单克隆抗体及适配体的局限性,化学性质稳定,具有较强的组织渗透性,并能快速从本底清除以获得较高的病灶/本底比,对前列腺癌原发灶和转移灶的检出敏感性及特异性高,对转移性去势难治性前列腺癌(metastatic castrate-resistant prostate cancer,mCRPC)也表现出良好的治疗效果,成为前列腺癌显像和治疗一体化的研究热点。
3 靶向PSMA的核医学显像
3.1 诊断及分期
临床筛查疑诊前列腺癌的患者常规进行经直肠超声引导下前列腺12针系统穿刺活检确诊前列腺癌。该方法的诊断敏感性及特异性均不足,并不能准确判断肿瘤的分化及浸润程度。研究表明,穿刺活检与前列腺癌切除后病理标本的Gleason分级符合率仅69%[26]。磁共振成像(magnetic resonance imaging, MRI)引导下及磁共振-超声共同引导下的前列腺穿刺活检技术对病灶的检出率及准确率均优于经直肠超声[2],并已写入欧洲泌尿生殖放射学会(European Society of Urogenital Radiology, ESUR)的前列腺癌诊断指南。近期研究发现,在中-高危前列腺癌患者中,68Ga-PSMA-11 PET/MRI显像方法比单纯应用PET或多参数MRI(multiparametric MRI, mp-MRI)对位于前列腺内病灶的定位和检出更加准确,PET/MRI引导下的穿刺活检技术是否更有临床意义值得后续研究进一步证实[27]。
初次诊断时肿瘤的分期十分重要,关乎患者的治疗方案。目前临床上仍常规应用计算机断层扫描(computed tomography, CT)、MRI及骨显像(bone scan, BS) 对前列腺癌进行分期评估,研究者们将PSMA核医学显像与这些传统影像学方法进行了比较。
欧洲泌尿外科学会(European Association of Urology,EAU)推荐应用mp-MRI对前列腺内的病灶进行评估[28]。然而,现有的研究结果表明,应用PSMA PET/CT或PET/MRI优于mp-MRI。在一项纳入21例患者的研究中,68Ga-PSMA-11 PET/CT对于前列腺内病灶的检出敏感性可达67%,特异性可达92%,对于前列腺包膜浸润诊断准确率达71%,对于精囊腺浸润诊断准确率达86%[29]。在上文提到的另一研究中,68Ga-PSMA-11 PET/MRI不仅敏感性高于mp-MRI(76% vs. 43%),其对病灶检出率也高于mp-MRI(98%vs. 66%)[27]。但是,在一项应用18F-DCFBC作为显像剂的研究中发现,MRI对前列腺内病灶检出的敏感性高于PET/CT,这可能是由于18F-DCFBC较高的血池分布及较低的病灶/本底对比所致[30]。鉴于这些研究数量较少、规模较小,应用PSMA核医学显像评估前列腺内病灶的方法是否可以取代mp-MRI需要进一步的研究证实。
前列腺癌常发生淋巴结转移及骨转移。EAU推荐术中盆腔淋巴结清扫后组织学检查,认为是评估盆腔淋巴结转移的金标准[28]。但该方法手术耗时长、风险较大,并不适合淋巴结转移的筛查。术前利用影像学方法对盆腔及远处淋巴结转移做出准确评估具有重要意义。增强CT及MRI应用广泛,通常短径>1cm的淋巴结被认为是转移的淋巴结。然而,大多数前列腺癌转移淋巴结大小正常,用传统影像学检出困难[31]。在一篇荟萃分析中,CT和MRI对淋巴结转移的检出敏感性和特异性均较低(CT:39%, 82%; MRI:42%, 82%)[31]。由于淋巴结转移灶高表达PSMA[32],PSMA PET/CT或PET/MRI表现出明显优势。在一篇纳入130例中-高危前列腺癌患者的回顾性分析中,68Ga-PSMA-11 PET/CT或PET/MRI对淋巴结转移灶检出的敏感性、特异性、准确率均高于传统影像学(65.9-68.3%, 98.9-99.1%, 88.5-95.2%,vs. 27.3-43.9%, 85.4-97.1%, 72.3-87.6%)[33]。其他研究结果也类似[34-35]。然而,也有一篇研究认为68Ga-PSMA PET/CT对淋巴结转移灶的检出率低于MRI[36]。但该研究存在一些缺陷:纳入病例的淋巴结转移率低;病理及影像学阅片标准未统一[3]。对于骨转移及其他器官的远处转移,PSMA PET同样优于传统影像学。一项68Ga-PSMA-11 PET/CT与BS对骨转移灶检出的比较研究中,前者的敏感性(98.8-99.0% vs.82.4-86.6%)及特异性(98.9-100% vs. 91.6-97.9%)均更高[37]。另一项比较68Ga-PSMA-11 PET/CT及PET/MRI的研究发现,这两种影像学检查对淋巴结转移及骨转移病灶的检出率一致[38],均高于传统影像学检查。
PSMA PET对肿瘤的初次分期更加准确,将改变临床决策。在一项小型队列研究中,PSMA PET/CT检查使53.3%患者的初次分期结果改变,改变了33.3%患者的放疗方案[39]。但由于研究较少、样本量小,初次分期结果对改变于临床治疗方案的指导意义仍有待进一步确证。
3.2 血清学复发后再分期
初治患者在接受手术或放疗治疗后,30%~40%的患者在10年内会出现血清学生化复发(biochemical recurrent,BCR)[40]。对复发病灶的定位尤为重要。EAU推荐应用BS、腹盆腔CT、mp-MRI及11C或18F-胆碱-PET/CT定位复发病灶[28]。一项研究评估应用CT或BS对于BCR患者复发病灶的检出率,结果表明CT检出率为14%,BS检出率为11%,且检查阳性患者的血清PSA水平均较高(CT 27.4 ng/mL, BS 61.3 ng/mL)[41]。mp-MRI对于局部复发病灶的检出率明显优于CT,可检出根治性前列腺切除术后(radical prostatectomy, RP)血清PSA为0.2-1 ng/mL患者的局部复发病灶[42],但其无法对远处复发病灶进行评估。11C或18F-胆碱-PET/CT常用于评估远处复发病灶,但在低血清PSA水平下该检查对病灶的检出率较低,PSA<1 ng/mL时对病灶的检出率只有7%~31%[3],因此EAU推荐当血清PSA>1 ng/mL时才应用该检查评估远处复发病灶[28]。
众多研究表明,PMSA PET/CT或PET/MRI在BCR后再分期的应用较其他影像学检查有明显优势。在最近的一篇荟萃分析中,作者回顾了9篇共纳入983例进行BCR后再分期的患者,结果显示68Ga-PSMA PET/CT或PET/MRI对复发病灶的检出率为81%(799/983);血清PSA 0.5-0.99 ng/mL时检出率为53%(56/195),血清PSA 0.2-0.49 ng/mL时检出率为50%(72/147)[43];该研究认为68Ga-PSMA PET对于RP后血清PSA>1 ng/mL的患者复发病灶的检出有重要作用。另一项研究比较了68Ga-PSMA PET/CT和18F-胆碱-PET/CT对病灶的检出率,结果表明18F-胆碱-PET/CT检查阴性的患者有43.8%可在68Ga-PSMA PET/CT检查上检测到复发病灶[44]。
PMSA PET使得BCR后再分期发生改变,这对于临床决策具有重要指导意义。一项研究表明28.6%(20/70)准备进行骨盆挽救性放疗患者的临床决策由于68Ga-PSMA PET/CT发生了改变,包括改为手术或骨盆外放疗,或新增去势治疗及骨盆外放疗[45]。另一项研究表明68Ga-PSMA PET/CT检查后50.8%(29/57)的患者分期发生了改变,临床决策随之发生改变:其中,62.1%的患者新增同时加量调强放射治疗,27.5%的患者放疗野范围扩大,13.8%的患者由局部治疗改为全身治疗[46]。相似的结果亦有所报道[47-48]。然而,临床决策的变化对患者生存率及生活质量的影响未见报道,此部分的研究有待进一步开展。
PSMA核医学显像也存在一定的局限性:低表达PSMA的病灶可能不被检出,影响诊断的敏感性;非特异性表达PSMA的组织对显像剂高摄取,从而影响诊断的准确性,例如正常的骶髂神经节常常被误认为腹膜后淋巴结转移灶[49]。因此,我们需要对患者的影像学检查结果做出综合判读,以尽可能提高诊断准确性。
综上,PSMA核医学显像较传统影像学方法对肿瘤局部浸润、淋巴结及远处转移灶的检出更具有优势,对分期和再分期更为准确,能更准确地指导临床决策。
4 靶向PSMA的核素治疗
转移性去势难治性前列腺癌(metastatic castrate-resistant prostate cancer, mCRPC)无有效治疗方法,目前临床上常采用细胞毒性化疗药物、免疫调节、新型雄激素受体拮抗剂等进行姑息治疗,均效果不佳[50]。以PSMA为靶向的核素治疗具有极好的应用前景:PSMA高表达于前列腺癌的原发灶和转移灶;表达量与细胞的侵袭性相关;PSMA位于细胞膜表面,在与特异性分子结合后,PSMA及与其结合的分子内吞进入细胞并在细胞中存留;PSMA PET显像发现的病灶均可进行核素放射治疗,真正实现诊疗一体化[6]。
最早尝试用于治疗的核素为177Lu-J591,II期临床试验的结果表明其治疗反应较好,但存在明显的血液系统毒副作用[51]。随着小分子抑制剂的研发,核素治疗的研究不断推进。其中,以177Lu-PSMA-DKFZ-617及177Lu-PSMA I&T这两种小分子抑制剂的应用较为广泛。多项研究发现,mCRPC患者对177Lu-PSMA治疗反应好,半数以上的患者血清PSA下降≥50%,临床症状缓解,生存期延长,且血液系统毒副作用少见,无明显肾脏毒性[52-54]。剂量学研究发现,吸收辐射剂量最高的器官为唾液腺及肾脏,并不是骨髓,而对于唾液腺及肾脏的毒副作用有待长期随访观察[52]。
近期,德国核医学学会发表的一篇多中心回顾性分析对177Lu-PSMA-DKFZ-617的安全性和疗效做出了评估[55]。该研究纳入了12个研究中心的145例mCRPC患者,对这些患者进行一至四个周期的核素治疗,平均随访时间为16周。安全性方面,12%的患者发生了3-4级血液系统毒性,包括贫血、血小板减少及白细胞减少,8%的患者发生口干症,所有患者未见明显的肾脏毒性;疗效方面,45%的患者在治疗结束后血清PSA下降≥50%,40%的患者在第一个周期治疗后血清PSA即下降≥50%;生存期并未纳入该研究的评估指标。该研究指出,177Lu-PSMA-DKFZ-617的安全性及疗效高于现有的姑息治疗方法,但尚需II/III期临床试验进一步验证。该研究也指出,虽然目前常采用血清PSA下降≥50%作为治疗有效性的判定标准,但其是否优于影像学检查仍存在争议[56],其临床意义有待进一步考证。上述研究结果表明,177Lu-PSMA核素治疗对于mCRPC患者有重要意义。
另外,亦有124I/131I-MTP-1095及90Y核素治疗的报道[57]。177Lu、131I、90Y均为发射β射线的核素,但是177Lu的应用前景更为乐观。131I虽然具有较低能量的β射线,但其在体内易发生脱碘作用而并不稳定。90Y的物理半衰期仅64小时,且发射的β射线能量高。177Lu的物理半衰期为6.7天,在病灶中存留时间较长,发射的β射线射程只有0.2-0.3 mm,骨髓吸收剂量小,引起骨髓抑制的风险较90Y低[3]。因此,应用177Lu-PSMA进行核素治疗更为合适,其研究也最多。
作者课题组在177Lu-PSMA-617的基础上,引入伊文思蓝(Evans Blue, EB)改结后获得177Lu-EB-PSMA-617,以优化其血液动力学,增加在前列腺癌病灶中的摄取。初步研究发现,用于剂量学研究的30mCi177Lu-EB-PSMA-617即可对患者产生显著的治疗效果(图1)。
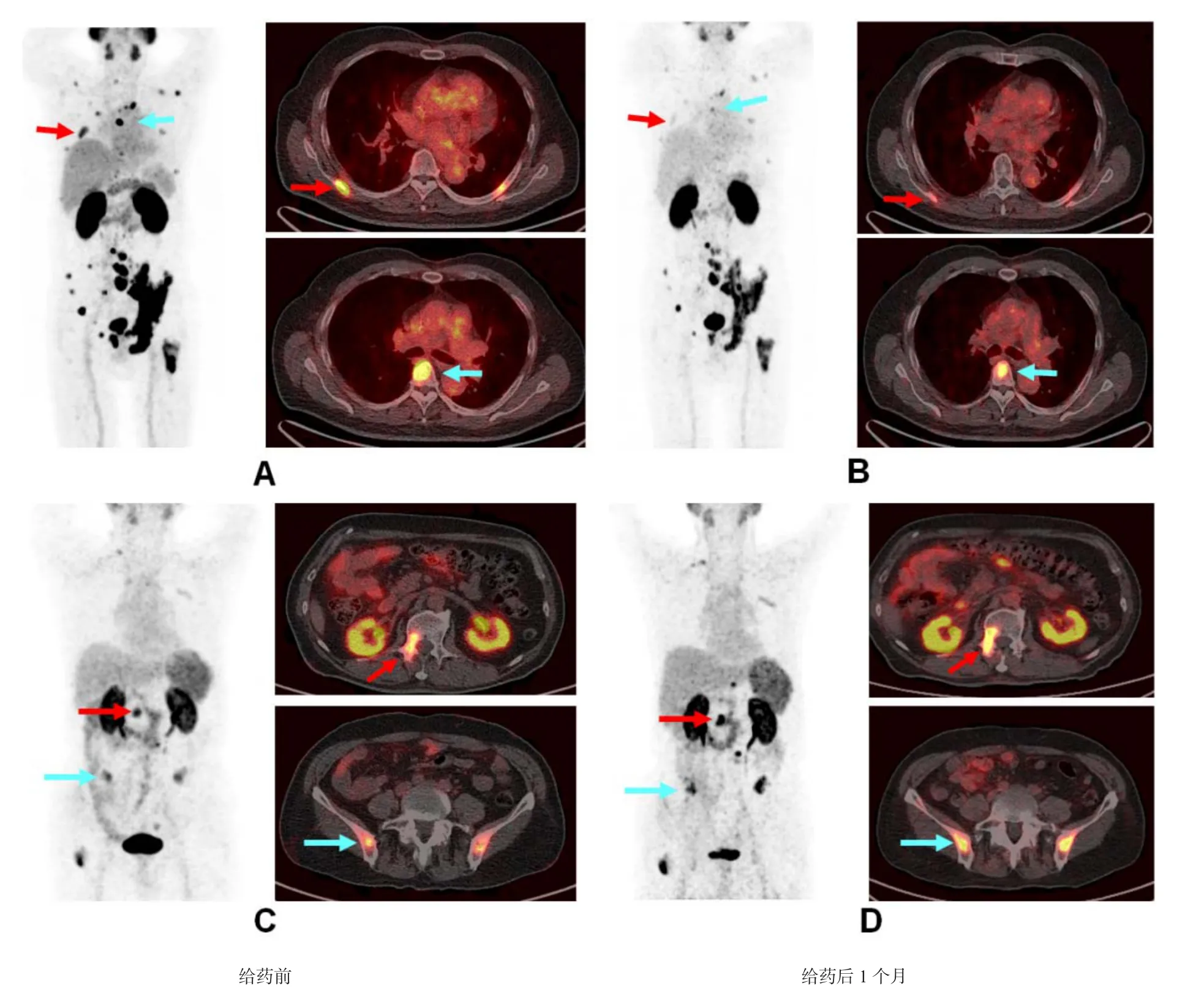
图1 177Lu-EB-PSMA-617与177Lu-PSMA-617作用效果的比较
5 结论
综上,靶向PSMA的核医学诊疗一体化策略对前列腺癌表现出明显优势,特别是对于转移性去势难治性前列腺癌疗效显著,为前列腺癌患者的临床诊疗决策提供了新方法、新思路。然而,由于各种原因,各大研究中心应用的核素标记分子种类不尽相同,同时新的核素标记分子也在不断涌现,因此不论是从显像和治疗效果还是从经济学方面来看,究竟哪一种核素标记分子最好目前仍没有定论。从近期发展趋势来看,68Ga-PSMA PET/CT指导下的177Lu-PSMA治疗正成为难治性前列腺癌精准诊疗的重要方向。总之,前列腺癌的核素诊疗一体化显示了极好的发展前景,但仍需要更多的研究数据支持,需要大型多中心临床研究的开展,并逐渐规范诊疗过程,最终实现精准医疗。

