98例肿瘤寡转移立体定向体部放疗的疗效及安全性
戴婷婷 何栋成 周锡垒 陶光州 于长华
南京医科大学附属淮安第一医院放疗科,江苏淮安 223000
20世纪末,有学者提出肿瘤寡转移概念,即远处转移发生于1个或数量有限的器官,且转移具有靶器官性[1]。寡转移意味着肿瘤处于生物侵袭性较温和的时期,是介于局部原发灶与广泛转移的过渡阶段,此时肿瘤负荷较小,具有潜在可治愈性[2]。微创手术能够彻底切除病灶,有效改善总生存期(OS)及无进展生存期(PFS),但手术对患者身体损伤大[3]。对于该类患者,立体定向体部放疗(SBRT)不失为一种替代选择。SBRT具有几何定位精准、靶区勾画精细、放射治疗精确等优势[4]。此次研究采用回顾性分析方法,总结了98例肿瘤寡转移SBRT的疗效及安全性。
1 资料与方法
1.1 一般资料
纳入标准:1)经组织细胞学或病理学检查明确Ⅳ期肿瘤诊断;2)转移病灶≤5个;各转移病灶均具有可评估性;3)于我院接受SBRT治疗且随访资料保存完整;4)无同期化疗。2012年3月—2016年8月期间98例肿瘤寡转移患者符合标准纳入此次回顾性分析。原发肿瘤:结直肠癌29例,乳腺癌21例,肺癌18例,头颈部肿瘤11例,其他19例;转移灶部位:肺转移61例,肝转移37例。转移灶数量1~5个,平均(2.21±0.65)个,98例患者共检出转移灶217个。
1.2 治疗方案
SBRT治疗,5次/周,生物等效剂量(BED)≥80 Gy,6~8 Gy/次,每次治疗前需行定位、模拟和固定:嘱患者取仰卧位,将模拟机采集的图像传输至Monaco治疗计划系统(美国ELEKTA公司),系统自动读取3D-CT图像,选择合适的窗宽/窗位勾画肿瘤大体体积(GTV),记为GTV3D;于4D-CTMIP图像勾画内靶区(ITV),记为ITVMIP。融合GTV3D、ITVMIP生成ITVCOMB,即为治疗ITV。ITV外扩5~10 mm形成计划靶区(PTV),要求100%处方剂量包括95%PTV、大气管、大血管、脊髓等危及器官,胃肠放疗剂量限制参照美国肿瘤放射治疗协作组(RTOG)第0236条协议[5-6]。患者放疗总剂量为42~54 Gy,其中74个(34.10%)病灶放疗总剂量为42 Gy,72个(33.18%)病灶放疗总剂量为48 Gy,71个(32.72%)病灶放疗总剂量为54 Gy。
1.3 分析方法
参照RTOG标准评估患者SBRT治疗开始至放疗结束后6个月内出现的不良反应,包括胃肠道反应、骨髓抑制、放射性肺炎、放射性食管炎等,评级分为1~4级[7]。此外,参照实体瘤疗效评价标准(RECIST 1.1),比较不同放疗总剂量病灶的局部控制情况[8],完全缓解(CR):所有靶病灶消失,全部病理淋巴结短直径减少至<10 mm;部分缓解(PR):靶病灶直径之和较基线水平减少≥30%;疾病稳定(SD):介于PR和疾病进展(PD)之间;PD:靶病灶直径之和的最小值直径相对增加≥20%,且靶病灶直径之和的绝对值增加≥5 mm;局部控制率=(CR+PR+SD)/总病灶数×100%。
1.4 统计学分析
对本临床研究的所有数据采用SPSS 18.0进行分析,疾病控制率以(n/%)表示,并采用χ2检验,以P<0.05为差异有统计学意义;生存曲线采用Kalpan-Meier方法绘制。
2 结果
2.1 不良反应发生情况
患者SBRT治疗后不良反应见表1,以骨髓抑制、胃肠道反应为主,发生率分别为48.98%、30.61%;患者不良反应以1级为主,均在对症治疗后好转,未见4级不良反应发生。
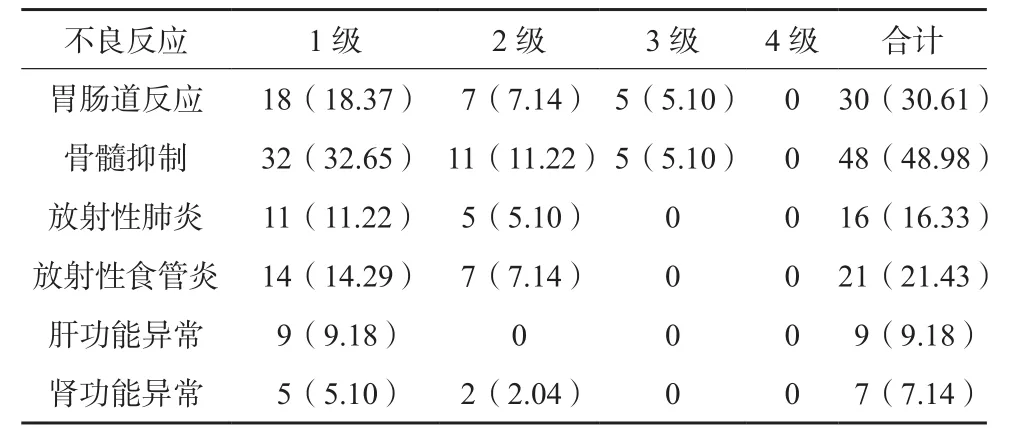
表1 98例患者SBRT治疗后不良反应发生情况(n/%)
2.2 病灶局部控制情况
217枚寡转移灶放疗后局部控制率为67.28%,其中放疗剂量48 Gy、54 Gy病灶局部控制率分别为79.17%、84.51%,均高于放疗剂量42 Gy病灶的39.19%,差异有统计学意义(P<0.05)。见表2。
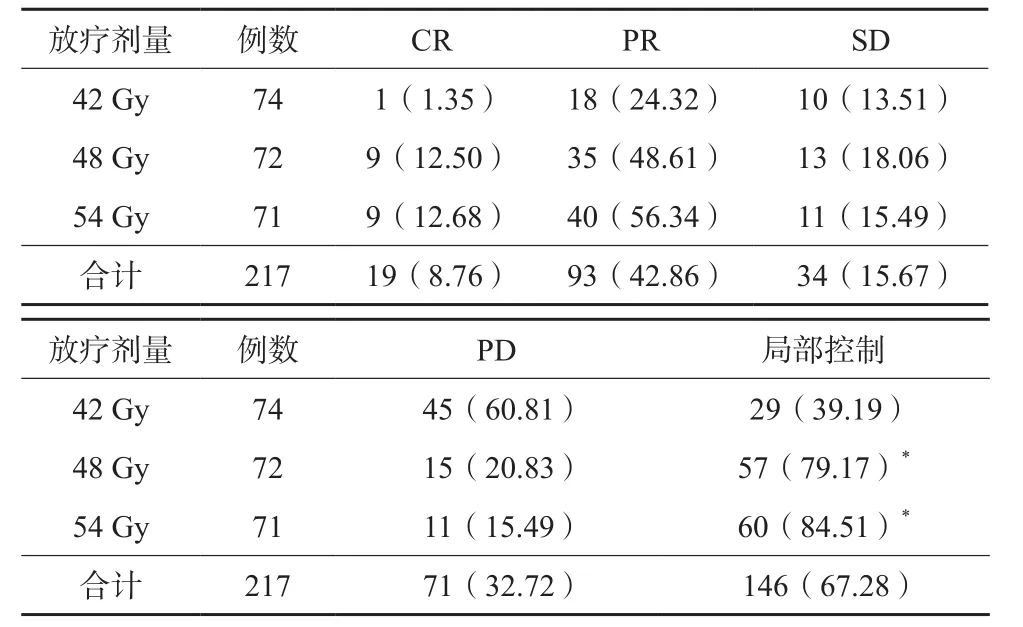
表2 217枚寡转移灶放疗后局部控制情况(n/%)
2.3 生存时间
患者SBRT治疗后1年、2年、3年PFS分别为32.65%(32/98)、25.51%(25/98)、23.47%(23/98),中位PFS为8个月;其1年、2年、3年OS分别为80.61%(79/98)、75.51%(74/98)、70.41%(69/98), 中 位 OS为 26个 月。见图1。
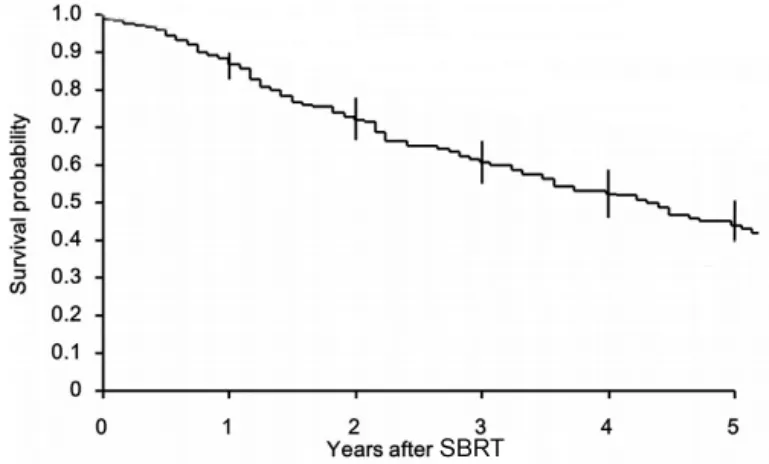
图1 98例患者生存曲线
3 讨论
远处转移是导致肿瘤患者死亡的主要原因,故通常认为复发转移是恶性肿瘤达到晚期状态的标志[9]。随着医学界对肿瘤干细胞研究的深入,发现肿瘤由局限性发展至广泛性转移是一个分阶段、分步骤的过程,因此,远处转移并不完全代表预后不良,部分合并远处转移患者仍有治愈机会[10-11]。
肿瘤寡转移是介于局部原发灶和广泛性转移之间的过渡状态,此时病灶转移数量较少、具有器官特异性且生物侵袭性较温和、暂不具备全身性播散倾向,对于寡转移病灶而言,SBRT、手术、射频消融等局部治疗均具有潜在治愈可能[12]。此次研究的98例肿瘤寡转移患者,采取大剂量低分割放疗的SBRT模式,结果显示,除10例患者发生3级不良反应外,其余患者不良反应均为1~2级,且患者不良反应经对症处理后均好转,未见难以纠正的重度不良反应,显现出该方案良好的安全性。患者胃肠道反应的发生一方面与患者原发肿瘤以结直肠癌占比最高有关,另一方面,病变邻近胃肠道或胃肠道接受较高放射剂量时也会造成胃肠道反应发生风险大幅上升[13-14],因此,对于肝脏周围的危及器官的剂量限定应严格执行,尤其是胃和十二指肠。
目前临床关于剂量分割模式的选择尚无统一规范,常用的SBRT剂量分割模式包括3次×(10~20) Gy、(4~6)次×(8~10)Gy、10次×(5.0~5.5)Gy三种[15]。在既往经验的基础上,本研究SBRT剂量分割方案为5次×(6~8)Gy,以期通过适当增加SBRT频次、降低单次放射剂量,在达到相同治疗效果的同时提高患者耐受性。结果显示,病灶放疗总剂量为42 Gy的74枚病灶,其局部控制率仅为39.19%,而放疗总剂量达到48 Gy、54 Gy的病灶,其局部控制率分别达到79.17%、84.51%,说明放疗总剂量越高,肿瘤局部控制率越理想,而以48~54 Gy作为寡转移病灶放疗总剂量,有望实现疗效与安全性的平衡。
需要注意的是,SBRT并不适用于所有肿瘤寡转移患者,若患者病灶接近消化道,SBRT可能出现穿孔、溃疡、出血风险,实施过程中应予以重视[16]。对于肿瘤体积巨大、伴门静脉瘤栓、合并肝功能损害或严重肝硬化患者而言,SBRT的选择应慎之又慎。SBRT的适应证一般为:瘤体相对规则,最大直径在6 cm范围内。此外,若病变位于肝门区或邻近大血管、胆管系统,或病变位于横隔下、肝门表面,亦可行SBRT治疗[17]。此外,有研究显示,对于非小细胞肺癌寡转移患者而言,BED应适当提高至100~150 Gy[18],说明针对原发肿瘤类型与寡转移灶设定不同的BED,也是确保治疗效果的关键所在,值得进一步关注。
综上所述,SBRT治疗肿瘤寡转移的疗效随放射剂量的增加而提高,将放射剂量控制在48~54 Gy时,能够取得疗效与安全性的平衡,利于患者PFS与OS的改善,针对不同原发灶和转移灶的放疗剂量选择标准,是今后SBRT治疗肿瘤寡转移需要关注的重点研究方向。

