过表达PDCD4逆转胃癌顺铂耐药的初步机制
柳 丹,汤志明,赵红艳,柯 镜,白 磊,牛成群,金佳晴,武福云,李 珊
0 引 言
化疗是中晚期胃癌患者的主要治疗选择,其中铂类是胃癌化疗最为重要且基础的一线治疗药物[1-4]。顺铂是一种中性的、正方形Pt (CN)配合物。在中国以顺铂为主或有顺铂参加配伍的胃癌化疗方案占所有化疗方案的70%~80%。铂类引起的DNA损伤可以通过激活多种信号转导途径进而激活细胞凋亡信号,当信号转导途径被异常激活或抑制时,细胞会表现出对铂类药物的抵抗、凋亡抑制[5]。胃癌细胞对顺铂耐药性的产生常使化疗难以奏效并最终导致化疗失败。因此,如何提高胃癌细胞对顺铂的敏感性、避免化疗耐药性的产生是目前亟待解决的临床问题。
程序性细胞死亡因子(programmed cell death protein 4, PDCD4)是近年来新发现的一类促凋亡基因,我们前期的研究也发现过表达PDCD4能够通过抑制抗凋亡蛋白Bcl2的表达起到促进宫颈癌细胞凋亡的作用[6]。PDCD4还可通过结合并抑制翻译起始因子eIF4A发挥抑制蛋白质翻译的功能,有研究发现,PDCD4及PDCD4-eIF4A复合物的表达下降,多药耐药基因(multiple drug resistance gene1, MDR1/P-gp)的表达量会增加,肿瘤细胞的增殖增强[7-8]。这一结果证明PDCD4和肿瘤化疗敏感性直接相关,但关于 PDCD4对胃癌细胞顺铂敏感性的影响尚未明确,PDCD4的下游调控基因也未阐明。
丝氨酸/苏氨酸蛋白激酶/糖原合酶激酶β(glycogen synthase kinase-3β, GSK3β)途径在控制细胞凋亡的过程中起着非常重要的作用[9]。GSK3包含两种亚型 GSK3α和 GSK3β,在细胞内呈组成性激活[10]。GSK3β是一个在进化上高度保守并且广泛表达的丝氨酸苏氨酸激酶,除了可以调控糖代谢,进一步研究发现GSK3β还可磷酸化一系列底物,包括代谢相关蛋白、信号传导通路蛋白、结构蛋白和一些转录因子,从而影响细胞的生存与凋亡[11-13]。GSK3β N末端丝氨酸残基(Ser9-GSK3β)的磷酸化可导致其活性抑制,从而抑制细胞凋亡的发生,促进细胞的存活[14]。因此,在本研究中,我们通过过表达PDCD4,探究其是否通过Akt/GSK3β信号通路对胃癌细胞顺铂耐药产生影响,为胃癌顺铂耐药机制的阐明提供新的分子机制,也为临床上逆转胃癌顺铂耐药提供潜在的基因靶点。
1 材料与方法
1.1试剂抗PDCD4、Bak、BCL-2、PARP多克隆抗体购自武汉三鹰公司,抗pGSK3β(S9)、pAkt(S473)单克隆抗体购自CST公司;LY294002、wortmannin购自 Sigma 公司;胃癌细胞系细胞系SGC7901购自中科院上海细胞所;胎牛血清购自杭州四季青公司;RPMI-1640培养基购自Hyclone公司;青链双抗购自杭州吉诺公司;PVDF膜购自Millipore公司;M-PER、蛋白酶抑制剂、BCA检测试剂盒、ECL化学发光检测试剂盒购自Pierce公司。
1.2细胞培养与转染胃癌顺铂耐药细胞株SGC-7901/DDP购自南京凯基生物有限公司,胃癌顺铂敏感细胞株SGC-7901购自中国科学院典型培养物保藏委员会细胞库,将胃癌顺铂耐药细胞株SGC-7901/DDP培养于含500 ng/mL DDP的RPMI-1640完全培养基以维持细胞的耐药性,SGC-7901培养于RPMI-1640完全培养基中,5% CO2、37 ℃和饱和湿度的培养箱中进行培养。我们检测了胃癌顺铂耐药细胞株SGC7901/DDP和其同源细胞系SGC7901的IC50,我们发现SGC7901细胞系的IC50为(20.3±2.23)μmol/L,而SGC7901/DDP的IC50为(42.5±3.68)μmol/L。
细胞转染按照lipofectamine 3000说明书进行,将pCMV空载质粒和pCMV-PDCD4质粒转染至SGC7901/DDP细胞系中,然后再进行G418筛选14 d,培养阳性克隆,最后形成稳定过表达pCMV和PDCD4的细胞株。转染效率用荧光显微镜﹑荧光定量PCR进行验证。顺铂(5 μg/mL,孵育12 h)﹑特异性Akt激活剂SC79(4 μg/mL,孵育4 h)作用后,再检测PDCD4过表达组对顺铂的敏感性是否产生影响。实验分为对照组(仅转染pCMV质粒),高表达组(仅转染pCMV-PDCD4质粒),对照加药组(转染pCMV质粒并加入顺铂处理),高表达加药组(转染pCMV-PDCD4质粒并加入顺铂处理),进行细胞免疫荧光﹑流式细胞术、RT-PCR和Western blot实验。实验分为空载加药组(转染pCMV质粒并加入顺铂处理)﹑PDCD4加药组(转染pCMV-PDCD4质粒并加入顺铂处理)和PDCD4加激活剂组(转染pCMV-PDCD4质粒,先加入SC79再加入顺铂处理)进行pAkt回补实验。
1.3MTT取对数生长期细胞,按2×103个/孔接种于96孔板,放入37 ℃、5% CO2培养箱继续培养。24 h后,将不同浓度的顺铂(10~80 μmol/L)分别加入相应各孔。继续培养48 h后,每孔加入5 mg/mL的MTT,4 h后弃上清再加入DMSO,至于振荡器中剧烈震摇10 min,使紫色结晶充分溶解。于酶标仪上570 nm处测定各孔波长吸光光度值,公式如下:
细胞存活率=(加药组-空白对照组)/(对照组-空白对照组)×100%
1.4细胞增殖实验在7901细胞中分别转染ShNC和ShPDCD4质粒,24 h后,用PBS洗涤1次,换新鲜培养基,吹打混匀后吸取100 μL进行细胞计数,调整细胞密度为1×105个/mL,将调整好密度的细胞加入12孔板。37 ℃、5% CO2的孵箱培养4 h后细胞处于生长对数期,加入5 μmol/L的DDP,12、24、36、48 h后,取100 μL细胞悬液与睢虫蓝混合,进行活细胞计数,每组细胞计数8次后取平均值绘制细胞生长曲线。
1.5实时荧光定量PCR细胞总RNA的抽提采用 TRIzol 法。取2 μg总RNA逆转录至终体积为20 μL,采用SYBR Green 实时荧光定量PCR方法检测目的基因mRNA的表达。用于Real-time PCR的引物(PDCD4和GAPDH)来自参考文献[6]。采用Bio-Rad荧光定量PCR仪,95 ℃ 3 min;95 ℃ 3 s,60 ℃ 30 s,72 ℃ 30 s,40个循环,并收集溶解曲线。GAPDH作为内参基因,分析目的基因的相对表达水平。
1.6Westernblot用含cocktail蛋白酶抑制剂的M-PER裂解液200 μL裂解细胞30 min,所有操作均在冰上进行。于4 ℃以10 000×g离心10 min,收集上层液体。取部分样品进行BCA法定量分析并调整上样量至20 μg。SDS-PAGE电泳后,将蛋白质转印至PVDF膜上。5%的BSA孵育封闭后,一抗按照1∶1000稀释,并放置于4 ℃中孵育12 h。HRP标记的二抗按照1∶10 000稀释,室温孵育2 h,使用ECL化学发光检测试剂盒进行检测。
1.7细胞免疫荧光检测刺激细胞发生凋亡后,吸尽培养液,加入固定液,固定10 min或更长时间(可4 ℃过夜)。细胞培养物中加入约1/10细胞培养基体积Hoechst染色液,充分覆盖住待染色的样品。在37 ℃培养细胞10~20 min。用PBS洗细胞2次。然后将样本至于荧光显微镜下观察。激发波长350 nm,发射波长460 nm。
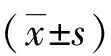
2 结 果
2.1PDCD4稳定过表达的SGC7901/DDP细胞株构建高表达组PDCD4蛋白和mRNA表达较对照组明显升高(P<0.05),高表达加药组PDCD4蛋白和mRNA表达较对照加药组明显升高(P<0.05)。见图1、图2。

1:对照组; 2:高表达组; 3:对照加药组; 4:高表达加药组

1:对照组; 2:高表达组; 3:对照加药组; 4:高表达加药组
2.2PDCD4参与调控胃癌细胞对顺铂的敏感性通过Hoechst染色结合荧光显微镜观察凋亡细胞形态改变,结果发现,相较于对照组,对照加药组虽然细胞数目减少,但细胞核形态完整,细胞核边缘清晰高,大小正常。但是相对于高表达组,高表达加药组中细胞核结构不完整、核固缩、染色质聚集浓染等现象出现增多,细胞出现凋亡的比例增加。见图3。流式细胞术检测细胞早期凋亡水平的结果显示,对照组细胞早期凋亡水平为15.15%较对照加药组(21.08%)明显降低(P<0.05);高表达组细胞早期凋亡水平为17.01%,而高表达加药组细胞早期凋亡水平上升至25.22%,差异有统计学意义(P<0.05),见图4。同时,为了进一步证实PDCD4的表达与DDP耐药的相关性,我们在DDP敏感的同源细胞系7901中利用ShRNA敲低PDCD4的表达,利用MTT和细胞生长曲线实验发现,PDCD4的表达缺失将导致7901细胞对DDP的敏感性下降,促进细胞的生长和存活。

a:对照组; b:高表达组; c:对照加药组; d:高表达加药组

a:对照组; b:对照加药组; c:高表达组; d:高表达加药组
Figure4PDCD4facilitatethepro-apoptosisofDDPingastriccancercells
2.3过表达PDCD4导致pAkt表达降低和GSK3β磷酸化抑制通过Western blot, 我们发现,相较于对照加药组,高表达加药组中pAkt、pGSK3β和BCL-2的表达量均有明显降低(P<0.05);而相较于对照加药组,高表达加药组中促凋亡蛋白BAK的表达水平则明显升高(P<0.05),见图5。通过与内参蛋白GAPDH相比较,各组中蛋白相对表达水平见表1。
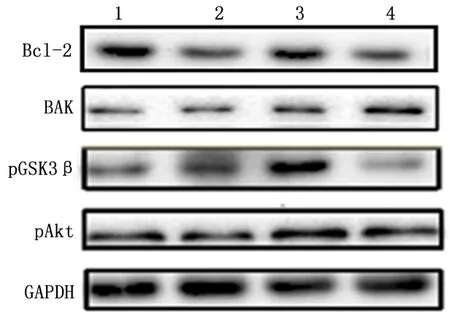
1:对照组; 2:高表达组; 3:对照加药组; 4:高表达加药组
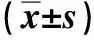
表 1 过表达PDCD4抑制pAkt/pGSK3β通路蛋白的表达水平
对照加药组相比,*P<0.05,**P<0.05
2.4PDCD4过表达通过pAkt/pGSK3β信号通路促进细胞凋亡PDCD4加药组pAkt、pGSK3β表达较空载加药组、PDCD4加激活剂组明显降低(P<0.05),PARP(C)表达较空载加药组、PDCD4加激活剂组明显升高(P<0.05)。见图6。

1:空载加药组; 2:PDCD4加药组; 3:PDCD4加激活剂组
3 讨 论
化疗耐药的相关机制尚未完全阐明,主要机制包括:①通过基因突变使耐药基因发生选择性上调,产生耐药;②细胞凋亡通路受阻:如凋亡抑制基因的表达增强,使肿瘤细胞凋亡受到抑制,产生耐药;③损伤修复系统失调等[15]。其中,细胞增殖与凋亡的失平衡被认为是肿瘤化疗耐药发生的一个重要原因[16]。尽管为了逆转DDP的耐药性已做了各种尝试,但到目前为止,成功的例子非常有限。
PDCD4基因最早是在小鼠体内发现的抑癌基因。已知人PDCD4基因定位于10q24,cDNA全长约3.5kb,其中编码区约1.4kb[5]。在PDCD4的氨基侧有两个重要的α-螺旋结构区,PDCD4通过该功能域与真核细胞翻译起始因子eIF4A结合,从而抑制核糖体复合物的形成和蛋白质的合成,进而促进细胞凋亡[17]。除此之外,最近的研究还表明PDCD4能够与PolyA结合蛋白的相互作用,通过不依赖eIF4A途径,直接介导基因转录抑制[18]。PDCD4 低表达参与多种恶性肿瘤形成,而正常表达或高表达的PDCD4 可通过抑制基因转录、翻译等过程促进细胞的凋亡。研究发现,在肝癌细胞中如果诱导 PDCD4 的表达将启动凋亡途径[19],而运用MTT 法检测同样浓度DDP中卵巢癌细胞系 SKOV3-PDCD4、SKOV3-MOCK中细胞生存率,发现 PDCD4过表达可增强卵巢癌细胞对DDP的化疗敏感性,并且沉默表达 PDCD4 可降低卵巢癌对化疗敏感性[20]。进一步的研究证明 PDCD4 和DDP联合治疗将明显抑制卵巢癌细胞系的生长,其机制可能是通过上调死亡受体DR5诱导细胞凋亡[21]。
通过构建PDCD4 过表达载体,我们发现在胃癌耐药细胞系SGC7901/DDP中增加PDCD4的表达量可上调细胞对DDP的敏感性,促进DDP引起的细胞凋亡。细胞凋亡是一个涉及多条信号通路、调控精细复杂的过程。在参与调控细胞凋亡的众多信号转导通路中,Akt是一种丝氨酸/苏氨酸激酶,又称蛋白激酶B,与蛋白激酶A﹑C高度同源,可通过直接磷酸化多种转录因子,如核因子-κB和哺乳类动物雷帕霉素等参与调节多种生命活动过程[22]。pAkt是其发挥作用的关键,GSK3β是下游的一个重要蛋白,它对于细胞存活来说是必需的,目前普遍认为它是一种细胞抑制因子,当Akt被激活以后,GSK3β的位点被磷酸化,其活性被抑制[23],肿瘤细胞的活性与GSK3β的抑制密切相关,GSK3β的活性抑制可能是肿瘤细胞的化学耐药的以一种机制。因此,pAkt/pGSK3β通路是重要的细胞抗凋亡、促存活的转导途径,该通路与多种恶性肿瘤的发生、发展及耐药密切相关[24-26]。Wang等[27]研究发现,PDCD4能够通过PI3K/Akt信号通路调控肿瘤坏死因子相关凋亡配体(tumor necrosis factor-related apoptosis-inducing ligand, TRAIL)引起的胃癌细胞凋亡,增强细胞对TRAIL的敏感性;另一方面,Feng等[28]研究也证实PDCD4能够在神经母细胞瘤SH-SY-5Y细胞中通过Akt/GSK3β信号通路调控神经细胞的凋亡。而在本实验中我们发现,PDCD4过表达可抑制胃癌耐药细胞中pAkt/pGSK3β通路的活性,从而促进DDP引起的耐药细胞的凋亡。而SG79作为Akt激活剂,在加入SG79后,PDCD4促进DDP诱导耐药细胞凋亡的效应不再出现,说明了PDCD4促进DDP引起的细胞凋亡正是通过pAkt这一关键位点实现的。我们的研究发现,PDCD4逆转胃癌顺铂耐药与凋亡信号通路的激活有关,但是除pAkt/pGSK3β信号通路之外,是否还有其它通路的参与及其具体的调控机制还有待进一步的研究。
综上,本研究提示在耐药细胞中过表达PDCD4可抑制pAkt/GSK3β信号通路,促进细胞凋亡的发生,从而逆转胃癌DDP耐药的发生发展。这将为胃癌的耐药机制提供新的思路与方法,也为临床上逆转胃癌DDP耐药提供了新的分子靶标。

