玉米苞叶HPLC指纹图谱的研究
周曙光,甄丹丹,陈明伟,丘 琴,甄汉深
(1.广西壮族自治区人民医院,广西 南宁 530021;2.广西中医药大学,广西 南宁 530200)
玉米苞叶也称玉米苞皮,是禾本科玉蜀黍属植物玉米(Zea mays L)果穗外部的包被部分[1],为玉米收割后的废弃物。我国是玉米的生产大国,玉米苞叶资源丰富,其含有大量的纤维素、一定量的淀粉、总黄酮及单糖多糖等活性成分。研究表明,玉米苞叶具有降低血脂[2-4]、抗氧化[5]、抑制 α-糖苷酶活性而降糖等药理作用[6]。目前还没有关于玉米苞叶的质量标准研究,为此,笔者对广西十个不同产地玉米苞叶的HPLC指纹图谱进行研究,为建立玉米苞叶质量标准提供依据,为玉米苞叶的进一步开发和利用提供参考依据。
1 实验仪器与试药
1.1 仪器 Alliance e2695高效液相仪(美国沃特世);超声波清洗器(昆山市超声仪有限公司);Millipore Simplicity-185超纯水仪(美国密里博公司);AJ150电子天平分析天平(瑞士梅特勒);色谱柱:非罗门OOG-4435-EO(C18,4.6 mm×250 mm,5 μm)。
1.2 试剂与试药 乙腈(德国默克股份有限公司,色谱纯);甲醇(德国默克股份有限公司,色谱纯);乙酸乙酯(国药集团化学有限公司,分析纯,批号:20140320);95%乙醇(广东省化学试剂工程技术研究开发中心,分析纯,批号:20130715);正丁醇(上海申博化工有限公司,分析纯,批号:20140620);冰乙酸(天津市光复精细化工研究所,色谱纯,批号:20150930);超纯水。本实验所用玉米苞叶经广西一心药业马利飞副主任药师鉴定为禾本科玉蜀黍属植物玉米(Zea mays L)的苞叶。药材来源见表1。

表1 10个不同产地的玉米苞叶
2 方法与结果
2.1 供试品溶液的制备 取玉米苞叶药材粉末约5g,精密称定,置50ml锥形瓶中,加入30ml95%乙醇溶液,摇匀,于超声波清洗器中超声提取45min,冷却,过滤,置于水浴锅上挥干溶剂,加5 ml甲醇溶解,过0.22 μm微孔滤膜,即得供试品溶液。
2.2 对照品溶液的制备 精密称定芦丁对照品56.66mg,置25 ml容量瓶中,加70%乙醇溶解,定容至刻度,摇匀,即得对照品溶液。
2.3 色谱条件 色谱柱:phenomenonC18(5μm,4.6mm×250 mm)色谱柱;流动相系统见表 2;检测波长:280 nm;柱温:25 ℃;进样量:20 μl;流速:0.8 ml/min。

表2 流动相组成
2.4 方法学考察
2.4.1 精密度试验 按2.1项下方法制备供试样品溶液,按2.3项下的色谱条件下连续进样6次,记录色谱图。计算保留时间和峰面积的精密度。保留时间RSD值为0.09%~0.47%,峰面积的RSD值为0.64%~5.17%。RSD值均符合仪器精密度要求,结果见表3、表4。
2.4.2 重复性试验 精密称取同一产地玉米苞叶6份,各约5 g,按2.1项下制备供试品溶液,并按2.3项下的色谱条件测定。结果,保留时间的RSD值为0.08%~0.50%,峰面积的RSD值为0.02%~2.08%,结果表明重复性良好。结果见表5、表6。

表3 玉米苞叶精密度试验结果(保留时间)

表4 玉米苞叶精密度试验结果(峰面积)
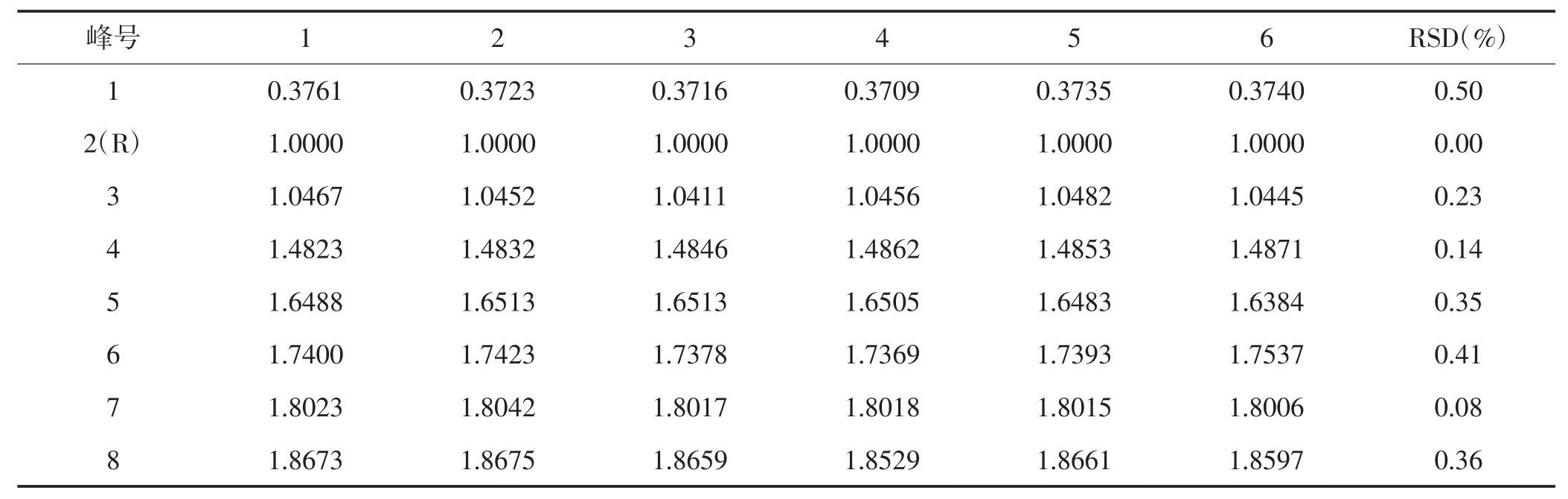
表5 玉米苞叶重复性试验结果(保留时间)
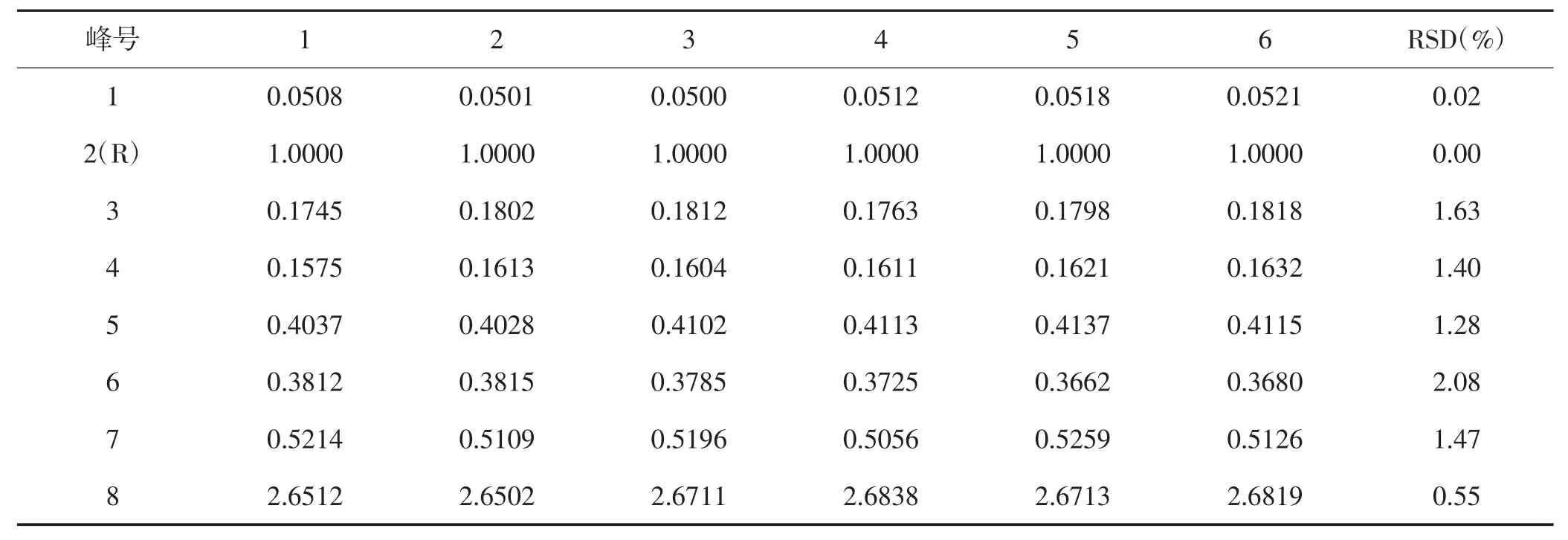
表6 玉米苞叶重复性试验结果(峰面积)
2.4.3 稳定性试验 取玉米苞叶1份,约5 g,按2.1项下供试品溶液制配方法制配,并按2.3项下的色谱条件测定,记录图谱。分别在 0 h、2 h、4 h、8 h、12 h、24 h检测图谱,考察稳定性。结果各色谱峰的保留时间RSD值为0.07%~0.51%,峰面积的RSD值为0.50%~1.78%。说明供试品在24 h内稳定性良好。见表7、表8。

表7 玉米苞叶稳定性试验结果(保留时间)

表8 玉米苞叶稳定性试验结果(峰面积)
2.5 建立指纹图谱
2.5.1 空白试验 按2.3项下的条件测定,以提取溶剂为供试品,记录图谱。提取溶剂及流动相中没有杂质干扰。结果见图1。
2.5.2 延长冲洗试验 取一供试品溶液,按2.3项下的色谱条件进样,梯度洗脱120 min。从图上可以看出60 min以后再也没有其他色谱峰出现。见图2。
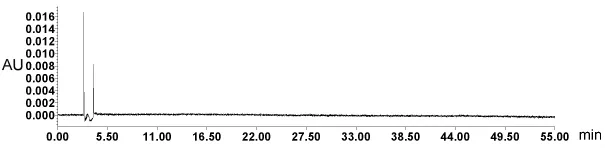
图1 空白溶剂色谱图
2.6 参照峰的建立 依照指纹图谱研究的有关规定,制定指纹图谱参照物。由供试品中所含化学成分的性质,选择合适的对照品作为参照物。本课题实验研究中,2号峰为已知物芦丁。所以选择2号峰为参照峰,进行相对保留时间和相对峰面积的计算,符合指纹图谱的要求。按2.3项下的色谱条件取对照品溶液和供试品溶液分别进样,结果见图3和图4。

图3 芦丁对照品色谱峰

图5 A号样品色谱图

图2 玉米苞叶120分钟色谱图
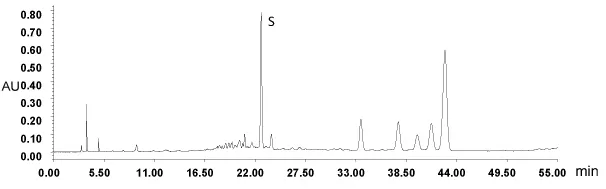
图4 玉米苞叶样品色谱峰
2.7 各批玉米苞叶的指纹图谱的采集 取10批玉米苞叶按2.1项下供试品溶液制备方法配制供试品溶液,再按2.3项下的色谱条件测定,分别记录各色谱图,见图5~图14。10批玉米苞叶叠加色谱图见图15。

图6 B号样品色谱图

图7 C号样品色谱图

图8 D号样品色谱图

图9 E号样品色谱图

图10 F号样品色谱图
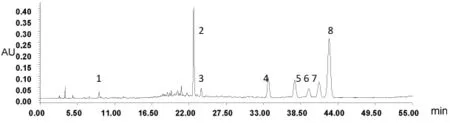
图11 G号样品色谱图
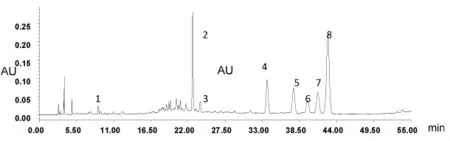
图12 H 号样品色谱图

图13 I号样品色谱图

图14 J号样品色谱图

图15 10批不同产地玉米苞叶叠加色谱图
2.8 共有指纹峰的标定 采用国家药典颁布的中药色谱指纹图谱(2012.1版本)评价软件进行自动匹配10批玉米苞叶药材,以2号色谱峰芦丁为参照图谱,标定其中匹配数目8个色谱峰为共有指纹峰,以平均数法作为对照指纹图谱的生成方法,设定时间宽度为0.1 min,提取玉米苞叶药材的共有模式建立对照指纹图谱,见图16。

图16 共有模式建立对照指纹色谱图
本实验选择玉米中成分含量比较稳定的2号色谱峰—芦丁为指纹图谱参照峰,设定参照峰的相对保留时间和相对峰面积为1,以此为基准分别计算出10批玉米苞叶的相对保留时间和相对峰面积,结果见表9、表 10。
2.9 10批玉米苞叶非共有峰面积的百分比 见表11。
2.10 玉米苞叶药材相似度评价 见表12。由结果可以看出,10批不同产地的玉米苞叶药材的相似度均大于0.8,相似度较好。

表9 10批玉米苞叶的相对保留时间

表10 10批玉米苞叶的相对峰面积

表11 10批玉米苞叶非共有峰面积的百分比

表12 玉米苞叶药材相似度
3 讨论与小结
3.1 供试品的制备方法考察 本实验分别用水、95%乙醇、乙酸乙酯作为提取溶剂,分别对玉米苞叶进行超声提取和回流提取,结果以95%乙醇超声提取的提取结果较好。
3.2 色谱柱的选择 本实验分别考察了Thermo C18(5 μm,250 mm×4.6 mm)色谱柱、Agilent WondaSil C18-WR(5 μm,250 mm×4.6 mm)色谱柱和 phenomenon C18(5 μm ,250 mm×4.6 mm)色谱柱。结果 phenomenon C18(5 μm,250 mm×4.6 mm)色谱柱分离出来的色谱峰比较丰富,且分离效果较好。
3.3 流动相的选择 本实验分别考察了甲醇-水系统、甲醇-0.1%冰乙酸系统、乙腈-水系统、乙腈-0.1%冰醋酸系统,结果提示乙腈-0.1%冰醋酸为最理想的流动相,该条件下峰形尖、较对称、不拖尾、无阴性干扰。
3.4 检测波长的确定 本实验使用了DAD检测器,对样品进行190~400 nm全波长扫描,获得3D图,并重点考查了 250 nm、280 nm、300 nm、320 nm、340 nm波长处色谱图。结果显示在色谱峰最丰富的波长为250 nm,但是分离度差而且芦丁对照品出峰不明显。综合考虑分离度及对照品的出峰情况,最终确定280nm为本指纹图谱实验的检测波长。
3.5 柱温的选择 本实验分别考察了20℃、25℃和30℃三个不同柱温的色谱图,三个图总体相差不大,但25℃峰形整体比较好而且基于对色谱柱和仪器的保护,所以选择25℃为检测温度。
3.6 流速的确定 本实验分别考察了0.5 ml/min、0.8 ml/min和1.0 ml/min流速对有效成分出峰的影响。结果0.5 ml/min、1.0 ml/min流速的色谱图分离效果不好,因此选用0.8 ml/min流速。
3.7 小结 本实验采用HPLC法对10批不同产地玉米苞叶进行HPLC指纹图谱研究,并采用相似度软件对色谱峰数据进行评价,建立了玉米苞叶HPLC指纹图谱,结果表明,各批次玉米苞叶的整体图貌基本一致,确定了8个共有峰,相似度均在0.8以上。因此HPLC特征指纹图谱能够有效评价玉米苞叶,可作为其质量的评价方法,为完善其质量标准提供了实验依据。

