化学发光法检测肺炎衣原体抗体的性能评估
周 湧,李慧敏,李夏萌
(东莞市第五人民医院检验科,广东东莞 454002)
肺炎衣原体(CP)是社区获得性肺炎(CAP)中非常重要的非典型病原体之一[1]。研究表明,CP可能诱发CAP患者的慢性咳嗽(CC)。CC是复发性和难治性呼吸系统疾病之一,导致CAP的延迟治愈。虽然,CAP通常不会产生严重的临床结局,但是如果迁延不愈也可以引起多种器官的并发症,影响患者的生理和心理健康[2]。另外,CAP通常也合并有其他的细菌感染[3]。因此,发明快速而准确的实验室检测方法对于CP感染的早期诊断和早期治疗非常关键。目前,对于CP的实验室检测方法包括病原体分离培养法、直接检测法、荧光定量核酸扩增法(FQ-PCR)以及血清检测法。血清检测法又包括化学发光法(CLIA)、酶联免疫吸附测定(ELISA)以及间接免疫荧光(IIF)等。ELISA实验步骤多,干扰环节多;IIF只能检测IgM,而目前对于CLIA在CP抗体检测中的作用却缺乏研究。本研究拟探讨化学发光法(CLIA)检测肺炎衣原体IgG和IgM抗体的性能,并且与ELISA和IIF相比较,以期为临床上采用这种方法早期诊断CP造成的CAP提供一定的理论依据。
1 资料与方法
1.1一般资料 选择2015年1月至2017年12月在本院呼吸内科接受治疗的200例CP患者作为观察组,男115例,女85例,年龄4~80岁,平均(31.2±4.5)岁。纳入标准:(1)成人CAP感染符合中华医学会呼吸病学分会制定的《中国成人社区获得性肺炎诊断和治疗指南(2016年版)》的相关诊断标准[4]。(2)儿童CAP感染符合中华医学会儿科学分会呼吸学组制定的《儿童社区获得性肺炎管理指南(2013修订)》中的相关诊断标准[5];(3)临床上出现不同程度的发热、咳嗽、咳痰症状,可伴有呼吸困难、恶性呕吐等症状。(4)结合患者的血常规、肺部X线片、痰培养、血培养等相关辅助检查结果,确定诊断为社区获得性肺炎。(5)儿童CAP感染患儿年龄在12岁以下;(6)急性期患者,病程<3 d。(7)病情严重程度均为轻中度。(8)无严重心、肺、肝、肾功能不全。(9)患者知情同意,自愿参加本项研究。排除标准:(1)合并其他病原体的肺部感染;(2)合并其他感染性疾病,如结核感染,或有结核病史等;(3)严重心、肺、肝、肾功能不全。(4)无法排除医院感染可能性的患者;(5)伴有免疫系统异常疾病的患者;(6)患者及家属不配合治疗,依从性差者。选择同期在本院体检中心接受体检的200例健康受试者作为对照组,男112例,女88例,年龄5~78岁,平均(30.50±5.3)岁。两组受试者的性别和年龄差异均无统计学意义。分离静脉血血清,于-20 ℃冰箱保存,第1次复溶后于2~8 ℃冰箱保存,24 h内完成试验。
1.2检测试剂 CPIgG和PCIgM抗体试剂(试剂批号分别为20171205和20171207,亚辉龙生物科技股份有限公司,中国); CPIgG和CPIgM抗体ELISA试剂盒(试剂批号分别为ZK-H2323和ZK-H2325,美国R&D公司); CP间接免疫荧光抗体(试剂批号RD455645,美国R&D公司)。
1.3检测设备 iFlash 3000化学发光免疫分析仪(型号:FA6C-00000A64,亚辉龙生物科技股份有限公司,中国),Biotek酶标仪(型号:CYT50-0000065,Molecular Devices,美国),Mikon E3600荧光显微镜。
1.4性能评估方法 参考美国临床和实验室标准化研究所(CLSI)[6]制订的《体外诊断试剂性能分析指导原则》,检测CPIgG和CPIgM的性能检验指标包括:最低检出限( LoD)、批内精密度、批间精密度、线性范围以及临床符合率。
1.4.1最低检出限 参考CLSI的EP17-A2文件[7]进行验证,以评价该方法的。选择低浓度梯度样本5份,重复测试20次,设定Ⅱ类错误水平β错5%,若数据呈正态分布,则采用参数方法估计LoD,若呈非正态分布,则采用非参数方法估计LoD。
1.4.2精密度 精密度为评价测量中随机误差程度的指标。表达方式采用变异系数(CV),CV越小,精密度越好。参考CLSI的EP5-A文件[8]进行验证。批内精密度选择CPIgG和IgM各高低2个浓度水平的样本,1 d内重复检测20次;批间精密度选择CP-IgG和-IgM各高低2个浓度水平的样本,每个水平每天重复检测4次,共检测5 d。
1.4.3线性评价 参考CLSI的EP6-A文件[6]进行验证,采用已知浓度为3.0、30.0、40.0、50.0、60.0、100.0、200.0 AU/mL的系列标准溶液,分别由测试产品测量。应用线性回归,使用已知浓度绘制数据X轴上的样本和Y轴上的测量平均值,两轴均以10为底的对数绘制坐标。测试产品的线性范围。
1.4.4临床符合率 参考CNAS-CL39文件[9]进行验证,选择确诊CP的阴性和阳性标本各200例,使用CLIA检测标本的CPIgG和CPIgM抗体。
1.5统计学处理 统计分析使用SPSS19.0软件进行。线性范围通过线性回归分析计算。不同方法学之间的一致性程度通过Kappa检验评估,以P<0.05表示差异有统计学意义。
2 结 果
2.1最低检出限 测试产品用于测量稀释的梯度L-系列标准品的浓度并产生标准剂量-反应曲线(图1)。同时,0 AU/mL标准溶液(空白参考)的样本在检测中独立检测20次。最低检测浓度的平均值为0.009 2 AU/mL,低于0.01 AU/mL。因此,CLIA的LoD为0.01 AU/mL。
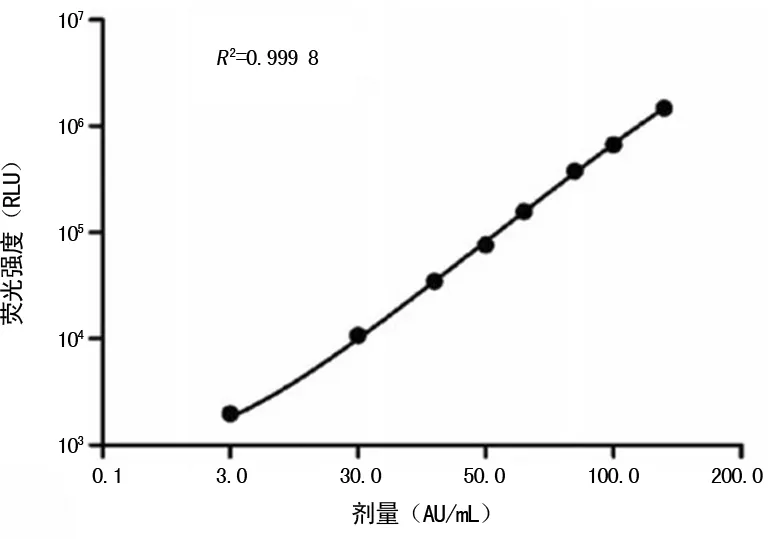
图1 CLIA法的标准剂量-反应曲线
2.2精密度 如表1、2所示,CLIA具有2.15%~6.47%的批内CV和3.17%~6.18%的批间CV,表明CLSI的结果具有良好的重复性。

表1 CLIA检测CP-IgG抗体的精密度

表2 CLIA检测CP-IgM抗体的精密度
2.3线性评价 当CPIgG抗体在3.0~200.0 AU/mL时,拟合曲线为Y=0.937 4X-5.327,R2=0.993 4,验证通过。见表3。

表3 CLIA法检测CPIgG抗体的线性 评价实验结果(AU/mL)
2.5方法学之间的一致性
2.5.1采用CLIA和ELISA分别检测200例样本的CPIgG和CPIgM抗体,通过Kappa检验评估,Kappa分别=0.900和0.903(均P<0.001)。一致百分比分别为85.0%和85.5%,见表4、5。

表4 CLIA与ELISA检测CP-IgG抗体的结果比较(n)

表5 CLIA与ELISA检测CP-IgM抗体的结果比较(n)
2.5.2采用CLIA与IIF以不区分抗体类型检测200例样本的CP抗体,通过Kappa检验评估,Kappa=0.905(P<0.001)。一致百分比为80.0%,见表6。

表6 CLIA与IIF检测CP抗体的结果比较(n)
3 讨 论
CP于1986年首次发现,到1989年,CP被确认为沙眼衣原体和鹦鹉热衣原体之后的第三种衣原体。 CP分布在世界各地,并通过气溶胶在人群中传播[10-11]。CP原发性感染3周后,即可检测到IgM抗体。在急性或既往感染患者的血清中可以检测到抗体。临床一般在第2周,第3周和第6周进行进一步的测试,以区分新感染与既往感染或慢性感染。因此,CP感染后抗体的形成慢于其他病原体[12]。CPIgG抗体水平通常在再感染后1~2周升高,但有时候没有再感染也会升高。CPIgM抗体水平在再感染时可能会稍微升高。
大约一半的CP感染患者无症状或仅有轻度咽痛。其他CP感染症状包括:持续性干咳、头痛和发热。CP慢性感染在成人中更常见。超过50%成人感染过CP,产生CP抗体。CP感染可诱导特异性T细胞免疫和B细胞免疫。抗体可能会暂时提供一定的免疫保护,但是其免疫力不够强,只能保持短暂时间,这在大多数情况下不能阻止再次感染反复发作。血清流行病学研究有表明CP感染3~5年后血清抗体会减少或消失[13]。CP特异度IgM和IgG抗体可以在健康者身上检测到,这表明存在健康的携带者。CP是一种常见的人类呼吸系统感染性疾病病原体。近年来,CP被发现与一些相关慢性疾病,包括支气管哮喘、冠心病疾病和动脉粥样硬化,以及一些比较罕见的疾病,如脑膜炎、心肌炎和格林巴利综合征有关。最近的临床研究也发现,CP抗体检测结果较高的患者更有可能存在多种全身性疾病,包括咽炎、喉炎、鼻炎、鼻窦炎、结节病、恶性淋巴瘤、多发性硬化症、老年痴呆症、肺癌、早产和胎膜早破[3-4,13]。CP已成为一种严重危害人类的病原体,因此引起越来越多的学者的关注。
《医学实验室质量和能力认可准则》中规定,对开展某一新的检测项目,更换检测系统或仪器或改变检测试剂盒生产商时,实验室需要对其相关方法学分析性能予以验证,对厂商提供的评价资料中的主要性能予以确认。因此,本研究根据由CLSI制订的《体外诊断试剂性能分析指导原则》,在检测CPIgG和CPIgM的性能检验指标选择最低检出限、批内精密度、批间精密度、线性范围以及临床符合率。CLSI检测CPIgG的最低检测限为0.01 AU/mL,临床应用可接受。CLSI检测CPIgG与CPIgM的批内、批间精密度较小,表明CLSI检测CP分型抗体的结果具有良好的重复性。CLIA检测CPIgG抗体在3.0~200.0 AU/mL线性范围内,拟合曲线符合R2≥0.990,0.85 根据一致性强度的判定标准:Kappa值为正数,而且Kappa值越大,一致性越好。Kappa≥0.75,表明一致性良好;0.40≤Kappa<0.75,表明一致性一般;Kappa<0.40,表明一致性较差[14]。本研究结果显示,CLIA和ELISA检测CPIgG和CPIgM抗体的Kappa分别为0.900和0.903。一致百分比分别为85.0%和85.5%,表明CLIA和ELISA检测CPIgG和CPIgM抗体的一致性较好。另外,CLIA与ELISA检测CPIgG及CPIgM抗体阳性率结果存在差异,其原因可能主要来源于不同季节、不同人群以及患者处在不同的感染阶段,均可导致阳性率的差异。此外,CLIA和IIF检测CP抗体的Kappa为0.905(P<0.001)。一致百分比为80.0%,表明CLIA和ELISA检测CP抗体也具有较好的一致性。 自发明以来,CLIA已广泛应用于临床诊断和环境分析[15]。在最初阶段,CLIA通常使用化学发光指示剂[16],如异鲁米诺,吖啶酯等,直接标记抗原(抗体)。尽管CLIA技术提高了免疫分析的灵敏度,化学发光的直接标记指标受到相对较短的发光持续时间的限制,所以它的应用需要机器来协助。因此,近年来发明了基于化学发光的酶-抗体缀合物底物和发光计用于测量抗体的水平,具有较高的灵敏度和更大的检测线性范围[17-23]。 CLIA检测CP抗体的各项指标符合生产厂家的声明和临床要求。CLIA法具有操作简便、灵敏度高、特异度强、精密度高、检测范围宽等优点,临床上可以替代ELISA和IIF用于CP抗体的检测。4 结 论

