Bmi-1小分子抑制剂PTC-209对肾癌细胞生物学行为的影响及机制
区景运,谭晓军,胡波,刘璠娜,尹良红
(1 开平市中心医院,广东开平529300;2 暨南大学附属第一医院)
肾细胞癌简称肾癌,是泌尿生殖系统中的高发恶性肿瘤。其治疗方案主要为手术切除,但术后复发及转移仍为临床一大难题。由于肾癌细胞膜表面具有药物泵蛋白,可加速肾癌细胞中药物的泵出[1,2];因此,相对于其他恶性肿瘤,肾癌对化疗和放疗敏感性弱,预后不良[3]。Notch信号通路参与细胞增殖、凋亡、迁移及侵袭等重要生物学行为,该通路异常活化可过度激活下游癌基因发状分裂相关增强子1(HES1)、髓细胞组织增生蛋白(MYC)及细胞周期蛋白依赖性激酶抑制因子2A(CDKN2A)、Cyclin D1及Bcl-2的表达,调节多种肿瘤细胞的发生发展。Long等[4]研究发现,自我更新基因Bmi-1是一种良好的肾癌预后指标,肾癌患者Bmi-1表达量显著高于健康人,并且患者Bmi-1表达水平越高,总体生存率越低。PTC-209是一种新型Bmi-1小分子抑制剂,多项研究发现其可在体内外抑制多种肿瘤细胞的增殖及生存[5~7]。至今,未见PTC-209对肾癌作用的报道。2018年3~8月,我们观察了PTC-209对肾癌细胞生物学行为的影响,并进一步探讨其可能的机制,为开发肾癌治疗新药物及新靶点奠定一定基础。
1 材料与方法
1.1 材料 肾癌细胞株786-O购于ATCC公司,PTC-209购于Selleckchem公司,DMEM培养基、胎牛血清(FBS)、PBS、胰酶均购于Gibco公司;CCK-8检测试剂盒购于Dojindo公司;qRT-PCR引物由上海英潍捷基公司设计并提供,逆转录及SYBR试剂盒购于Takara公司;Annexin-V/PI双染凋亡试剂盒购于凯基生物有限公司;PI周期试剂盒购于BD公司;细胞克隆结晶紫染色液购于广州威佳公司;抗体购于CST公司。细胞培养箱及生物安全柜购于Thermo公司;倒置显微镜购于Leica公司。
1.2 实验方法
1.2.1 细胞培养 786-O细胞以完全培养基(含10% FBS的DMEM)于细胞培养箱中培养,细胞增殖至培养瓶80%左右时,消化并传代培养。
1.2.2 细胞存活率测算 采用CCK-8法。取对数生长期状态良好的786-O细胞以6×103/孔接种于96孔板中,放置于细胞培养箱中贴壁过夜。将培养基更换为含PTC-209药物的培养液,浓度分别为0、1、2.5、5、10 μmol/L,设立空白及对照孔,每浓度设5个复孔。药物作用24、48 h后加CCK-8 10 μL/孔,于培养箱中继续培养4 h,检测450 nm处的吸光度值并计算细胞存活率。细胞存活率=(实验孔-空白孔)吸光度值/(对照孔-空白孔)吸光度值×100%。
1.2.3 细胞周期分布情况观察 采用流式细胞仪。将786-O细胞以1×106/孔接种于6孔板中,贴壁24 h后将培养基更换为PTC-209药物浓度为0、1、2.5、5、10 μmol/L的培养基,继续培养24 h;收集细胞并用PBS清洗3次,加入75%乙醇固定,4 ℃存放24 h。PBS洗涤3次后加入500 μL PI重悬细胞,4 ℃避光孵育0.5 h,上流式细胞仪检测细胞周期分布情况。
1.2.4 细胞凋亡情况观察 采用流式细胞仪。将786-O细胞以1×106/孔接种于6孔板中,贴壁24 h后将培养基更换为PTC-209药物浓度为0、1、2.5、5、10 μmol/L的培养基,继续培养24 h;收集细胞并用PBS清洗3次,加入100 μL Binding Buffer重悬细胞;加入APC和PI各5 μL,常温下避光孵育0.5 h,上流式细胞仪检测凋亡细胞并计算细胞凋亡率。
1.2.5 细胞克隆形成情况观察 采用克隆形成实验。取对数生长期的786-O细胞,以2×102/孔接种于6孔板中;细胞贴壁后,将培养基更换为PTC-209药物浓度为0、1、5、10 μmol/L的新鲜培养基,于培养箱中培养2周;用PBS冲洗干净,4%多聚甲醛固定1 h后充分清洗,用结晶紫染色1 h;充分洗掉染色液,倒置显微镜下拍照并计数克隆形成个数。
1.2.6 细胞迁移能力观察 采用细胞划痕实验。用胰酶消化对数生长期的786-O细胞,调整细胞密度并以1×106/孔接种6孔板,置于细胞培养箱中继续培养;待细胞融合度度达90%~100%时,用200 μL的无菌枪头迅速在细胞中划痕,同时将细胞培养基更换为PTC-209药物浓度为0、1、5、10 μmol/L的培养基。分别于加药0 h和48 h后于倒置显微镜下拍照,Image J软件计算各个图像的无细胞区域面积(S)。细胞迁移率=(S0 h-S48 h)/S0 h×100%。
1.2.7 细胞中Notch1、HES1、MYC、CDKN2A、Cyclin D1和Bcl-2蛋白检测 采用Western blotting法。收集0、5 μmol/L PTC-209药物处理24 h后的细胞,充分冲洗3遍后加入适量细胞裂解液,冰上充分裂解30 min,提取全细胞蛋白并用Bradford法测定蛋白浓度。根据蛋白分子量配置合适浓度的SDS-PAGE胶,每个电泳通道加入25 μg蛋白,100 V恒压电泳约1.5 h;250 mA恒流湿转法转膜,将PVDF膜置于5%脱脂牛奶溶液中封闭2.5 h;分别将PVDF膜孵育相应一抗溶液,4 ℃冰箱孵育过夜;用含有0.1% Tween-20的TBS-T洗涤一抗3次,10 min/次;室温下孵育二抗2 h;TBS-T漂洗二抗4次,6 min/次;PVDF膜沥干后加入超敏ECL发光液,于Tannon成像系统中显影;用Image J软件计算蛋白灰度值,以目的蛋白与内参GAPDH灰度比值表示其相对表达量。
1.2.8 细胞中Notch1、HES1、MYC、CDKN2A、Cyclin D1和Bcl-2基因检测 采用实时荧光定量PCR法。收集0、5 μmol/L PTC-209药物处理24 h后的细胞,TRIzol裂解并提取细胞总RNA,将RNA逆转录成cDNA并于-80 ℃储存备用。引物序列:Notch1上游5′-GGTTCCGAAGAAGATGCTCCAG-3′,下游5′-GCGTTGCACAGCTCAATGTG-3′;HES1上游5′-AGGCGGCTAAGGTGTTTGG-3′,下游5′-CGTTGGGAATGAGGAAAGCAA-3′;MYC上游5′-CACATGCCCAAGATTCACTGATAG-3′,下游5′-GAGGTGGCTTGGACAGGTTAG-3′;CDKN2A上游5′-GCCCTAAGCGCACATTCATG -3′,下游5′-GCTAGCAGTGTGACTCAAGAGAAG-3′;Cyclin D1:上游5′-CTGGGTCTGTGCATTTCTGGTT-3′,下游5′-CTGCTGGAAACATGCCGGTTA-3′;Bcl-2上游5′-GAGCACAGAAGATGGGAACACT -3′,下游5′-AGGTGCATGGATTTACTCAGTATC-3′;GAPDH上游5′-CCTGCACCACCAACTGCTTAG-3′,下游5′-TGAGTCCTTCCACGATAC-CAA -3′。20 μL qRT-PCR扩增体系包含SYBRGreen混合物10 μL,DEPC水6.4 μL,cDNA 2 μL和上下游引物(10 μmol/L)各0.8 μL,按照TaKaRa说明书推荐程序进行上机反应。内参基因选用GAPDH,利用2-ΔΔCt法分析结果。

2 结果
2.1 PTC-209对786-O细胞存活的影响 结果见表1。

表1 PTC-209对786-O细胞存活的影响
注:与同时点0 μmol/L PTC-209比较,*P<0.05;与同浓度PTC-209作用24 h比较,#P<0.05。
2.2 PTC-209对786-O细胞凋亡及细胞周期的影响 结果见表2。

表2 不同浓度PTC-209药物对786-O细胞凋亡及周期的影响
注:与0 μmol/L PTC-209比较,*P<0.05。
2.3 PTC-209对786-O细胞迁移能力的影响 1、5、10 μmol/L PTC-209作用后细胞迁移率分别为52%±11%、36%±7%、25%±3%,均低于0 μmol/L时的65%±4%(P均<0.05)。
2.4 PTC-209对786-O细胞克隆形成能力的影响 1、5、10 μmol/L PTC-209作用后细胞克隆形成数分别为(50.67±6.34)、(26.33±4.99)、(6.67±2.05)个,均少于0 μmol/L时的(77.33±8.73)个(P均<0.05)。
2.5 细胞中Notch1、HES1、MYC、CDKN2A、Cyclin D1和Bcl-2表达比较 结果见表3。
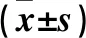
表3 细胞中Notch1、HES1、MYC、CDKN2A、Cyclin D1和Bcl-2表达比较
注:与0 μmol/L PTC-209比较,*P<0.05。
3 讨论
肾癌是第七常见恶性肿瘤,病死率高。肾癌占成人恶性疾病的2%~3%,全球发病率逐年上升,每年新增患者20.9万例,死亡10.2万例。此外,肾癌患者5年生存率与疾病分期密切相关,TNM Ⅰ~Ⅳ期患者5年生存率从81%可降至8%;约30%的初诊患者出现癌细胞转移,其5年生存率下降约10%。病情复发是目前肾癌治疗所面临的一大难题,高达40%的患者在首次手术后5年内出现肿瘤复发[8]。
Bmi-1是一种位于10号染色体的癌基因,即B细胞特异的莫洛尼鼠白血病病毒插入位点1基因,属于多梳基因家族(PcG)成员之一。PcG家族是由多种与细胞周期和增殖相关的转录因子组成,是一类重要的与发育相关的基因,在干细胞的维持、胚胎发育和肿瘤发生中有着不可忽视的作用[9]。研究发现,Bmi-1基因在肾癌等多种癌组织中的表达高低与肿瘤形成、疾病进展、侵袭与转移、疾病不良预后密切相关[10]。文献报道,Bmi-1与Notch在肿瘤组织中高表达并具有相关性,对乳腺癌患者病情的发生、发展具有促进作用[11]。Notch信号通路可参与调节细胞增殖、分化及凋亡,对机体正常发育至关重要,是许多重要信号通路的主要组成部分和关键调控点。Notch受体激活后经过ADAM金属蛋白酶和γ分泌酶介导的一系列酶促分裂反应,促使Notch1移位至细胞核,进而与细胞核内转录因子形成复合物,激活下游靶基因HES1、CDKN2A、MYC、Cyclin D1、Bcl-2的转录活性;HES1、CDKN2A和MYC影响细胞的增殖及迁移,Cyclin D1及Bcl-2分别调控着细胞周期和凋亡,从而影响细胞增殖能力[12~15]。Kreso等[16]研究发现,Bmi-1小分子抑制剂PTC-209可抑制Bmi-1活性,通过PRC1下调CDKN2A转录活性,抑制下游靶基因p16INK4A和p14ARF激活,阻滞肿瘤细胞周期进展并促进凋亡蛋白Bcl-2的翻译,杀伤血液肿瘤细胞。Ohtaka等[17]报道,PTC-209通过抑制白血病细胞中Bmi-1蛋白活性从而促使Notch1失活,减少Notch1移位至细胞核中发挥促进下游靶基因的转录活性,HES及MYC蛋白翻译作用减弱,Cyclin D1蛋白表达量下降,Caspase-3活性增加,导致白血病细胞发生凋亡及细胞周期阻滞。
本研究结果显示,随着PTC-209作用浓度升高及作用时间的延长,786-O细胞存活率减少;随着PTC-209作用浓度升高,786-O细胞凋亡率、G0/G1期细胞比例增加,S期及G2/M期细胞比例、细胞迁移率及克隆形成数减少;与0 μmol/L比较,5 μmol/L的PTC-209作用后细胞中Notch1、HES1、MYC、CDKN2A、Cyclin D1、Bcl-2基因及蛋白表达均减少。这提示Bmi-1小分子抑制剂PTC-209可抑制肾癌786-O细胞增殖、迁移及克隆形成能力,促进肿瘤细胞凋亡并阻滞细胞周期进展,该作用与其抑制Bmi-1蛋白活性并影响Notch1蛋白作用于下游靶分子HES、Cyclin D1、MYC、CDKN2A及Bcl-2有关。因此,Bmi-1可作为肾癌治疗的靶点,而PTC-209有望成为肾癌治疗的有效药物。

