肥胖患者脂肪组织STAU1表达变化及其在脂肪间充质干细胞成脂分化中的作用
孟轩羽,梁小弟,努尔比耶·努尔麦麦提,焦谊,刘杰,胡婷婷,高佳乐,徐尤宗盛,张玲,关亚群
(新疆医科大学基础医学院,乌鲁木齐830011)
肥胖是引起2型糖尿病、高血压、非酒精性脂肪肝等代谢性疾病的重要原因之一[1~4],脂肪细胞的异常分化和过度增殖是导致肥胖的细胞生物学基础。脂肪细胞分化涉及一个复杂的调控网络,包括表观遗传学、转录水平、转录后水平、翻译及翻译后水平[5];在转录水平中,过氧化物酶体增殖剂激活受体(PPARγ)不仅是调控脂肪组织中前体脂肪细胞分化的关键因子,而且在调节脂类代谢中扮演重要的角色[6]。在转录后水平中,RNA结合蛋白起着重要的调节作用[7]。Cho等[8]发现,双链RNA结合蛋白STAU1在小鼠脂肪细胞3T3-L1的分化过程中高表达。前期我们通过生物信息学方法预测发现,STAU1可以与PPARγ结合。2018年7~9月,我们在人脂肪组织及人脂肪间充质干细胞(hADSCs)成脂分化中检测STAU1的表达水平,并于hADSCs中敲低STAU1表达后检测细胞成脂情况及PPARγ表达水平变化,初步探讨STAU1在人脂肪组织及hADSCs成脂分化中的可能作用。
1 材料与方法
1.1 主要试剂与仪器 低糖培养基(DMEM)、胎牛血清(FBS)购自Hyclone;无血清培养基(Opti-MEM)购自Gibco-BRL;LipofectamineTM3000转染试剂、TRIzol RNA提取试剂购自Invitrogen;SYBR Green Real time PCR试剂盒购自Takala;RevertAid First Strand cDNA Synthesis Kit逆转录试剂盒购自Thermo Scientific;Anti-actin、Anti-STAU1、Anti-PPARγ抗体购自Abcam;STAU1 siRNA购自广州瑞博。荧光定量PCR仪(ABI 7500)核酸微量检测仪购自NanoDrop;低温高速离心机购自Thermo,荧光倒置显微镜购自Leica;全波长酶标仪、凝胶成像仪购自Bio-Rad;电热恒温培养箱购自Thermo。
1.2 实验方法
1.2.1 人脂肪组织的获取与临床资料收集 选取2016年9月~2018年5月新疆维吾尔自治区人民医院慢性胆囊结石和腹股沟疝择期手术患者56例,均无动脉或外周血管疾病、甲状腺功能紊乱、急性炎症性疾病、创伤和其他需要紧急治疗的病症、恶性肿瘤、酒精或药物滥用史者,术中留取网膜和皮下脂肪组织。将患者根据BMI分为肥胖组(BMI≥28 kg/m2)27例和非肥胖组(BMI<24 kg/m2)29例,两组年龄、BMI、腰围、臀围、血压、血糖、血脂比较,见表1。本研究均经医院伦理委员会批准,患者均签署知情同意书。
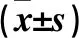
表1 两组年龄、BMI、腰围、臀围、血压、血糖、血脂比较
注:与非肥胖组比较,*P<0.05。
1.2.2 hADSCs的获取 取人网膜脂肪组织约2 g,用含1 000 U/mL青霉素和链霉素的PBS清洗3遍;用眼科剪将脂肪组织剪至1 mm3大小,在37 ℃水浴中与1 mg/mL的Ⅰ型胶原酶一起温育60 min,轻微摇晃直至看不到组织块为止。加入20 mL PBS终止消化,将组织液以600 r/min离心10 min。弃去上清液后,将沉淀重悬于含有10% FBS和1 000 U/mL青霉素和链霉素的低糖DMEM中。将细胞悬浮液接种在10 cm细胞培养皿上,在37 ℃培养箱中用5% CO2培养;48 h换1次液,直至细胞融合率为80%,用胰酶消化传代。传代后收集细胞悬液,分为阴性对照及同型对照,分别加单克隆抗体CD44-FITC、CD105-PE在4 ℃冰箱避光孵育30 min;用PBS清洗5遍,洗掉多余的抗体后上流式细胞仪检测细胞表面抗原。结果显示,间充质干细胞标记抗原CD44、CD105呈阳性表达,表明分离的细胞为hADSCs。
1.2.3 hADSCs成脂分化诱导与甘油三酯形成情况观察 当细胞融合率达85%时,将含10%FBS、1 μmol/L地塞米松、10 μmol/L胰岛素、0.5 mmol/L 3-异丁基-1-甲基黄嘌呤和200 μmol/L吲哚美辛的成脂诱导液处理hADSCs;每3 d更换培养基1次,持续8 d。分别于0、2、4、6、8 d,取上述细胞样品;PBS清洗后以4%多聚甲醛固定30 min,用油红O染料染色25 min。PBS清洗3遍后,加入ddH2O放在倒置显微镜下观察细胞成脂情况;最后用异丙醇洗脱培养皿提取油红O染料,在波长520 nm下测量光密度,以此表示甘油三酯生成量。
1.2.4 脂肪组织STAU1基因和hADSCs成脂分化中STAU1、PPARγ基因表达检测 采用RT-qPCR法。PBS洗涤3.5 cm培养皿3次后(脂肪组织用研钵碾成粉末),加入TRIzol 1 mL吹打匀浆细胞和组织;采用异丙醇氯仿方法提取细胞及组织内RNA,通过分光光度法测量RNA浓度及A260/A280,确保RNA的质量。使用Revert Aid First Strand cDNA Synthesis试剂盒将RNA逆转录为cDNA后,在ABI 7500系统下使用SYBR Select Master Mix试剂进行PCR扩增。STAU1基因上游引物5′-TGCTGGGGTTTGTTGTGATG-3′、下游引物5′-TGAGTGAGCCAGCTTGAGAA-3′,PPARγ基因上游引物5′-AAATGCGAGAGTGGGAAGGA-3′、下游引物5′-AGGGTCTTGCTATGTTGCCT-3′,由上海生工生物有限公司设计并合成。以HSP90为内参,用2-ΔΔCt法计算STAU1基因相对表达量。
1.2.5 脂肪组织STAU1蛋白和hADSCs成脂分化中STAU1、PPARγ蛋白表达检测 采用Western blotting法。将hADSCs细胞用PBS清洗3遍后(网膜脂肪组织研磨成粉末),在RIPA中裂解后用BCA工作液对蛋白进行定量;在10%的SDS-PAGE胶上样电泳后转移至PVDF膜,在5% BSA中室温孵育2 h;将膜和一抗Anti-STAU1、Anti-HSP90、Anti-PPARγ(1∶1 000)置于5 mL一抗稀释缓冲液中,4 ℃摇床上孵育过夜。用15 mL TBST洗涤3次,每次15 min;将二抗(1∶5 000)HRP-Anti-rabbit室温孵育1 h,再用15 mL TBST洗涤3次,每次15 min。ECL底物进行显色,以Image Lab软件进行光密度分析。以HSP90为内参,用目的蛋白与内参吸光度比值表示目的蛋白相对表达量。
1.2.6 敲低STAU1对hADSCs中甘油三酯生成及PPARγ表达影响的观察 将4×105个细胞接种于3.5 cm皿中,待融合率为60%时,加入基础培养基2 mL饥饿8 h后;将细胞分为3组,干扰1、2组分别转染siRNA STAU1-homo-718、STAU1-homo-923,对照组不转染。加无血清培养基Opti-MEM 250 μL稀释10 μL LipofectamineTM3000,室温孵育5 min;加入5 μL siRNA用250 μL Opti-MEM进行稀释,将脂质体LipofectamineTM3000与siRNA混合液室温孵育30 min;加入培养皿中在37 ℃、5% CO2的培养箱中孵育1 h后换成DMEM低糖完全培养基,每2 d换液1次。转染后2、4 d,分别检测甘油三酯生成情况、STAU1和PPARγ基因及蛋白质表达水平,方法分别同1.2.3、1.2.4、1.2.5。siRNA由广州博瑞设计并合成,引物序列见表2。

表2 STAU1 siRNA引物序列

2 结果
2.1 肥胖组与非肥胖组脂肪组织中STAU1基因及蛋白表达情况 肥胖组网膜脂肪组织中STAU1基因相对表达量高于非肥胖组(P<0.05),两组皮下脂肪组织中STAU1基因相对表达量差异无统计学意义,见表3。肥胖组网膜脂肪组织中STAU1蛋白相对表达量为2.68±0.28,高于非肥胖组的1.32±0.36(P<0.05)。
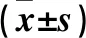
表3 肥胖组与非肥胖组脂肪组织中STAU1基因表达比较
注:与非肥胖组同型脂肪组织比较,*P<0.05。
2.2 肥胖组网膜脂肪组织中STAU1基因表达水平与患者临床特征的关系 相关性分析显示,肥胖组网膜脂肪组织中STAU1基因表达水平与患者的腰围、臀围、低密度脂蛋白、高密度脂蛋白、空腹血糖无明显相关性(r分别为0.169、0.176、0.173、0.164、0.171,P均>0.05),与BMI、甘油三酯呈正相关(r分别为0.777、0.795,P均<0.01)。
2.3 hADSCs成脂分化过程中甘油三酯生成及STAU1、PPARγ表达水平变化 随着诱导分化天数增加,hADSCs中甘油三酯生成增多,STAU1、PPARγ表达水平逐渐升高(P均<0.05)。见表4。
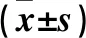
表4 hADSCs成脂分化过程中甘油三酯生成及STAU1、PPARγ表达水平变化
注:与成脂分化诱导0 d时比较,*P<0.05。
2.4 敲低STAU1对hADSCs中甘油三酯生成及PPARγ表达的影响 与对照组比较,干扰1、2组转染2、4 d时hADSCs中STAU1表达降低,甘油三酯生成及PPARγ表达减少(P均<0.05)。见表5。
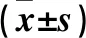
表5 各组hADSCs中甘油三酯生成及STAU1、PPARγ表达比较
注:与对照组同时点比较,*P<0.05。
3 讨论
随着社会发展及生活方式的改变,肥胖得到人们越来越多的关注,其发病率在全球范围内迅速上升[9~12]。研究发现,脂肪细胞的异常分化是导致肥胖的重要原因之一。因此,研究脂肪细胞的分化及其机制对预防和治疗肥胖及相关疾病具有重要意义。脂肪细胞分化可以分为两个阶段:第一个阶段为多潜能的干细胞转变为前体脂肪细胞;第二个阶段为前体脂肪细胞终末分化为成熟的脂肪细胞[13]。脂肪细胞分化存在复杂的调控网络,如PPARγ和CEBPα转录因子介导的转录水平的调节[14]。PPARγ通过调控下游与脂代谢相关基因的表达,促进脂肪细胞的分化、增加脂肪细胞的数量,对脂肪的生成、转运及脂肪的贮存和氧化等都起着重要作用,是脂肪细胞形成和代谢的关键调节因子[15]。另外,转录后水平也在脂肪细胞分化过程中发挥着重要作用,其中RNA结合蛋白可以参与RNA前体的剪接、RNA的细胞定位、RNA稳定性等多种转录后调控[16]。STAU1是重要的RNA结合蛋白,又称STAU1人源全长重组蛋白。Cho等[17]报道,在前体脂肪细胞3T3-L1分化中,RNA结合蛋白STAU1可以通过与Kruppel样因子2(KLF2)基因上的局部双连结合,影响KLF2基因稳定性,使KLF2下游靶基因PPARγ表达水平升高,进而促进3T3-L1细胞内甘油三脂的生成。
本实验在hADSCs成脂分化过程中,STAU1、PPARγ表达水平随着诱导分化天数增加而增加,油红O染色结果显示成脂加快。生物信息学方法预测显示STAU1可以与PPARγ结合,而PPARγ是脂肪细胞分化重要的转录因子。本研究结果显示,在脂肪细胞中敲低STAU1后PPARγ的蛋白及基因水平降低,推测STAU1可能通过上调PPARγ的表达水平进而加速甘油三酯的生成,此外,在人脂肪组织中发现STAU1基因和蛋白水平在肥胖患者网膜脂肪组织中表达升高,差异有统计学意义,而在皮下脂肪组织中无统计学意义。Serralde-Zúniga等[18]研究发现,脂肪组织在脂代谢和病理生理方面有明显的部位特异性,网膜脂肪的积聚较皮下脂肪对人体危害更加明显。因此,STAU1在网膜脂肪组织高表达可能与内脏肥胖导致的代谢性疾病相关。相关性分析发现,网膜脂肪组织中STAU1基因表达与肥胖组BMI和甘油三酯呈正相关。甘油三酯是组成脂质的主要成分,脂肪酸作为合成甘油三酯的直接底物,脂肪酸合成增多直接加速了甘油三酯的合成;PPARγ可以通过调节脂肪酸合成酶的速率,加速脂肪酸合成的进程,进而增加了甘油三酯的合成[19,20]。这提示STAU1在脂肪组织及脂肪细胞中可能通过上调PPARγ的表达,促进甘油三酯的生成,从而导致肥胖的发生。
综上所述,双链RNA结合蛋白STAU1,在人网膜脂肪组织及hADSCs成脂分化过程中高表达,STAU1可通过调节PPARγ表达水平来影响人体脂肪的形成,从而在肥胖的发生发展中起重要作用,但具体调控机制还有待进一步研究。

