父代饮酒致子代小鼠心脏发育异常的组蛋白乙酰化修饰机制*
路 倩, 赵唯安, 刘玲娟, 潘 博, 田 杰
(重庆医科大学附属儿童医院心血管内科, 儿童发育疾病研究教育部重点实验室, 儿童发育重大疾病国家国际科技合作基地, 儿科学重庆市重点实验室, 重庆 401122)
先天性心脏病(congenital heart disease,CHD)是胚胎时期心脏及血管发育异常导致形态结构功能与循环代谢的异常。全球范围内,每年约有135万~150万的先天性心脏病患儿出生,其中约有15%左右是由明确的遗传原因造成的[1],而绝大多数是由环境和遗传因素共同作用引起的,但环境因素是以何种机制与遗传因素共同参与了先天性心脏病的发生发展尚不清楚。
表观遗传(epigenetic inheritance)是遗传与环境因素间的桥梁,其介导了心脏的发生与构建。既往环境因素对胚胎发育影响的研究多集中于母代孕期不良环境因素暴露,如饮酒、药物和感染等。然而近年研究表明,父代不良环境因素暴露,尤其是父代在备孕期多种环境因素也对子代胚胎发育产生重要影响[2]。流行病学及模式动物研究显示,父代饮酒可显著增加子代先天性心脏病等多种先天性畸形发生率[3-4]。然而父代饮酒对子代心脏发育影响的机制尚不完全清楚。本文通过构建父代饮酒致子代心脏发育异常的动物模型,检测子代小鼠心肌细胞凋亡水平显著升高,进一步探讨组蛋白乙酰化修饰在该病理发生中的可能机制,为父代在备孕期间避免酒精暴露提供参考资料。
材 料 和 方 法
1 实验动物及模型构建
雄性SPF级C57小鼠,6~8周龄,18~20 g;雌性SPF级C57小鼠,8~10周龄,由重庆医科大学动物中心提供,合格证号为SYXK(渝)2007-0016。雄性小鼠随机分为3组,参考相关文献[5]分别给予40%酒精(alcohol)组和生理盐水(negative)组每日灌胃,连续6周,另一组不予任何处理即空白对照组(blank group)。处理后进行雌雄合笼,雌鼠受孕后即分笼饲养。采用二氧化碳窒息处死新生小鼠,快速分离心脏组织。
2 主要试剂
抗caspase-3 抗体购自CST;抗active caspase-3抗体购自Arigo;抗Bcl-2抗体购自Santa Cruz; ChIP级抗乙酰化组蛋白H3K9抗体和抗乙酰化组蛋白H3K27抗体购自Abcam;抗β-actin鼠单克隆抗体、山羊抗兔及山羊抗小鼠带HRP标记的IgG抗体购自北京义翘神州生物技术有限公司;TUNEL试剂盒和全蛋白提取试剂盒购自江苏凯基生物技术股份有限公司;BCA蛋白测定试剂盒购自Pierce;总RNA提取试剂盒购自北京百泰克生物技术有限公司;逆转录试剂盒购自TaKaRa;2×SYBR Green Mix试剂购自天根生化技术有限公司;ChIP试剂盒购自Abcam。
3 主要方法
3.1 TUNEL检测心肌细胞凋亡 收集新生小鼠心脏组织每组3~5个,4%多聚甲醛处理24 h,30%蔗糖脱水处理48 h后,用OCT包埋,梯度降温(-20 ℃,30 min)后-80 ℃保存。用冰冻切片机切成8 μm厚度薄片,制成组织切片,4 ℃保存。按照TUNEL试剂盒说明书步骤染色组织切片,荧光显微镜观察,细胞核被DAPI标记为蓝色荧光,TUNEL阳性细胞被标记为绿色荧光。
3.2 透射电镜观察心肌超微结构 收集新鲜新生小鼠左心室心肌组织每组各3~5个,快速分离约1 cm×1 cm×1 cm大小组织碎块,立刻放置于2.5%戊二醛固定液中保存,透射电镜观察心肌超微结构由重庆医科大学生命科学院电镜中心完成。
3.3 qPCR实验 收集新生小鼠心脏组织每组6~8个后按照总RNA提取试剂盒说明书步骤提取组织RNA,按逆转录试剂盒说明书步骤得到cDNA进而以之为模版进行qPCR检测。由上海生工生物工程有限公司设计并合成caspase-3、Bcl-2和内参照β-actin引物序列,详见表1。采用qPCR反应10 μL体系,并设置3复孔,在QuantStudio®3 Real-Time PCR Instrument中进行基因扩增。条件为:95 ℃ 2 min;变性95 ℃ 10 s,退火68 ℃ 15 s,延伸60 ℃ 1 min,40次循环。熔解曲线程序:95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s。结果分析以β-actin为内参照,通过2-ΔΔCt法计算caspase-3和Bcl-2的相对表达水平。
3.4 总蛋白提取及Western blot实验 获得新生小鼠心脏标本每组5~6个后,按照凯基总蛋白提取试剂盒说明书步骤提取心肌组织全蛋白,通过BCA蛋白浓度测定后调整上样量为每孔45 μg,在10%的SDS-PAGE进行分离(80 V 30 min,100 V 1 h),通过电转(105 V,2 h)至0.22 μm的PVDF膜(经甲醇激活15 s),用5%脱脂奶粉封闭1 h,用5%BSA液稀释(按说明书工作浓度)的Ⅰ抗工作液4 ℃孵育过夜,洗膜后室温下孵育Ⅱ抗(110 000稀释)2 h后洗膜,用ECL发光试剂盒显影检测蛋白。
3.5 ChIP-qPCR实验 收集新生小鼠心肌组织每组3~5个,按照ChIP试剂盒说明书步骤进行操作,简要来说,首先利用甲醛进行DNA-蛋白交联实验;第2进行超声DNA切割,切割DNA片段以200~500 bp为宜;第3经利用前述ChIP级抗体进行逆交联,最后纯化获取与目的抗体结合的DNA。将DNA进行qPCR实验,操作同前描述。Caspase-3及Bcl-2基因启动子区域引物序列见表1。
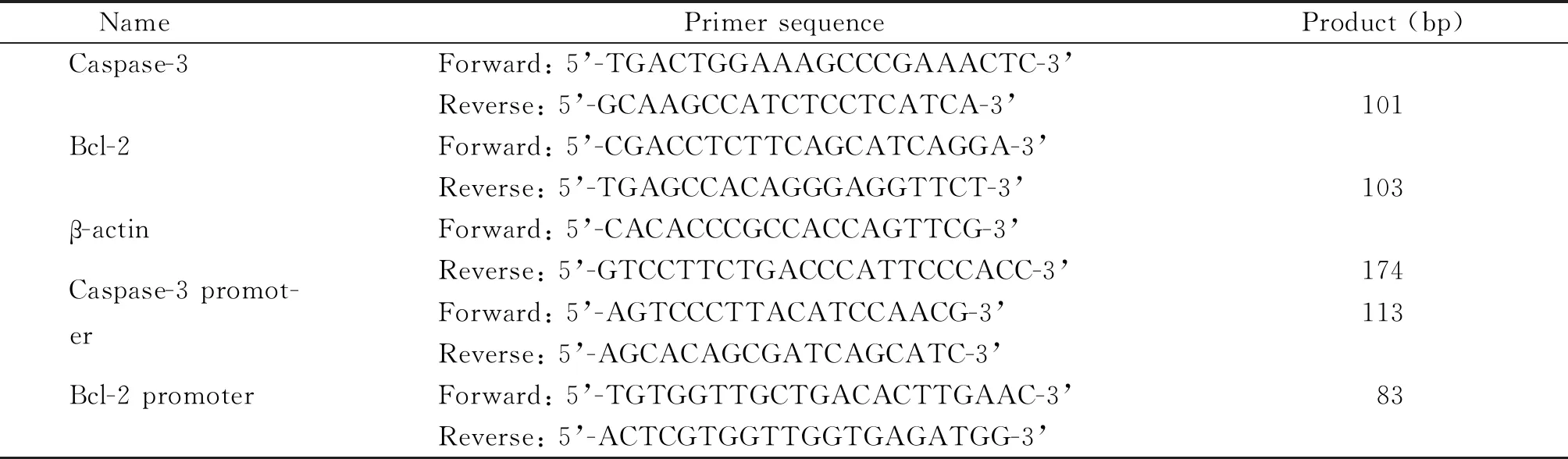
表1 引物序列
4 统计学处理
采用SPSS 23.0 统计软件包进行统计学分析。所有数据用均数±标准差(mean±SD)表示,多组间比较应用单因素方差分析(one-way ANOVA),各组间均数的两两比较应用SNK-q检验。以P<0.05 为差异有统计学意义。
结 果
1 新生小鼠出生体重检测
子代新生小鼠生后进行体重检测。Alcohol组小鼠出生体重较对照组显著降低(P<0.05),见表2。

表2 新生小鼠出生体重
*P<0.05vsother groups.
2 小鼠心肌超微结构
与对照组心肌超微结构对比,酒精暴露组子代新生小鼠心肌肌原纤维含量明显减少,肌丝部分断裂扭曲、排列紊乱,局部肌丝溶解,肌节结构不完整、长短不一,且明暗带不明显,肌浆网扩张,线粒体肿胀,其内有糖原沉积,见图1。

Figure 1. Cardiac ultrastructure evaluation (×10 000). A, B and C: alcohol exposure group; D: control group. Red arrows indicate disorder of sarcomere arrangement (A), enlargements of sarcoplasmic reticulum (B) and sarcomere dissolution (C). The scale bar=2 μm.
图1 心肌超微结构
3 小鼠心肌细胞凋亡水平检测
TUNEL染色结果显示,与对照组相比,酒精组子代小鼠心脏组织中凋亡的心肌细胞数量明显增多,见图2。

Figure 2. Myocardial apoptosis in various groups. Blue for DAPI and green for TUNEL positive cells. The scale bar=100 μm.
图2 心肌细胞凋亡检测
4 Caspase-3及Bcl-2 mRNA水平检测
与对照组相比,酒精暴露组小鼠心肌组织中caspase-3 mRNA水平显著升高(P<0.05),而Bcl-2的mRNA水平较对照组显著降低(P<0.05),见图3。
5 Active caspase-3和Bcl-2蛋白水平检测
Western blot结果显示与对照组和空白组相比,酒精暴露组Bcl-2蛋白表达显著降低,而active caspase-3蛋白在酒精暴露组表达水平较对照组显著升高(P<0.05),见图4。
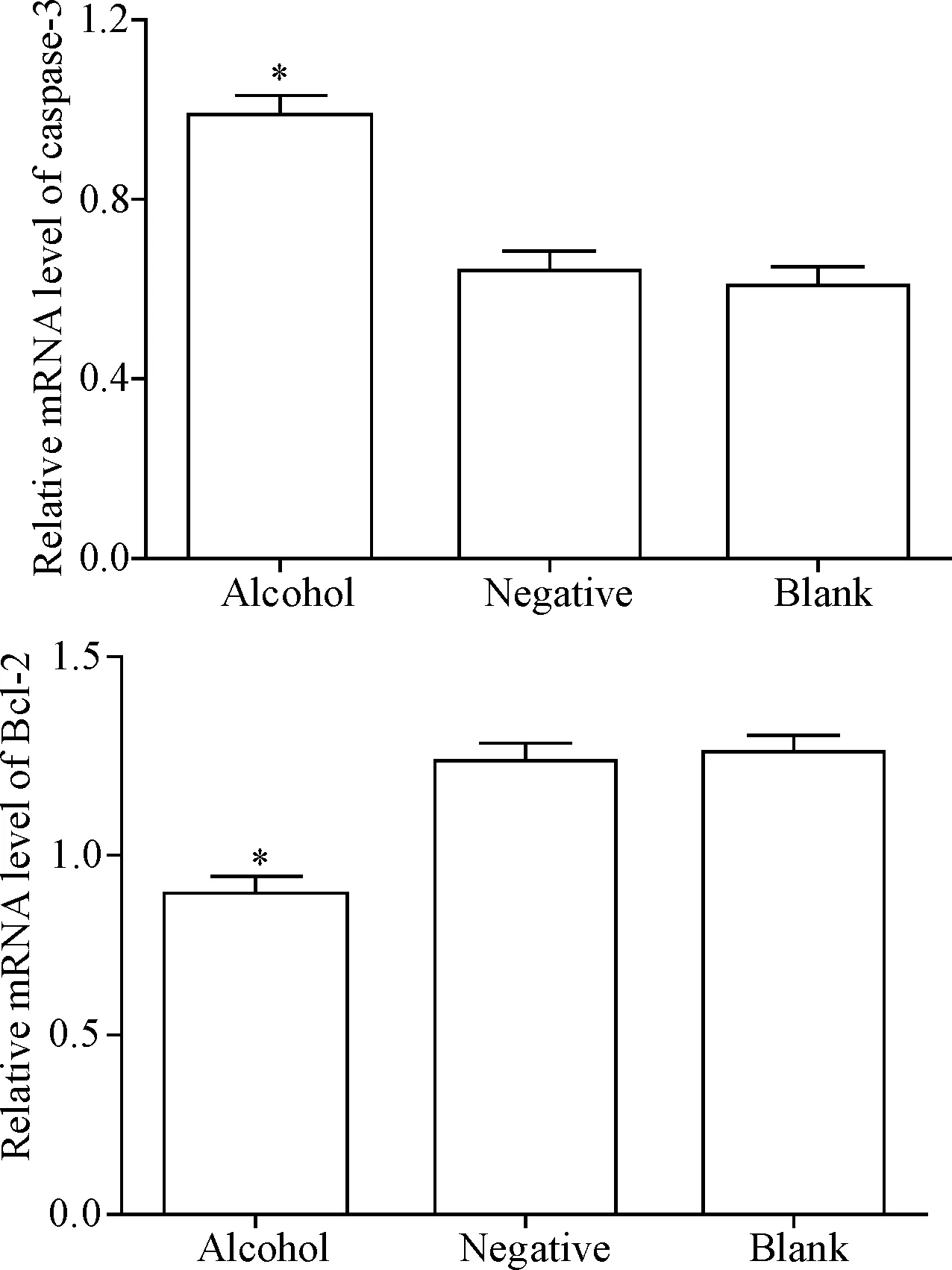
Figure 3. Relative mRNA levels of caspase-3 and Bcl-2. Mean±SD.n=5.*P<0.05vsother groups.
图3 Caspase-3及Bcl-2的mRNA表达水平
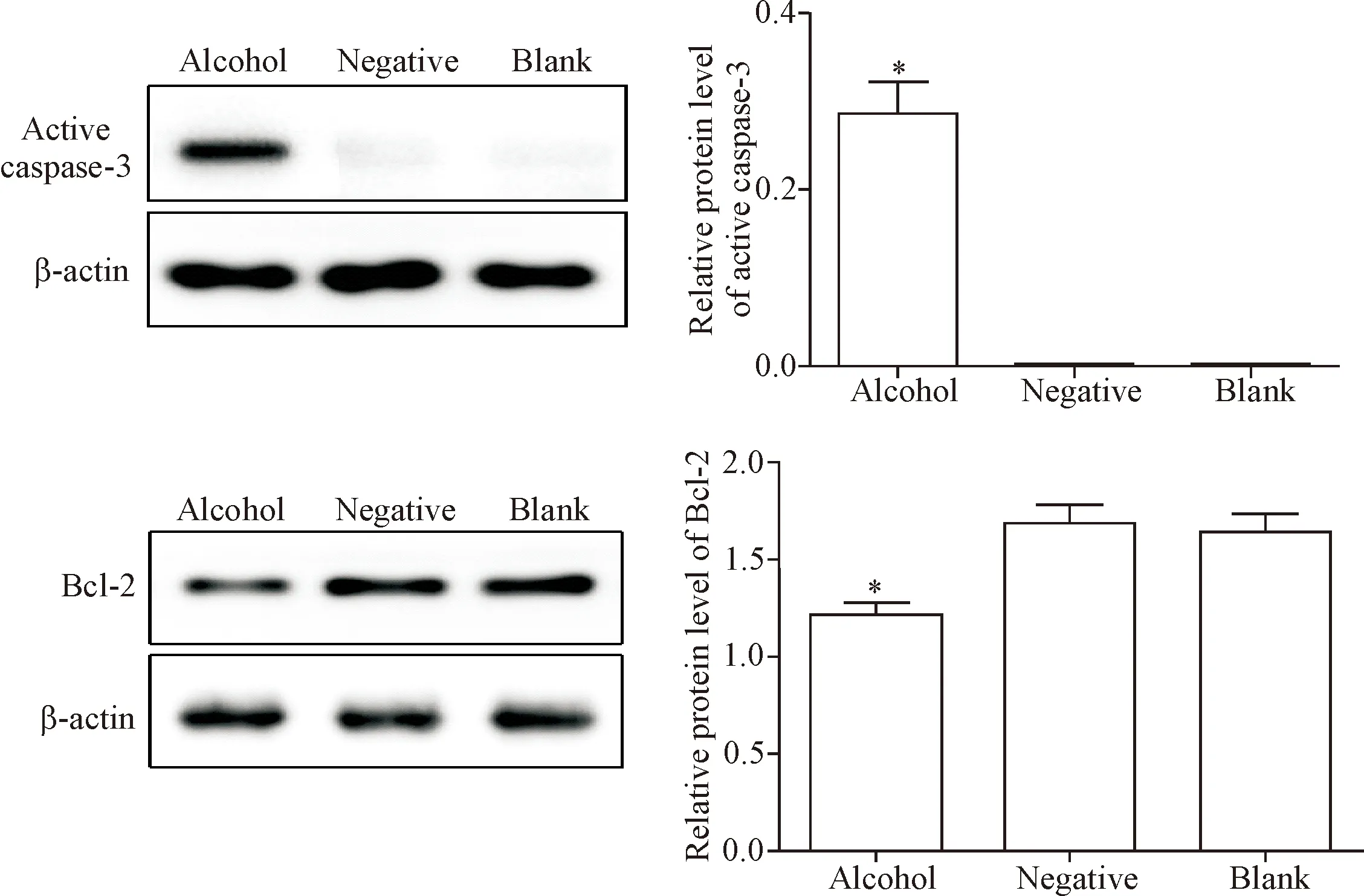
Figure 4. The protein levels of active caspase-3 and Bcl-2 were detected by Western blot. Mean±SD.n=5.*P<0.05vsother groups.
图4 Active caspase-3及Bcl-2蛋白表达水平
6 Caspase-3及Bcl-2基因启动子区域组蛋白H3K9及H3K27乙酰化水平检测
利用ChIP-qPCR方法分别检测caspase-3及Bcl-2基因启动子区域组蛋白H3K9及H3K27乙酰化水平,酒精暴露组caspase-3启动子区域组蛋白H3K9乙酰化(acH3K9)水平较对照组与空白组显著升高(P<0.05),而H3K27乙酰化(acH3K27)水平在各组间无显著差异;酒精暴露组Bcl-2启动子区域组蛋白H3K27乙酰化水平较对照组与空白组显著降低(P<0.05),而H3K9乙酰化水平在各组间无显著差异,见图5。
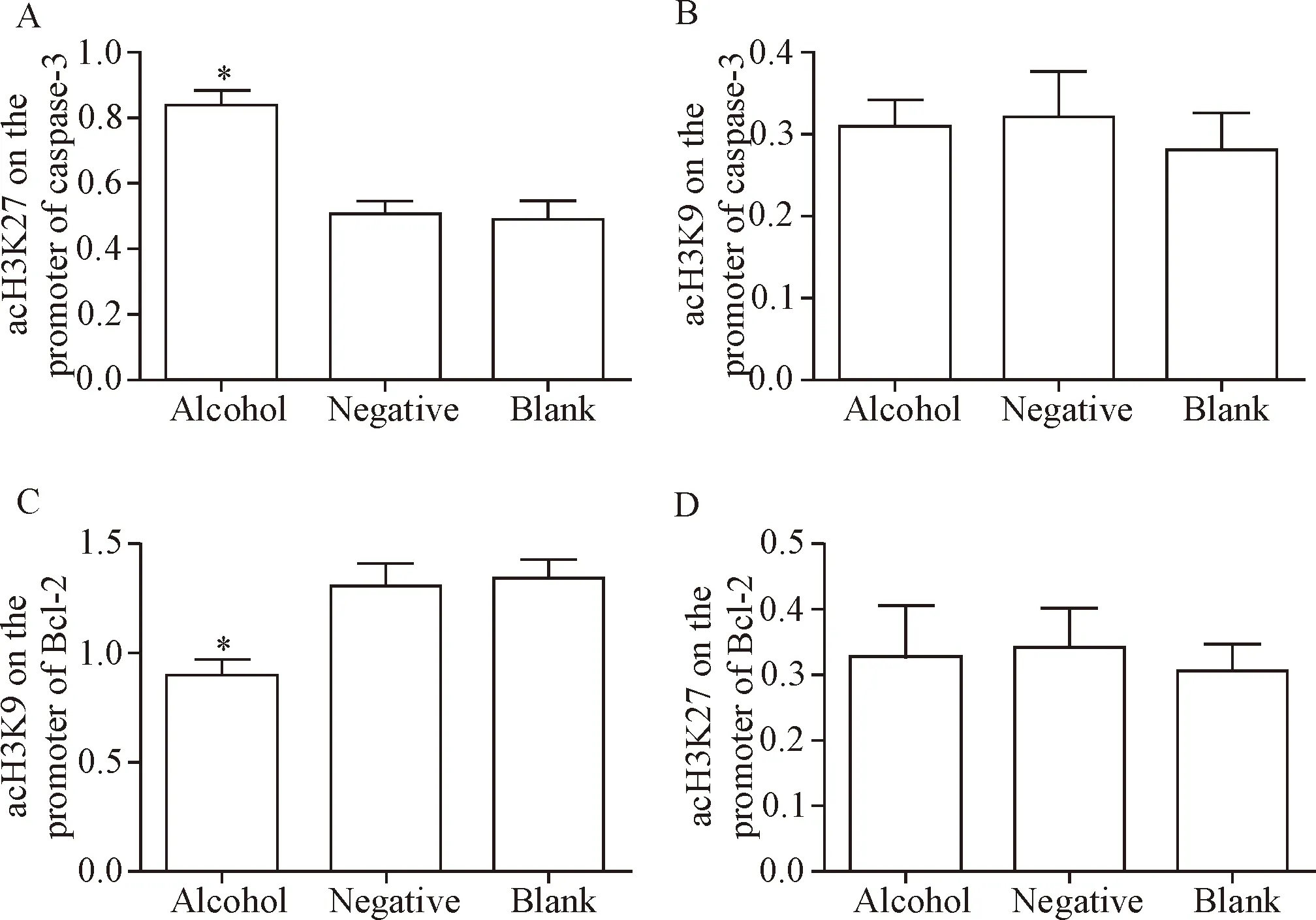
Figure 5. The acH3K9 and acH3K27 levels on the promoters of caspase-3 and Bcl-2. A: acH3K9 levels on the promoter of caspase-3; B: acH3K27 levels on the promoter of caspase-3; C: acH3K27 levels on the promoter of Bcl-2; D: acH3K9 levels on the promoter of Bcl-2. Mean±SD.n=5.*P<0.05vsother groups.
图5 Caspase-3及Bcl-2基因启动子区域组蛋白H3K9及H3K27的乙酰化水平
讨 论
酒精对胚胎心脏发育影响的研究主要集中于母代孕期酒精暴露,即我们熟知的胎儿酒精综合征(fetal alcohol syndrome, FAS),该综合征中先天性心脏病发生概率可达50%[4]。我们课题组先前利用动物模型亦观察到,组蛋白修饰在孕期酒精暴露致胚胎心脏发育异常中发挥关键作用[5]。然而,近年流行病学研究显示,父代饮酒亦可增加子代FAS发生率,同时可伴有子代的生长发育迟滞[6-8]。我们的研究同样观察到子代小鼠出生体重显著下降。既往研究多集中于心脏大体形态观察,直接发生如室间隔缺损和房间隔缺损概率并不高[8-9],我们实验中也并未观察到心脏大体形态的显著变化(数据未显示)。本研究中,我们首次对父代饮酒的子代小鼠心脏超微结构进行了观察,显示心肌组织中存在较广泛的超微结构破坏,包括肌丝排列紊乱、肌浆网扩张及肌丝溶解等,进一步的数据显示父代饮酒引起子代心肌细胞凋亡水平明显上升,即提示父代的酒精暴露可促进子代心肌细胞凋亡,同母代孕期酒精暴露一致,均是心脏发育过程中的危险因素。
Caspase-3是经典促凋亡蛋白,其活性形式active caspase-3是细胞凋亡过程中最主要的终末剪切酶[8], Bcl-2可以抑制由多种细胞毒因素所引起的细胞死亡[10-11], caspase-3及Bcl-2在凋亡中相互拮抗,共同参与调控细胞凋亡。因此,我们分别检测了caspase-3及Bcl-2表达水平,数据提示,父代饮酒的子代模型动物中caspase-3及Bcl-2在转录水平均发生变化,表现为caspase-3升高,而Bcl-2表达降低。在蛋白层面,基于具有活性成份的active caspase-3显著升高,表明caspase-3的活化水平增加,促进凋亡的发生;而抑制凋亡的重要蛋白Bcl-2含量降低,对于凋亡的抑制作用降低,从而导致心肌细胞内失衡,表现为凋亡的发生。
有研究发现组蛋白修饰对凋亡基因具有调控作用,是基因转录过程中的关键调控因子,有利于转录因子的结合,而组蛋白去乙酰化作用则相反,抑制基因转录[12-13]。组蛋白H3具有诸多可以发生乙酰化的赖氨酸位点,第9和27位赖氨酸是其中最为重要的2个乙酰化位点,组蛋白H3K9和H3K27的乙酰化是众多基因活化、转录的重要调控因素[14-15]。我们的数据显示父代饮酒的子代小鼠心肌组织中caspase-3启动子区域组蛋白H3K9乙酰化水平升高;另一方面,Bcl-2启动子区域组蛋白H3K27乙酰化水平显著降低,这与caspase-3转录水平的升高和Bcl-2转录水平的下降结果一致。这提示组蛋白乙酰化可能通过不同赖氨酸位点的修饰,实现对促凋亡基因及抑凋亡基因转录的动态调控,父代酒精暴露可改变子代小鼠心肌组织凋亡基因组蛋白乙酰化的平衡,进而导致促凋亡和抑凋亡蛋白表达的失调。
综上所述,本研究提示父代饮酒对子代心脏发育造成诸多不良影响,主要表现为心肌细胞的凋亡发生,而父代的酒精暴露是通过影响caspase-3及Bcl-2启动子区域组蛋白乙酰化修饰水平来参与子代新生小鼠心肌细胞凋亡的发生。据我们所知,这是首次对父代酒精暴露后子代心肌细胞程凋亡过程中组蛋白修饰的研究。然而这些新生小鼠成年后会有何种心脏疾病表型?组蛋白乙酰化又是通过哪些乙酰化酶和(或)去乙酰化酶调控凋亡发生?这些问题仍需进一步实验研究。
——基于人力资本传递机制
——基于城郊农村的调查
——基于反向社会化理论的实证研究

