ACE2基因过表达减轻血管紧张素II诱导的神经细胞氧化应激*
彭雯雯, 刘国英, 潘燕霞, 赵晓霖
(福建医科大学医学技术与工程学院康复治疗学系, 福建 福州 350004)
中枢氧化应激是高血压发生发展的病理生理机制,血管紧张素II(angiotensin II,Ang II)是刺激活性氧生成的关键因素[1-2]。然而,血管紧张素转换酶2(angiotensin-converting enzyme 2,ACE2)能降解Ang II生成为血管紧张素(1-7)[angiotensin(1-7),Ang(1-7)],后者与MAS受体结合拮抗Ang II作用[3]。在中枢神经系统,高血压大鼠延髓心血管中枢ACE2降低,而过表达ACE2则降低血压[4]。中枢ACE2过表达还可阻止Ang II介导的升压反应[5]。在Ang II诱导的高血压小鼠,过表达ACE2基因延缓高血压进展[6]。中枢ACE2在心血管疾病(高血压和慢性心衰)中的作用日益受到重视[7]。研究表明,ACE2降压作用与其抑制中枢交感神经活动[6, 8]、减轻氧化应激[7-8]、增强压力反射功能[6-7]等有关。自发性高血压大鼠过表达ACE2能降低心脏、肾脏和动脉内活性氧簇(reactive oxygen species,ROS)水平[5];相反,ACE2基因敲除加剧Ang II灌注所致脑内活性氧水平升高,过表达ACE2则降低脑内ROS水平,抑制还原型烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH)表达,从而降低血压[8]。
尽管ACE2能对抗Ang II诱导的氧化应激,在高血压和心力衰竭等心血管疾病中发挥重要作用,但ACE2引起氧化应激的通路尚未完全清楚。由于在整体动物,ACE2的作用受到神经和激素因素的影响,所以本研究在体外培养的神经细胞Neuro-2A,将携带ACE2基因的慢病毒转染神经细胞,探讨过表达ACE2对Ang II诱导氧化应激的影响及其作用机制,为ACE2作为心脑血管疾病新的治疗靶标提供实验依据。
材 料 和 方 法
1 细胞和材料
小鼠脑神经母细胞瘤Neuro-2A细胞购买于中国科学院典型培养物保藏委员会细胞库。DMEM高糖培养液和胰酶(含EDTA)购自HyClone;胎牛血清购自GEMINI;ACE2重组慢病毒载体(lentil-ACE2-eGFP)和慢病毒空载体携带绿色荧光蛋白(lentil-eGFP)由上海吉凯基因化学有限公司构建。AngⅡ、A779和dihydroethidium (DHE)购自MCE;Ang(1-7) ELISA试剂盒购自武汉华美生物科技有限公司;兔单克隆ACE2、AT1受体、NADPH氧化酶(NADPH oxidase, NOX)2和NOX4抗体购自Abcam;兔多克隆MAS抗体购自Alomone;兔多克隆p47phox和p67phox抗体购自Abcam;兔单克隆GAPDH抗体、辣根过氧化物酶标记的羊抗兔IgG-HRP等购自北京鼎国公司;Alexa Fluor 594标记山羊抗兔IgG购自Abcam。
2 方法
2.1 细胞培养 Neuro-2A细胞在含10%胎牛血清、1.0×105U/L青霉素和100 mg/L链霉素的DMEM高糖培养液中,置于37 ℃、5%CO2、饱和湿度培养箱内常规传代培养。实验所用细胞均为对数生长期细胞。待培养瓶内细胞融合度达80%以上时进行传代培养,实验在第3代细胞上进行。
2.2ACE2基因重组慢病毒载体构建ACE2基因重组慢病毒表达载体由上海吉凯基因化学有限公司构建。ACE2基因全长2 459 bp,序列号为NM_021804。利用PCR技术进行扩增人源ACE2cDNA片段,引物序列为:正义序列5’-GAGGATCCCCGGGTACCGGTCGCCACCATGTCAAGCTCTTCCTGGCTCC-TTC-3’;反义序列5’-TCCTTGTAGTCCATACCAAAGGAGGTCTGAACATCATCAGTG-3’。将扩增的人源ACE2基因片段与慢病毒载体GV358进行同源重组,酶切克隆位点为AgeI/AgeI,形成目的基因慢病毒为GV358-ACE2。阳性克隆测序证实测序结果与GenBank网站上人源ACE2序列一致。将连接成功的GV358-ACE2慢病毒转染293T细胞,通过抽提病毒、浓缩和病毒滴度测定,最终获得ACE2重组慢病毒的滴度为5×1011TU/L。
2.3 实验分组 Neuro-2A细胞接种36 h,细胞达到50%~60%融合时,慢病毒载体和重组ACE2以感染复数(multiplicity of infection, MOI)=10加入培养液中,培养10 h后弃去病毒液,加入新鲜的正常培养液继续培养96 h提取细胞总蛋白。实验共分为7组:空白对照(control)组、慢病毒载体(eGFP)组、重组ACE2(ACE2-eGFP)组、Ang II刺激(Ang II)组、Ang II+慢病毒载体(Ang II-eGFP)组、Ang II+重组 ACE2(Ang II-ACE2-eGFP)组和Ang Ⅱ+重组ACE2+A779(Ang II-ACE2-eGFP-A779)组。
空白对照组不做任何处理。eGFP组和ACE2-eGFP组均以MOI=10将慢病毒转染神经细胞。
Ang II干预组: 预实验时,以终浓度为1 000、100、10和1 nmol/L的AngⅡ孵育细胞24 h后检测AT1受体蛋白水平,以此确定AngⅡ最佳浓度为100 nmol/L[9]。
A779干预组:Ang(1-7)拮抗剂A779以终浓度为10 μmol/L加入培养液预处理30 min后,与AngⅡ共刺激细胞24 h。
2.4 Neuro-2A细胞的组织学鉴定 用镊子取出6孔板中的细胞爬片,预温37 ℃的PBS洗涤2次。预温37 ℃的4%多聚甲醛固定细胞20 min,PBS洗3次,每次5 min。 0.2% Triton透化15 min,PBS洗3次,每次5 min。5%羊血清室温封闭1 h,甩干,勿洗。 滴加适量兔抗NeuN抗体(1 200)于盖玻片上,4 ℃孵育过夜。PBS洗涤3次,每孔2 mL,每次5 min。滴加适量Alexa Fluor 594 标记的羊抗兔 IgG(1500)于盖玻片上,室温避光孵育2 h。PBS洗涤3次,每次5 min。滴加适量抗荧光淬灭剂避光孵育5 min, 吸除多余抗荧光淬灭剂,中性树脂封片,应用正置荧光显微镜进行观察并拍照。
2.5ACE2重组慢病毒转染Neuro-2A细胞 选用第3代生长状态良好的神经细胞,按照5×107/L细胞密度接种2 mL到6孔板中。待细胞生长融合至孔底面积的50%左右时,更换为无血清的DMEM饥饿培养12 h。慢病毒以MOI为10感染Neuro-2A细胞10 h后,弃去病毒液,更换为完全培养液继续培养。病毒感染72 h后,通过荧光显微镜观察绿色荧光蛋白表达情况。感染96 h后,使用细胞裂解液提取总蛋白。
2.6 原位检测细胞内ROS水平 Neuro-2A细胞按照每孔2.5×104个细胞密度接种到24孔板中,加入lentil-eGFP和lentil-ACE2-eGFP进行转染,72 h后加入AngⅡ(100 nmol/L)继续培养24 h。96 h后弃去旧培养液,室温下PBS漂洗3次,加入含有2 μmol/L DHE荧光探针的DMEM培养液500 μL,37 ℃避光孵育30 min,继续用PBS洗涤细胞3次,在荧光显微镜下观察并拍照。利用ImageJ软件进行荧光强度分析。
2.7 ELISA法测定Ang(1-7)水平 Neuro-2A细胞加入裂解液提取细胞蛋白,4 ℃、13 500×g离心20 min,取上清放入新的EP管中。采用ELISA试剂盒(CSB-E13763m)测定Ang(1-7)水平,按照说明书步骤进行操作[5]。
2.8 ACE2、MAS受体和NADPH氧化酶蛋白水平检测 收集各组细胞,预冷PBS冲洗2次,加入细胞裂解液(RIPA PMSF 蛋白酶抑制剂=100 1 1),冰上裂解30 min,4 ℃、13 500×g离心20 min,上清为细胞总蛋白。采用BCA法测定蛋白浓度。取30 μg蛋白进行SDS-PAGE电泳(10%分离胶)、湿转恒压100 V,5%的脱脂奶粉室温下封闭1 h,分别孵育兔抗ACE2、p47phox、p67phox(1 1 000)及兔抗MAS、NOX2、NOX4(1 2 000),4 ℃摇床过夜 。次日TBST洗3次,每次10 min。II抗(1 3 000)室温摇床1 h,TBST洗3次,每次10 min。加入ECL发光液进行显色、曝光。利用ImageJ软件进行灰度值分析,以GAPDH作为内参照,结果采用目的蛋白与GAPDH蛋白比值表示。
3 统计学分析
上述每个独立实验均重复3次以上,全部数据以均数±标准差(mean±SD)表示,采用SPSS 20.0软件系统进行统计学分析。各组间比较采用单因素方差分析(one-way ANOVA),再采用最小显著性差异法(LSD法)进行两两比较,以P<0.05表示差异有统计学意义。
结 果
1 体外培养Neuro-2A细胞鉴定及 ACE2基因转染
神经细胞标志物神经元核抗原(neuronal nuclear antigen,NeuN)在荧光显微镜下呈现红色。图1A可见Neuro-2A细胞胞浆呈红色,证明为神经细胞。慢病毒载体上携带绿色荧光蛋白,重组ACE2转染神经细胞72 h后,图1B显示80%以上的细胞呈现绿色荧光,说明ACE2基因成功导入神经细胞中。图1C是A和B的重叠,提示导入ACE2基因的细胞是神经细胞。慢病毒载体和重组ACE2以MOI =10感染Neuro-2A细胞72 h后,图1D显示空白对照组和慢病毒载体组不表达ACE2蛋白,ACE2基因导入组ACE2蛋白水平为空白对照组的1.45±0.31倍(P<0.05)。
2 AngⅡ干预对AT1受体蛋白表达的影响
AT1受体蛋白表达水平随AngⅡ浓度升高而增加,呈现浓度依赖性,AT1受体蛋白较空白组显著增加(P<0.05),其中100 nmol/L组的AT1受体蛋白表达达到峰值,故作为本实验后续的干预浓度,见图2。
3 ACE2过表达对AngⅡ诱导的ROS水平的影响
重组ACE2基因转染培养的神经细胞,其ROS水平与空白对照组无显著差异(P>0.05)。AngⅡ刺激显著升高ROS 水平(P<0.01),但ACE2基因过表达能抑制AngⅡ引起的ROS水平升高(P<0.01),ACE2基因转染+AngⅡ组ROS显著低于Ang II处理组(P<0.05),见图3。

Figure 1. Identification of the Neuro-2A cells andACE2gene transfection. A: NeuN positive cells (red); B:ACE2-transfected cells (green); C: merged image of A and B; D: ACE2 protein expression afterACE2transfection. The scale bar=50 μm. Mean±SD.n=4.*P<0.05vsthe control or eGFP group.
图1 Neuro-2A 细胞鉴定及ACE2基因转染

Figure 2. The effects of various concentrations of Ang II on AT1 receptor protein expression in the Neuro-2A cells. Mean±SD.n=4.*P<0.05vs0 nmol/L;#P<0.05vs1 nmol/L;$P<0.05vs10 nmol/L.
图2 Ang II诱导Neuro-2A细胞AT1受体蛋白表达的量效关系

Figure 3. The changes of reactive oxygen species in the Neuro-2A cells (DHE staining). The scale bar=50 μm. Mean±SD.n=4.*P<0.05vscontrol group;#P<0.05vseGFP+Ang II group.
图3 DHE 染色显示Neuro-2A细胞内活性氧变化
4 ACE2过表达对AngⅡ诱导的NADPH氧化酶的影响
空白对照组和慢病毒载体组的NOX2、NOX4、p47phox和p67phox蛋白表达无显著差异。AngⅡ处理组NOX2、NOX4、p47phox和p67phox的蛋白表达显著高于对照组(P<0.01),ACE2基因过表达则抑制AngⅡ诱导NOX2、NOX4、p47phox和p67phox的蛋白表达(P<0.01)。慢病毒载体不影响AngⅡ上调NOX2、NOX4、p47phox和p67phox蛋白表达的作用,见图4。

Figure 4. The effect ofACE2over-expression on the protein expression of NADPH oxidase (NOX) in the Neuro-2A cells. Mean±SD.n=4.*P<0.05,**P<0.01vscontrol group;##P<0.01vseGFP+Ang II group.
图4ACE2过表达对Neuro-2A细胞NADPH氧化酶蛋白表达的影响
5 ACE2过表达对AngⅡ诱导的Ang(1-7)水平的影响
空白对照组、慢病毒载体组和ACE2-eGFP组的Ang(1-7)水平无显著差异(P>0.05)。AngⅡ处理组或病毒空载体+Ang II组也不影响Ang(1-7)水平(P>0.05),但ACE2-eGFP+AngⅡ组Ang(1-7)水平显著升高于空白对照组和AngⅡ处理组(P<0.05),见图5A。
6 ACE2过表达对AngⅡ诱导的MAS蛋白表达的影响
空白对照组、慢病毒载体组和重组ACE2组,3组MAS蛋白表达无显著差异(P>0.05)。AngⅡ处理显著下调MAS蛋白表达(P<0.01),慢病毒载体+Ang II组MAS蛋白表达也显著低于空白对照组(P<0.05), ACE2-eGFP+AngⅡ组MAS蛋白表达较单独Ang II处理组显著上调(P<0.05),见图5B。
7 Ang(1-7)受体拮抗剂对NADPH氧化酶的影响
与空白对照组相比,AngⅡ处理显著增强NOX2、NOX4、p47phox和p67phox蛋白表达(P<0.01)。ACE2基因过表达则显著降低AngⅡ介导的NOX2、NOX4、p47phox和p67phox蛋白表达(P<0.05),但这种作用可以被MAS受体拮抗剂A779所阻断(P<0.05),见图6。
讨 论
ACE2是血管紧张素转换酶的同源物,但作用与其相反。ACE2主要作用是降解Ang II生成Ang(1-7),一方面Ang II水平降低,能改善与Ang II相关的疾病;另一方面,Ang (1-7)水平升高,对Ang II产生负性调节作用[10]。因此,ACE2能调节Ang II/Ang (1-7)平衡。在整体水平,ACE2基因功能受到神经和其体液因素影响。为研究ACE2基因在中枢神经系统中作用及其下游信号通路,本实验选用培养的神经细胞,探讨ACE2过表达对Ang II诱导的氧化应激的影响及其介导因素。Neuro-2A细胞是脑神经瘤细胞,主要用于研究神经细胞的分化、轴突生长及中枢信号通路等。它含有肾素-血管紧张素系统大多数成分,如肾素、Ang II和AT1受体等, 但ACE2含量非常少。若没有外来刺激,几乎无法检测到ACE2蛋白表达。因此,Neuro-2A细胞是研究ACE2基因功能的理想模型[11]。本实验采用同源重组技术构建携带ACE2和eGFP双基因的慢病毒载体,并转染Neuro-2A细胞,在荧光显微镜下,Neuro-2A细胞检测到绿色荧光,说明ACE2基因已成功进入Neuro-2A细胞。NeuN是神经细胞标志物[12],采用免疫荧光技术对Neuro-2A细胞进行染色,Neuro-2A细胞在荧光显微镜下也检测红色荧光,从而证实ACE2成功导入的Neuro-2A细胞是神经细胞。Western blot 显示神经细胞内ACE2蛋白高表达,进一步证明ACE2成功导入神经细胞,为后续研究奠定基础。

Figure 5. The effect ofACE2over-expression on Ang(1-7) level (A) and MAS protein expression (B) in Neuro-2A cells. Mean±SD.n=4.*P<0.05vscontrol group;#P<0.05vseGFP+Ang II group.
图5ACE2过表达对Neuro-2A细胞Ang(1-7)水平和MAS蛋白表达的影响
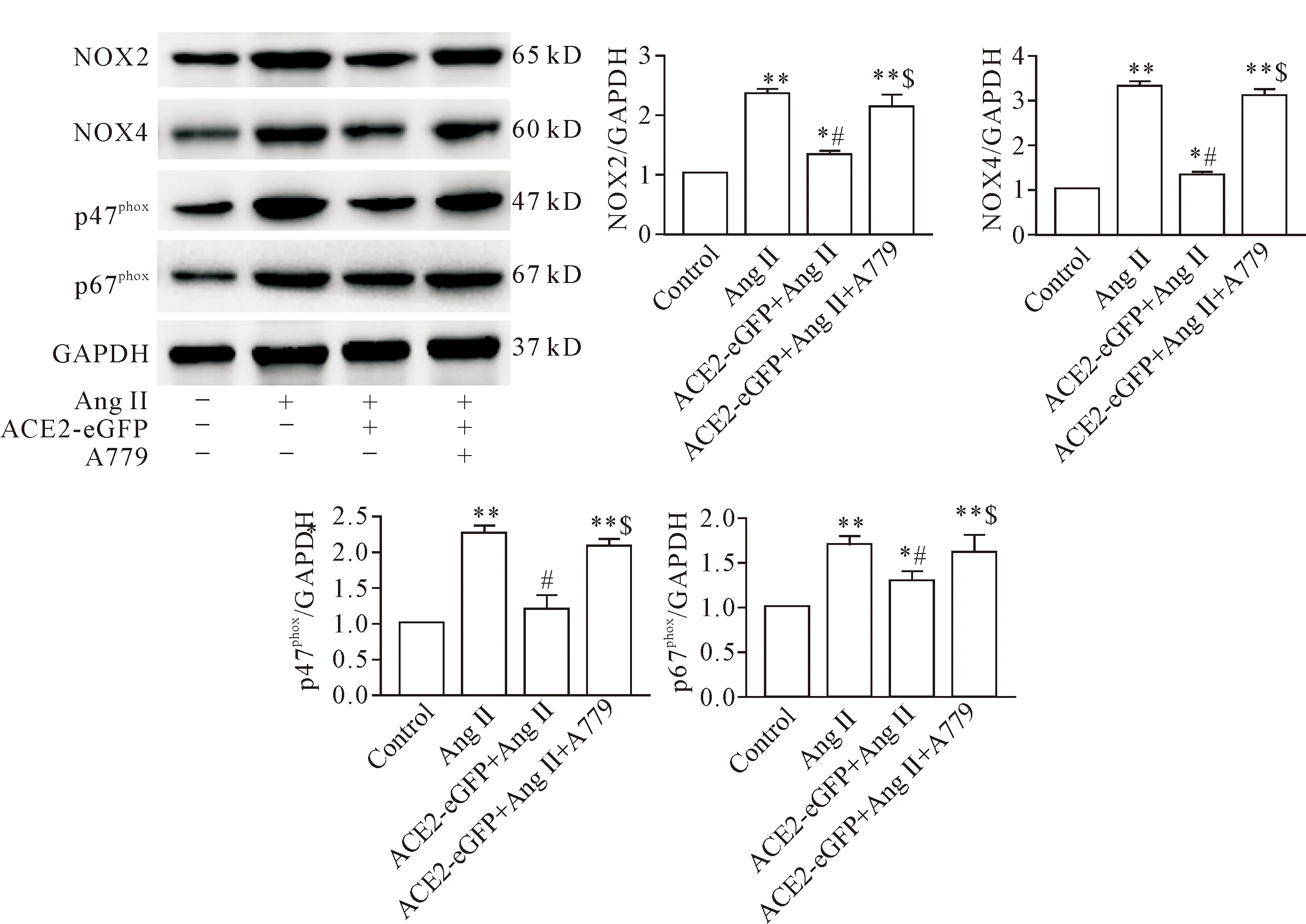
Figure 6. Effects of MAS receptor antagonist A779 on the protein expression of NADPH oxidase in the Neuro-2A cells. Mean±SD.n=4.*P<0.05,**P<0.01vscontrol group;#P<0.05vsAng II group;$P<0.05vsACE2-eGFP+Ang II group.
图6 MAS受体拮抗剂A779对Neuro-2A细胞NADPH氧化酶表达的影响
Ang II是引起细胞氧化应激的主要刺激物[13],本实验在培养神经细胞加入100 nmol/L Ang II,细胞内ROS水平较空白对照组增加了(10.26±1.9)倍,ACE2基因显著抑制Ang II 诱导的ROS水平升高。在培养血管内皮细胞,ACE2基因过表达也产生抑制细胞氧化应激的作用[14]。细胞内ROS水平升高主要来自NADPH氧化酶激活[15- 16]。正常情况下NADPH氧化酶由胞膜上NOX2(gp91phox)和p22phox亚基,以及胞浆p47phox和p67phox亚基组成,胞膜上亚基与胞浆亚基分离,NADPH氧化酶没有活性。但在Ang II刺激下,胞浆内亚基活化,并转位到胞膜上,与胞膜上亚基结合,激活NADPH氧化酶,导致ROS生成增多[2]。本研究也观察到,在Ang II刺激下,NADPH氧化酶NOX2、NOX4、p47phox和p67phox亚基蛋白表达均上调,显著高于空白对照组,但ACE2基因过表达则显著抑制Ang II诱导的NOX2、NOX4、p47phox和p67phox表达。ACE2基因以慢病毒为载体,本研究结果显示,慢病毒载体不影响Ang II对NADPH氧化酶的刺激作用。在没有Ang II刺激情况下,单独ACE2基因过表达也不影响NADPH氧化酶亚基的表达。在培养的血管内皮细胞,AngⅡ刺激明显增加NADPH氧化酶亚基p22phox的表达,而ACE2基因过表达则明显抑制p22phox表达[14]。此外,ROS水平升高还与NADPH氧化酶激活有关。Zhong等[17]报道Ang II能增强NADPH氧化酶活性,促进ROS生成增加。若敲除ACE2基因则增加肾脏ROS水平和NADPH氧化酶活性[18]。上述研究结果表明ACE2过表达通过抑制NADPH氧化酶表达和活性而减轻Ang II诱导的氧化应激。
为了明确介导ACE2作用的下游信号通路,本实验检测Ang(1-7)水平和MAS受体表达。结果表明,Neuro-2A细胞内Ang(1-7)较低水平, 给予 Ang II刺激后,Ang(1-7)水平无明显变化,这与Zhang等[19]结果不一样,Zhang等[19]报道Ang II刺激后,内皮细胞内Ang(1-7)水平明显下降。造成这个差异可能由于内皮细胞存在内源性ACE2,Ang II刺激后,Ang II浓度升高抑制ACE2酶活性,导致Ang(1-7)生成减少。而Neuro-2A细胞几乎测不到内源性ACE2,加入Ang II对神经细胞内Ang(1-7)水平无明显影响。然而,神经细胞过表达ACE2后,Ang II刺激不仅不能降低Ang(1-7),反而显著提高Ang(1-7)水平。其可能原因是,外源性Ang II浓度高于生理水平,ACE2过表达使Ang II分解为Ang(1-7)增多,从而提高神经细胞Ang(1-7)水平。Lo等[5]报道正常大鼠灌注Ang II,引起血浆Ang II水平升高,Ang(1-7)水平降低,ACE2过表达则升高血浆Ang(1-7)。本实验ACE2过表达取消了Ang II抑制MAS受体表达的作用,MAS受体蛋白水平恢复,接近于空白对照组水平。同样地,Sriramula等[20]在Ang II灌注诱导高血压大鼠模型中,Ang II灌注下调ACE2和MAS受体表达,而ACE2过表达则上调MAS受体表达。若无Ang II刺激,ACE2基因过表达对神经细胞Ang(1-7)和MAS受体无明显影响。这说明ACE2过表达对正常情况无明显影响,但能够对抗Ang II作用。
为了明确ACE2抑制NADPH氧化酶表达是否由MAS受体介导的,本研究在ACE2过表达的神经细胞加入MAS受体阻断剂A779,与Ang II共同处理神经细胞,结果表明A779取消了ACE2抑制NADPH氧化酶亚基表达的作用,A779组NOX2、NOX4、p47phox和p67phox等蛋白表达升高,接近于单纯AngⅡ处理组,这一结果提示ACE2下调NADPH氧化酶表达是通过MAS受体介导的。在培养的脂肪细胞,Liu等[21]证实Ang(1-7)可以降低NADPH氧化酶水平,抑制氧化应激,而MAS受体阻断剂A779可拮抗Ang(1-7)的作用。
综上所述,在Ang II诱导氧化应激的神经细胞,ACE2基因过表达通过MAS受体介导减轻细胞氧化应激,这一作用与NADPH氧化酶表达降低有关。

