超声波辅助副干酪乳杆菌发酵脱脂乳粉制备多肽的动力学研究
陈苏婉,汤颖秀,邢 政,侯小珊,何荣海,马海乐
(江苏大学食品与生物工程学院,江苏省农产品物理加工重点实验室,江苏镇江 212013)
近年来,副干酪乳杆菌作为乳制品的发酵菌种被广泛用于发酵生产,传统副干酪乳杆菌发酵乳的功效成分主要是益生菌,其功能单一,对健康的促进效果有限[1]。传统副干酪乳杆菌发酵乳发酵过程存在发酵周期长、菌体内外物质交换效率低等问题,导致发酵效率及产物得率都较低[2-4]。通过前期研究发现,以脱脂乳粉、葡萄糖等为底物,在微生物的发酵过程中施加适宜的超声波处理,可有效提高发酵效率,加快发酵进程,提高发酵产物产量和功能特性[5];超声波处理后的发酵乳中多肽含量显著提高,同时,发酵乳的营养品质和活性功能得到了加强[5],但超声波对脱脂乳粉发酵进程促进的原因还有待进一步的研究。
发酵动力学是指在整个发酵过程中,随着发酵时间的延长,发酵液中微生物的活菌数、产物的生成量和底物的消耗量的变化规律以及各变量之间通过软件建立的相应数学模型关系[6]。研究发酵动力学是为了了解发酵过程中不同变量之间的关系,找出各种变化和现象之间存在的潜在联系,对不同参数进行非线性拟合确定相应模型参数的系数值[6]。在微生物发酵的过程中,微生物的生长代谢会影响发酵产物中产物的生成以及底物的消耗,微生物消耗的底物用于自身生长的维持和生产活性产物[7]。研究发酵动力学对于发酵过程的优化和调控、深入了解微生物的代谢规律、将发酵规模从实验室向工厂化的转变和放大有着十分重要的意义[8]。何荣海等[9]研究了枯草芽孢杆菌液态分批发酵菜籽粕的代谢特征,发现多肽浓度在32 h时达到稳定,对枯草芽孢杆菌正常液态发酵过程中的菌体生长规律、多肽生成和底物蛋白消耗进行了模型拟合,且模型验证的计算值与实测值的相对误差低于10%,较好地反映了枯草芽孢杆菌分批发酵过程的动力学特征。孟掉琴等[10]通过筛选复合益生菌,以苹果浊汁为原料,构建了菌体生长、产物生成及底物消耗动力学模型,研究确立了模型的动力学参数,并进行验证,发现模型的理论值与试验值误差均小于10%,拟合较好,建立的动力学模型能够较好地预测复合益生菌发酵苹果浊汁发酵过程的变化。对超声波辅助发酵制备发酵乳过程进行发酵动力学研究,有助于对超声处理促进发酵过程原因的分析。
为此,本文对超声处理与未超声处理的副干酪乳杆菌发酵脱脂乳制备多肽发酵过程分别建立发酵动力学模型,并进行比较分析,探讨超声波提高发酵效率的原因。
1 材料与方法
1.1 材料与仪器
副干酪乳杆菌(CICC编号:20241) 中国工业微生物菌种保藏管理中心;脱脂乳粉(蛋白质含量:32.9%) 新西兰恒天然公司;食用葡萄糖 呼伦贝尔东北阜丰生物科技有限公司;MRS培养基 杭州百思生物技术有限公司;酪蛋白(AR)、1,1-二苯基-2-三硝基苯肼(DPPH,AR)、中性红(AR)、百里酚酞(AR) 国药集团化学试剂有限公司。
PB-10型pH计 赛多利斯科学仪器(北京)有限公司;T6新世纪紫外分光光度计 北京普析通用仪器有限责任公司;DL-5C型离心机 上海安亭科学仪器厂;YX280A型灭菌锅 上海三申医疗器械有限公司;QYC-200型全温空气摇床 上海福玛实验设备有限公司;JJ-CJ-1FD型单人单面无菌超净操作台 苏州市金净净化设备科技有限公司;脉冲多频超声试验设备 江苏大学食品与生物工程学院自主研制。
1.2 实验方法
1.2.1 多肽发酵乳的制备 称取脱脂乳粉12.6 g,葡萄糖6 g,100 mL蒸馏水溶解至250 mL锥形瓶中,搅拌至完全溶解,115 ℃高压灭菌15 min后冷却至室温,以5%(v/v)的接种比例接种副干酪乳杆菌种子液,使用摇床进行发酵(发酵时间:24 h,摇床转速:180 r/min,发酵温度:37 ℃)。在发酵9 h时取出发酵液,在37 ℃用频率为28 kHz,功率为100 W/L,每超声100 s间歇10 s超声35 min[11]。在超声组进行超声的同时,将对照组置于37 ℃水浴锅中保温,待超声结束后将超声组与对照组一同放回摇床中继续培养。在发酵过程的不同时刻取样,分别测定pH、葡萄糖含量、游离氨基酸含量、活菌数、多肽含量以及底物剩余蛋白质含量等指标。
每隔2 h取超声组与对照组的发酵乳分别测定活菌总数和pH。另外取发酵乳按如下步骤制备样液,用于测定除活菌数之外的指标:将发酵乳振荡摇匀后,取10 mL置于50 mL离心管中,用1 mol/L HCl溶液调节发酵乳pH至3.4~3.6,4000 r/min离心20 min。取上清液用1 mol/L NaOH溶液调节pH至8.2~8.4,4000 r/min离心20 min获得上清液进行相关指标的测定。
1.2.2 指标的测定
1.2.2.1 酸含量的变化 由于检测发酵乳中乳酸的含量较为不便,故以pH的变化代替乳酸含量的变化作为动力学模型研究的监测指标,其中pH用pH计直接测定。
1.2.2.2 葡萄糖含量的测定 取1.2.1中的发酵待测样液参照国标法[12]测定发酵乳中葡萄糖的含量。取5.0 g混匀后的发酵乳(精确至0.001 g),置于250 mL容量瓶中,加入50 mL水,缓慢加入乙酸锌溶液5 mL和亚铁氰化钾溶液5 mL,加水至刻度,混匀,静置30 min,用干燥滤纸过滤,弃去初滤液,取后续滤液备用。吸取碱性酒石酸铜甲液5.0 mL和碱性酒石酸铜乙液5.0 mL于250 mL锥形瓶中,加水10 mL,玻璃珠2~4粒,控制在2 min内加热至沸,保持沸腾继续以1滴/2 s的速度滴定,直至蓝色刚好褪去即为终点,记录样液消耗体积,平行测定3次,得出平均消耗体积(V)。
X=(m1×25)/(m×V)
式(1)
式中:X:试样中还原糖的含量(g/100 g);m1:碱性酒石酸铜溶液(甲、乙液各半)相当于某种还原糖的质量(mg);m:试样质量(g);V:测定时平均消耗试样溶液体积(mL)。
1.2.2.3 发酵乳中活菌数的测定 按照GB 4789.2-2016食品微生物学检验菌落总数的测定方法对发酵乳中的活菌数进行菌落计数[13]。将发酵乳摇匀,取5 mL于50 mL已灭菌的生理盐水中,混匀,制成样品溶液。取1 mL上述样品溶液于装有9 mL无菌生理盐水的无菌试管中,稀释6倍,取1 mL稀释液于灭菌平板中,将MRS琼脂培养基倾注于平板内,凝固后转入37 ℃培养箱中培养48 h进行菌落计数[5]。
1.2.2.4 游离氨基酸含量的测定 取超声组与对照组发酵待测样液各5 mL分别于两个250 mL锥形瓶中,每个锥形瓶中分别加入25 mL蒸馏水,一个锥形瓶中加入2~3滴0.1%中性红的50%乙醇溶液指示剂(中性红指示剂),用0.1 mol/L NaOH滴定至pH为7.4(颜色由红色变为琥珀色),记录消耗NaOH的体积为V1;向另一个锥形瓶中加入10 mL 40%甲醛溶液、2~3滴0.1%百里酚酞乙醇指示剂,充分摇匀后静置1 min,用0.1 mol/L NaOH滴定至pH为10.0(颜色由无色变为浅蓝色),记录消耗NaOH的体积为V2。按下式计算出样品中氨基酸态氮浓度,即可作为发酵乳中游离氨基酸的含量[14-16]。
氨基酸态氮浓度(mg/mL)=C×(V2-V1)×0.014×100
式(2)
式中:C:氢氧化钠标准溶液的浓度(mol/L);V1:中性红为指示剂消耗氢氧化钠标准溶液的体积(mL);V2:百里酚酞为指示剂消耗氢氧化钠标准溶液的体积(mL);0.014:氮的毫摩尔质量(g/mmoL);100:氨基酸态氮浓度转换系数。
1.2.2.5 多肽含量的测定 准确称取酪蛋白标准品12 g,用蒸馏水配制成12 mg/mL的母液,分别稀释为10、8、6、4和2 mg/mL的酪蛋白标准溶液。取1 mL酪蛋白标准溶液与3 mL双缩脲试剂混匀后静置30 min,于540 nm处测定吸光度值[4],根据结果制作标准曲线,标准曲线方程为y=0.0629x+0.0022,R2=0.998。
参照任国谱等[17]的研究方法配制双缩脲试剂。将5 mL按照1.2.1中方法制备得到的发酵液待测样液与10%的三氯乙酸(TCA)溶液1∶1等体积混匀后静置10 min,4000 r/min离心15 min。将离心上清液与双缩脲试剂以体积比3∶2的比例混匀后静置15 min,于540 nm处测定吸光度OD值,每个样品平行测定三次,取平均值,通过标准曲线回归方程换算得到多肽浓度C[18]。按照同样方法测定制备的发酵0 h时的发酵样液中多肽浓度C0。多肽含量的计算见下式:
多肽含量(mg/mL)=(C-C0)×2×5/3
式(3)
式中:C:发酵到某一时刻时发酵样液多肽浓度(mg/mL);C0:起始多肽浓度(mg/mL);2、5/3:样品的稀释倍数。
1.2.2.6 底物剩余蛋白质含量计算 在发酵过程中,副干酪乳杆菌生长所消耗的蛋白质绝大部分都转变成了牛乳多肽和游离氨基酸,因此,发酵乳中的底物剩余蛋白质含量可以通过脱脂乳粉发酵培养基中的总蛋白量除去乳源多肽和游离氨基酸的含量来计算。底物剩余蛋白质含量按下式计算:
M=M总-M1-M2
式(4)
式中:M总:发酵液中总蛋白含量(mg/mL);M1:发酵液中多肽含量(mg/mL);M2:发酵液中游离氨基酸含量(mg/mL)。
1.2.3 菌体生长动力学模型建立及拟合曲线分析 在菌体生长动力学中,Logistic模型能够很好地反映菌体浓度增加对菌体自身生长的抑制,表明微生物的生长速率不依赖物质的限制[19]。本文采用该模型来描述副干酪乳杆菌发酵制备多肽发酵乳中菌体细胞的生长,式(5)为Logistic方程。
式(5)
令t=0,X=X0,Logistic方程可以积分为代数方程式(6)。
式(6)
式中:X:发酵乳中的活菌数(106CFU/mL);μm:最大比生长速率(106个/h);Xmax:活菌数最大值(106CFU/mL)。
对超声组和未超声组的活菌数增长情况分别建立动力学模型分析。以式(6)为自定义函数,应用Matlab软件进行非线性拟合并进行对比分析。
1.2.4 产物生成动力学模型建立及拟合曲线分析 Luedeking和Piret对产物生成动力学规律进行了总结,可描述发酵产物形成与细胞生长的关系[20]。
式(7)
将式(6)代入(7),并积分可得式(8):
式(8)
式中:P:多肽浓度(mg/mL);P0:初始多肽浓度(mg/mL);A:与菌体生长相关联的产物合成常数(g/g);β:与菌体量相关联的产物合成常数(g/g·h);X:发酵乳中的活菌数(106CFU/mL)。
对超声组和未超声组的多肽浓度变化情况分别建立动力学模型分析。以式(8)为自定义函数,应用Matlab软件进行非线性拟合并进行对比分析。
1.2.5 底物消耗动力学模型建立及拟合曲线分析 在副干酪乳杆菌发酵产多肽的过程中,发酵培养基中奶粉蛋白的消耗主要用于菌株的生长、多肽和游离氨基酸的生成,乳源多肽和氨基酸的生成是由于菌株生长过程中释放的酶作用于牛乳蛋白而生成,可以看作菌株生长的一部分,因此牛乳蛋白主要是用于菌株的生长和维持,故牛乳蛋白的消耗可用与Luedeking-Piret方程相似的方程式9表示。
式(9)
对式(9)进行求解得到积分式(10)。
式(10)
式中:S:底物蛋白剩余量(×100 mg);S0:初始底物蛋白剩余量(×100 mg);Yx/s:底物用于菌体生长的得率常数;ms:微生物维持常数。
对超声组和未超声组的底物蛋白剩余量分别建立动力学模型分析以式(10)为自定义函数,应用Matlab软件进行非线性拟合并进行对比分析。
1.3 数据分析
每个实验结果重复测定3次,结果以“平均值±标准差”的形式表示。使用SPSS 17.0进行单因素方差分析,显著性水平α设定值为0.05,使用Origin 8.6进行图形绘制。
2 结果与分析
2.1 副干酪乳杆菌发酵乳发酵过程主要指标的变化及分析
超声组和对照组的pH基本保持一致(图1),超声组的葡萄糖消耗量略低于未超声组(图2),发酵乳中的游离氨基酸含量略高于未超声组,且游离氨基酸含量在发酵20 h以后增加幅度变大(图3)。如图4、图5,在发酵9 h对发酵乳进行超声波处理后,随着发酵时间的延长,超声组的多肽含量和活菌数逐渐高于对照组。超声组发酵底物中的剩余蛋白质含量要低于对照组(图6)。

图1 发酵过程中pH变化曲线图

图3 发酵过程中游离氨基酸含量变化曲线图

图4 发酵乳中菌体浓度变化曲线图

图5 发酵过程中多肽含量变化曲线图

图6 发酵过程中底物剩余蛋白质含量变化曲线图
2.2 菌体生长动力学模型参数求解及拟合曲线分析
从图4菌体浓度变化曲线可以发现超声组与未超声组菌体生长都呈S型曲线,符合Logistic模型反映的分批发酵过程中菌体的生长规律[20],超声组发酵液中的活菌数高于未超声组,以式(6)为自定义函数,应用Matlab软件对未超声组和超声组副干酪乳杆菌数实验值与模型方程分别进行非线性拟合。
利用Matlab软件拟合获得未超声组副干酪乳杆菌生长实验值与模型方程拟合曲线(图7)、发酵乳中活菌数(X)随时间变化的函数方程式(11)。

图7 未超声组副干酪乳杆菌生长实验值与模型方程拟合曲线
式(11)
式(11)模型参数:X0=6.745,Xmax=48.6,μm=0.297,R2=0.9900。从图8可以发现,式(11)拟合方程的曲线与实验数据能较好地吻合。
利用Matlab软件拟合获得超声组副干酪乳杆菌生长实验值与模型方程拟合曲线(图8)、发酵乳中活菌数(X)随时间变化的函数方程(式12)。

图8 超声组副干酪乳杆菌生长实验值与模型方程拟合曲线

式(12)
式(12)模型参数:X0=5.914,Xmax=55.503,μm=0.318,R2=0.9926。从图8可以发现,式(12)拟合方程的曲线与实验数据能较好地吻合,因此该方程较好地描述了超声组副干酪乳杆菌发酵制备多肽过程中菌体副干酪乳杆菌的生长规律,为优化控制提供了参考依据。
比较超声组和未超声组的动力学模型可以发现,超声组的最大活菌数高于未超声组,这与图4发酵乳中菌液浓度变化曲线的变化规律一致,超声组的最大比生长速率高于未超声组,由此可以解释随着发酵时间的延长,超声组发酵液中的活菌数逐渐高于未超声组的原因。
2.3 产物生成动力学模型参数求解及拟合曲线分析
从图5超声组和未超声组的多肽含量变化曲线可以发现超声组发酵液中的多肽生成量要高于未超声组。以式(8)为自定义函数,应用Matlab软件对未超声组和超声组发酵乳多肽浓度的实验值和模型方程分别进行非线性拟合。
利用Matlab软件拟合获得未超声组发酵乳多肽浓度实验值与模型方程拟合曲线(图9)、多肽浓度(P)随时间变化的函数方程(式13)和模型参数:P0=0.0301,α=0.01312,β=-0.0005245,R2=0.9658。

图9 未超声发酵乳多肽浓度实验值与模型方程拟合曲线
式(13)
利用Matlab软件拟合获得超声组发酵乳多肽浓度实验值与模型方程拟合曲线(图10)、多肽浓度(P)随时间变化的函数方程(式14)。

图10 超声发酵乳多肽生成动力学与模型方程拟合曲线
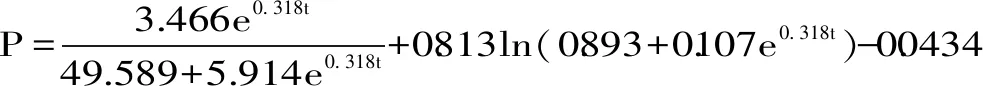
式(14)
式(14)模型参数:P0=0.0191,α=0.01056,β=-0.001047,R2=0.9658。从图10可知,式(14)拟合方程的曲线与试验所得数据在发酵24 h内能很好地拟合,较好地描述了超声发酵乳发酵过程中乳源多肽的生成情况。
β为负值,说明副干酪乳杆菌发酵产生的多肽随着菌体的生长,含量逐渐减少,分析其原因可能是由于副干酪乳杆菌分泌的蛋白酶将牛乳多肽进一步水解成游离氨基酸,导致多肽含量降低,比较超声发酵乳和未超声发酵乳的拟合方程可以发现,超声发酵乳的β值(即与菌体量相关联的产物合成常数)大于未超声组的β值,说明超声可以加快发酵过程中的物质代谢,使得发酵液中多肽含量增幅减缓,进一步导致游离氨基酸含量增多,最终产生的结果就是在发酵22 h以后,发酵乳的多肽含量趋于稳定甚至出现下降趋势,同时,这一结论与图3发酵液中游离氨基酸含量变化曲线也相对应。
2.4 底物消耗动力学模型参数求解及拟合曲线分析
从图6发酵过程中底物剩余蛋白质变化曲线可以发现未超声组的底物蛋白剩余含量高于超声组。以式(10)为自定义函数,应用Matlab软件对未超声组和超声组发酵乳底物蛋白消耗的实验值与模型方程分别进行非线性拟合。
利用Matlab软件拟合获得未超声组发酵乳底物蛋白消耗实验值与模型方程拟合曲线(图12)、底物蛋白消耗量(S)随时间变化的函数多肽浓度(P)随时间变化的函数方程式(15)和模型参数:S0=37.56,Yx/s=163.1,ms=-0.001451,R2=0.9778。

图11 未超声发酵乳底物蛋白消耗实验值与模型方程拟合曲线

式(15)
利用Matlab软件拟合获得超声组发酵乳底物蛋白消耗实验值与模型方程拟合曲线(图12)、底物蛋白消耗量(S)随时间变化的函数多肽浓度(P)随时间变化的函数方程式(16)和模型参数:S0=37.58,Yx/s=187.2,ms=-0.001908,R2=0.9836。
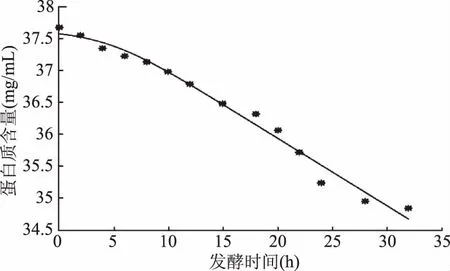
图12 超声发酵乳底物蛋白消耗实验值与模型方程拟合曲线

式(16)
从图12可知,式(15)拟合方程的曲线与试验所得数据能很好地拟合,与图6也相吻合,较好地描述了超声发酵乳中底物蛋白的消耗情况。
比较未超声和超声发酵乳底物蛋白的消耗情况可以发现,超声组和未超声组的初始底物蛋白剩余量基本是相同的,但随着发酵时间延长,超声发酵乳的底物剩余蛋白含量逐渐小于未超声组,同时,超声组底物用于菌体生长的得率常数Yx/s大于未超声组,说明超声可以加快发酵乳中牛乳蛋白的消耗,提高发酵效率,有利于发酵过程的进行。
2.5 发酵乳动力学模型分析
根据试验数据,通过Matlab软件模拟未超声组与超声组副干酪乳杆菌发酵制备多肽发酵乳的动力学模型参数值如表1所示。表1表明,两种发酵过程菌体生长均符合Logistic模型,其中超声组模型中的最大比生长速率Xmax比未超声组提高14.2%;两种发酵过程的产物生成均符合Luedeking和Piret提出的动力学模型,其中超声组模型中与菌体量相关联的产物合成常数β比未超声组提高99.62%;两种发酵过程的底物消耗均符合Luedeking-Piret模型,其中超声组模型中底物用于菌体生长的得率常数Yx/s比未超声组提高14.78%。

表1 动力学模型参数
3 结论
本文建立了超声波辅助发酵和无超声发酵过程的菌体生长、产物生成和底物消耗动力学模型,对比超声处理和未超声处理的发酵动力学模型,发现两种发酵过程均符合Logistic模型规律,且超声组最大比生长速率Xmax为55.5,未超声组最大比生长速率Xmax为48.6,超声组的最大比生长速率比未超声组提高14.2%;两种发酵过程的产物合成生成均符合Luedeking和Piret提出的动力学模型,且超声组产物合成常数β为-0.001047,未超声组产物合成常数β为-0.0005245,超声组产物合成常数比未超声组提高99.62%;两种发酵过程的底物消耗均符合Luedeking-Piret模型,且超声组模型中底物用于菌体生长的得率常数Yx/s为187.2,未超声组Yx/s为163.1,超声组的菌体生长得率常数比未超声组提高14.78%。因而在发酵乳的发酵过程中使用超声波处理可以加快发酵过程中的物质代谢,提高发酵效率,利于发酵过程的进行,在今后的研究中可利用本文的分析结果研究发酵过程中产物的生成和底物的消耗变化规律,同时可对副干酪乳杆菌发酵制备多肽发酵乳的发酵过程变化规律进行监控和预测。

