[Ni(H2O)4(phen)]SO4(C3H8N2O)材料的合成、热学和光谱性质
黄博文,许智煌,叶李旺,郑石贵,庄欣欣
(1.中国科学院福建物质结构研究所,福州 350002;2.中国科学院大学,北京 100049)
1 引 言
由于金属离子、配体、配位方式以及合成方法的不同,配合物的结构多种多样[1]。在进行配合物的合成时,研究人员根据中心离子的几何形状、溶剂的性质、配体的化学结构以及金属盐与有机配体的比例等因素合成具有不同化学组成和空间结构的配合物。镍作为一种经常出现的配位化合物中的元素,以其广泛的应用为人们所熟知[2],特别是硫酸镍盐材料在配合物的设计、组装、结构表征及性能研究上是当今十分热门的研究课题。近年来,人们利用Ni2+和一些有机配体合成新晶体结构,例如Michaelides等[3]曾用Ni2+与苯1,3,5三羧酸形成桥联制得配合物,Choi等[4]曾将Ni2+,吡唑作为原料制得配合物构建二维超分子网络结构。另外邻二氮菲(以下简称phen),一种双齿杂环化合物,也经常在研究中作为晶体材料中的辅助配体,构筑晶体结构,改善材料性能[5-7]。考虑到Ni与phen的配位以及脲类化合物在众多研究领域有着广泛的应用[8-10],使用水溶性较好的NiSO4·6H2O以及二甲基脲,探究合成一种含有phen配体的新材料。
在本文中,我们报道了一种新的配合物[Ni(H2O)4(phen)]SO4(C3H8N2O),通过X射线单晶衍射测定了它的结构并且得到晶胞参数,分子式为C15H24N4O9SNi。元素分析仪测定碳、氢、氮元素所占百分比;采用紫外可见近红外分光光度计、综合热分析仪等测试手段对该材料的光学性能和热学性能进行了分析。
2 实 验
2.1 试剂和仪器
所用的试剂为分析纯六水硫酸镍(NiSO4·6H2O),phen(C12H8N2)以及二甲基脲(C3H8N2O)。仪器:Miniflex600粉末衍射仪、vario MICRO元素分析仪、Vertex70红外光谱仪、STA449F3综合热分析仪、Lambda950紫外可见近红外分光光度计。
2.2 配合物的合成
NiSO4·6H2O与phen与二甲基脲按照摩尔比1∶1∶2的比例溶解在超纯水中,充分加热搅拌至完全溶解,得到成分为[Ni(H2O)4(phen)]SO4(C3H8N2O)的深蓝色溶液。化学方程式如下:
NiSO4·6H2O+phen+C3H8N2O→[Ni(H2O)4(phen)]SO4(C3H8N2O)+2H2O
(1)
将所得溶液放置于蒸发皿中,用聚丙烯膜封盖,在室温下缓慢蒸发,经过15 d生长出块状蓝色晶体,如图1。

图1 [Ni(H2O)4(phen)]SO4(C3H8N2O)晶体Fig.1 [Ni(H2O)4(phen)]SO4(C3H8N2O) crystal

图2 [Ni(H2O)4(phen)]SO4(C3H8N2O)晶体XRD图谱Fig.2 XRD patterns of [Ni(H2O)4(phen)]SO4(C3H8N2O) crystal
2.3 晶体的表征
本实验用配备有石墨单色化Mo-Kα辐射的UltraX-Saturn724 X射线衍射仪测量晶体的结构;玛瑙研磨钵将[Ni(H2O)4(phen)]SO4(C3H8N2O)晶体制成粉末,压片后在Miniflex600衍射仪上使用Cu-Kα辐射收集粉末X射线衍射数据,对比单晶衍射收集的数据模拟粉末衍射图与实际衍射图,如图2所示,实验衍射峰的位置与基于单晶的仿真模型衍射数据一致。
使用vario MICRO元素分析仪测定样品中碳、氢、氮元素所占百分比;Vertex70红外光谱仪测定光谱;STA449F3综合热分析仪以10 ℃/min的加热速率进行TGA和DTA测量;Lambda950紫外可见近红外分光光度计测定透射光谱。
3 结果与讨论
3.1 晶体结构
元素分析实际测量值C:36.25%,H:4.83%,N:11.63%,与分子式C15H24N4O9SNi理论值C:36.38%,H:4.85%,N:11.32%相当。经过结构解析得到配合物的分子结构见图3、有关晶体数据列于表1,R因子在误差允许的范围内。从晶体结构图3可知,配合物由中心镍离子、配位phen、4个配位水、硫酸根及二甲基脲基团所组成。配体phen以双齿螯合形式与镍配位[11]。关于晶体结构的分析有待于下一步讨论。
3.2 红外光谱
使用Vertex70红外光谱仪记录从4000 cm-1到500 cm-1的[Ni(H2O)4(phen)]SO4(C3H8N2O)的红外光谱,如图4。我们发现N-H伸缩振动的特征峰在3329 cm-1处。C=C伸缩振动与C=N伸缩振动产生1573 cm-1与1625 cm-1两个吸收峰,由于C-N伸缩振动,在1346 cm-1与1298 cm-1处产生两个峰,环状结构C-H面外弯曲振动出现619 cm-1、725 cm-1、871 cm-1三个尖峰[12-13]。

表1 配合物的晶体学数据Table 1 Crystallographic data of the complex
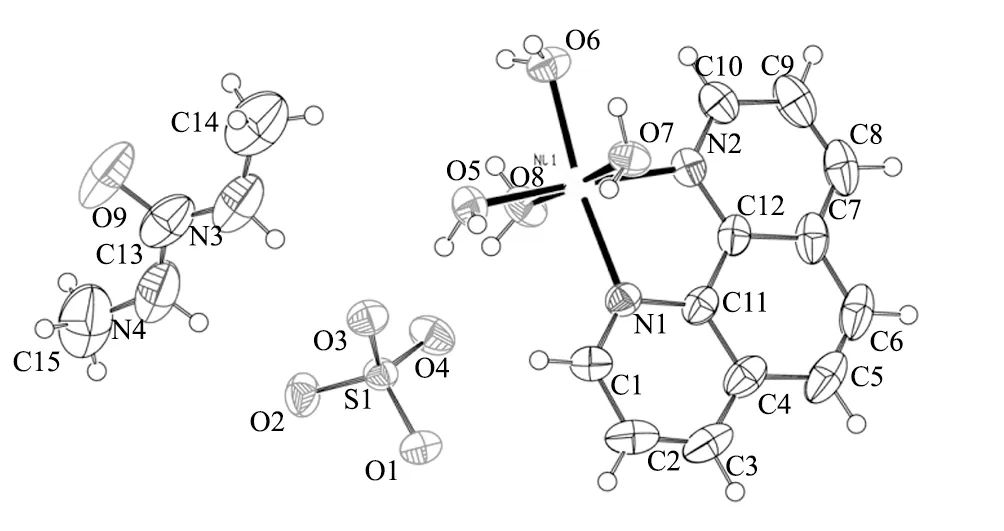
图3 [Ni(H2O)4(phen)]SO4(C3H8N2O)的分子结构Fig.3 Molecular structure of [Ni(H2O)4(phen)]SO4(C3H8N2O) crystal

图4 [Ni(H2O)4(phen)]SO4(C3H8N2O)的红外光谱图Fig.4 Infrared spectrum of [Ni(H2O)4(phen)]SO4(C3H8N2O) crystal

图5 [Ni(H2O)4(phen)]SO4(C3H8N2O)的TG与DTA图Fig.5 TG and DTA curves of [Ni(H2O)4(phen)]SO4(C3H8N2O) crystal

图6 [Ni(H2O)4(phen)]SO4(C3H8N2O)的透射光谱图Fig.6 Transmission spectrum of [Ni(H2O)4(phen)]SO4(C3H8N2O) crystal
3.3 热重分析
用STA449F3综合热分析仪使待测样品在N2作为保护气条件下以10 ℃/min的升温速率从30 ℃加热到1000 ℃[14-15],测试[Ni(H2O)4(phen)]SO4(C3H8N2O)的热稳定性,得到TG和DTA曲线,如图5。实验结果表明,当温度升高到75 ℃时晶体开始分解,失去配位水;当接近150 ℃左右二甲基脲分解;升温至500 ℃附近时晶体材料中的phen配体分解,最终质量稳定在原来的14.4%,产物为NiO。
3.4 配合物的光学特性

4 结 论


