听觉研究中NKCC1与Na+-K+-ATPase 在耳蜗K+循环中的作用研究
钱 迪 郑伟昌 陈翠霞 敬光怀 汤国栋 黄俊煊
(深圳市龙华区人民医院耳鼻咽喉科,广东 深圳 518109)
耳聋是临床常见的听力损伤类型,近年来随着临床医学对该病病理机制研究的不断深入,诸多文献研究报道从遗传、环境、病理及药物等因素探讨了其发病机制。据最新的研究报道显示,血管纹是转运K+进入耳蜗内淋巴致高钾环境形成,并促使耳蜗内电位(EP)产生的主要部位[1];而相关动物实验研究显示,在大鼠耳蜗中钠钾氯协同转运蛋白1(NKCC1)、Na+-K+-ATP酶(Na+-K+-ATPase) 主要于血管纹边缘细胞基础膜侧分布,在维持内耳听力中发挥了重要的参与作用机制[2]。且NKCC1及Na+-K+-ATPase 离子转运体活动建立起的耳蜗K+循环是EP产生的重要条件。C57BL/6J小鼠是已经证实的具有典型特征的听力损伤动物模型,本研究主要分析NKCC1与Na+-K+-ATPase 在耳蜗K+循环及中的作用,现报道如下。
1 材料与方法
1.1 动物材料:选择由动物中心提供的36只健康C57BL/6J小鼠为研究对象,小鼠经近交自行繁殖培育,可保持长时间稳定的听力,均系小鼠12周龄,体质量12~18 g,平均(15.32±4.26)g。所有试验小鼠均放置低噪声环境下进行普通饲养。
1.2 方法:①听觉脑干反应(ABR)检测。取实验鼠12只,予以三溴乙醇腹腔注射麻醉,用量0.53 mg/g;采用银针电极,于头顶正中皮下插入正极,于左耳皮下插入参考电极,于右耳皮下插入地极电极,ABR检测仪器采用美国产ABR仪,刺激参数设置由电脑产生设定的短声、短纯音的8、16、32 kHz为刺激声。实验中以能分辨出ABR I波的最低刺激强度作为ABR阀值,ABR检测3次,取平均值,作正常对照组[3]。②NKCC1抑制剂实验及恢复实验。取实验鼠12只,予以腹腔内注射麻醉后,给予NKCC1抑制剂呋塞米注射,注射30 min后再予以ABR检测,作为呋塞米实验组。12只小鼠停药3 d,后再次行ABR检测,作为呋塞米恢复组。③Na+-K+-ATPase抑制剂实验。取实验鼠12只,予以腹腔内注射麻醉后,给予Na+-K+-ATPase抑制剂哇巴因注射,1次/天,连续注射5 d。第5天注射30 min后再予以ABR检测,作为哇巴因实验组。12只小鼠停药3 d,后再次行ABR检测,作为哇巴因恢复组。
1.3 观察指标:通过1.2检测结果,对比分析对照组、呋塞米实验组、呋塞米恢复组、哇巴因实验组、哇巴因恢复组小鼠ABR阀值。
1.4 统计学方法:统计学软件版本号为SPSS20.0,用(±s)的形式对计量检测数据进行表示,数据之间的比较用t对其进行检验,P<0.05提示数据之间的差异有统计学意义。
2 结 果
2.1 对照组与实验组小鼠ABR阀值比较:从表1可以看出,在平均ABR阀值指标值上,给药前,对照组、呋塞米实验组、哇巴因实验组比较,差异均无统计学意义(P>0.05);给药后,呋塞米实验组、哇巴因实验组平均ABR阀值均高于给药前(P<0.05),与正常对照组接近。
表1 对照组与实验组小鼠ABR阀值比较(±s)
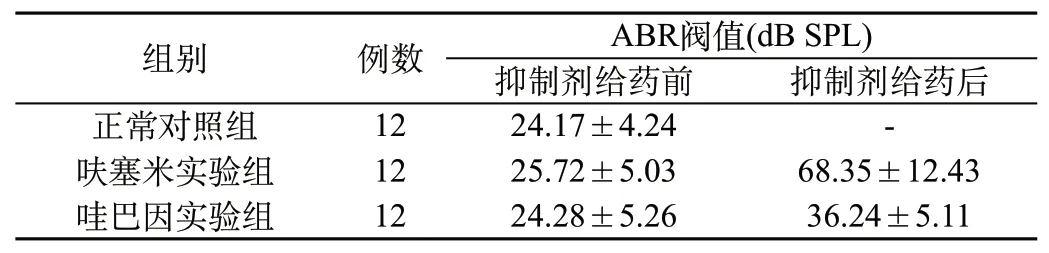
表1 对照组与实验组小鼠ABR阀值比较(±s)
?
2.2 实验组小鼠给药前后ABR阀值比较:从表2可以看出,停止给药恢复后,呋塞米实验组、哇巴因实验组平均ABR阀值均低于给药后(P<0.05),与给药前接近。
表2 实验组小鼠给药前后ABR阀值比较(±s)
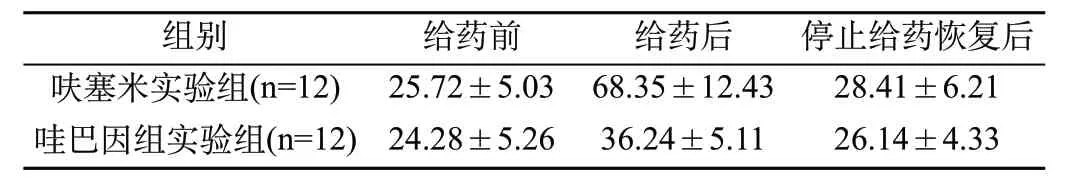
表2 实验组小鼠给药前后ABR阀值比较(±s)
?
3 讨 论
本研究主要研究听觉实验中NKCC1与Na+-K+-ATPase 在耳蜗K+循环中的作用,其中NKCC1是参与耳蜗K+循环生理机制,对听觉生理功能进行维护的重要功能通道[4];Na+-K+-ATPase会引发细胞内外的Na+浓度差,当Na+经该浓度差于细胞进入时,可经本体蛋白质运载体以共同运输的方式将通过细胞膜不易的物质带进细胞。如前文所述,血管纹是转运K+进入耳蜗内淋巴致高钾环境形成,并促使耳蜗内电位(EP)产生的主要部位,而在血管纹边缘细胞底侧膜的NKCC1与Na+-K+-ATPase在耳蜗K+循环中则发挥着重要的作用机制[5]。其中Na+-K+-ATPase通过3 Na+的泵出,以交换2K+转运至边缘细胞,促使Na+浓度梯度的形成;NKCC1则可通过对内向性Na+浓度梯度的利用以1 Na+:1K+:2Cl-的比例将离子转运至边缘细胞。而经边缘细胞顶膜上的KCNQ1通道将K+分泌至淋巴,进而形成EP,对听觉功能进行维持[6]。与此同时,分泌至耳蜗内淋巴中的K+经基底膜毛细胞与螺旋韧带间的通道进行转运,再次进入边缘细胞,以此循环,构成耳蜗K+循环机制。因此,血管纹边缘细胞底侧膜的NKCC1与Na+-K+-ATPase对K+的转运具有限制与促进作用[7]。
本研究通过构建动物听觉试验,以健康C57BL/6J小鼠为研究对象,分别设置正常对照组,NKCC1抑制剂呋塞米实验组、恢复组,Na+-K+-ATPase抑制剂哇巴因实验组、恢复组。结果显示:①在平均ABR阀值指标值上,给药后,呋塞米实验组、哇巴因实验组平均ABR阀值均高于给药前(P<0.05),与正常对照组接近。即通过对NKCC1与Na+-K+-ATPase活性的抑制,小鼠ABR阀值显著升高。②停止给药恢复后,呋塞米实验组、哇巴因实验组平均ABR阀值均低于给药后(P<0.05),又与给药前接近。提示,通过对NKCC1与Na+-K+-ATPase活性的恢复,小鼠ABR阀值显著降低,且接近正常。上述两项研究结果证实NKCC1与Na+-K+-ATPase作为离子转运蛋白,其活性与小鼠听觉功能密切相关。当小鼠被注入NKCC1抑制剂呋塞米后,耳蜗血管纹边缘细胞底侧膜上分布的NKCC1活性被阻断,其在耳蜗K+循环中所发挥的作用降低,对K+由边缘细胞转运至淋巴,再由淋巴转运至边缘细胞的循环路径进行阻断,致高钾环境破坏,EP建立受阻,从而导致听觉功能障碍,ABR阀值升高[8]。同时,当小鼠被注入Na+-K+-ATPase抑制剂哇巴因后,耳蜗侧壁螺旋韧带纤维细胞膜上分布的Na+-K+-ATPase活性被阻断,其在耳蜗K+循环中所发挥的作用降低,K+不能泵入,进入边缘细胞受阻,造成进入淋巴的K+大量减少,EP建立受抑制,同样引发听觉功能障碍,ABR阀值升高。另一方面,据相关研究报道证实,NKCC1与Na+-K+-ATPase活性与耳蜗神经变性密切相关。即NKCC1与Na+-K+-ATPase活性的降低,损伤耳蜗微血管内皮细胞功能,使血管基底膜厚度增加,造成微血管供应区神经缺氧、缺血、神经脱髓鞘及髓鞘空泡样改变,这是诱发耳蜗和耳蜗神经变性的重要因素,不仅可造成听觉功能受损,同时也是引起耳聋的主要原因。综上,NKCC1与Na+-K+-ATPase作为离子转运蛋白,其开展的离子转运体活动是建立耳蜗K+循环,产生EP及维持听觉功能的重要因子。

