澳洲茄边碱诱导食管癌细胞KYSE150凋亡及其机制研究
巫雪茹,郑世勤,严展鹏,陈 双,张 雯,缪 林,张秀华
作者单位:210011南京,南京医科大学第二附属医院消化医学中心[巫雪茹(医学硕士研究生)、郑世勤、陈 双、张 雯、缪 林、张秀华];210028南京,江苏省中西医结合医院中西医结合临床实验室(严展鹏)
0 引 言
食管癌是全球第九大常见癌症,也是全球癌症死亡的第六大常见原因[1]。中国作为食管癌发生率最高的地区之一,约90%的食管癌病理证实是鳞癌[2]。食管早癌目前以内镜手术治疗为主,中晚期食管癌多以外科手术辅以放化疗。中医药治疗是我国肿瘤治疗领域的一大特色,且有改善患者预后,减轻并发症等功效[3]。中草药龙葵在我国广泛分布,具有活血消肿、解热镇痛、抗炎、抗肿瘤的作用。而澳洲茄边碱(solamargine,SM)作为一种天然甾体生物碱,是龙葵中的主要抗癌活性成分[4]。研究表明SM对肝癌、前列腺癌、肺癌等肿瘤有诱导凋亡,抑制生长的作用[5-7]。食管鳞状细胞癌细胞中存在活化的NF-κB信号通路,且中草药可通过抑制NF-κB通路诱导细胞凋亡[8],但SM是否能诱导食管癌细胞凋亡及相关机制尚无人阐述。在这项研究中,我们观察SM对食管癌细胞增殖及凋亡的影响并探讨其可能的作用机制。
1 材料与方法
1.1 实验材料 人食管癌鳞癌细胞株KYSE150,购于中国科学院典型培养保藏委员会细胞库(中国上海)。SM(纯度≥98%)购于中国中医药研究所,溶于DMSO溶液中。RPMI1640培养基、胰酶及胎牛血清购于美国GIBCO公司。MTT购于美国Fluka公司。抗体Bax、Bcl-2、Caspase3、Cleaved caspase3、核因子κB(Nuclear factor kappa-B,NF-κB)、磷酸化 NF-κB(Phospho-NF-κB,p-NF-κB)、IκB激酶α(IκB Kinase α,IKKα)、IκB激酶β(IκB Kinase β,IKKβ)、IkBα和p-IkBα)均购于Cell Signal Technology公司。Annexin V-FITC/PI Apoptosis Detection Kits购于美国BD公司。
1.2 实验方法
1.2.1 细胞培养及分组 KYSE150细胞生长于含10%胎牛血清、100 μg/mL链霉素、100 U/mL青霉素的RPMI1640培养基内,在含5%CO2、37℃恒温培养箱中培养,传代按1∶5的比例进行。实验均取对数生长期细胞进行。以SM(0 μmol/L)为对照组,SM(2、4、6、8 μmol/L)为实验组。
1.2.2 MTT法检测细胞活力 取对数生长期细胞的KYSE150细胞,按5×104个/mL的密度接种于96孔板,每孔100 μL,待细胞贴壁生长至每孔面积的60%~70%时,弃去培养液,设置对照组及实验组。其中实验组中加入不同浓度 SM(0、2、4、6、8、10 μmol/L),每个浓度设6个平行复孔,继续培养24 h后,每孔加入10 μL MTT溶液(5.0 mg/mL),37℃孵育4 h,吸去上清,每孔加入100 μL DMSO,平板振荡器振荡10 min,用酶标检测仪测定570 nm处的吸光光度值(A570nm)。实验重复3次。
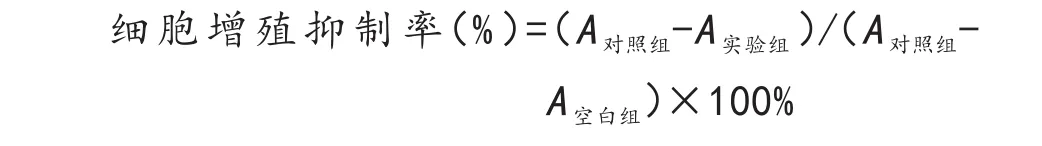
1.2.3 Annexin V-FITC/PI双染法检测细胞凋亡取对数生长期KYSE150细胞以3×105个/孔的密度接种于6孔板,贴壁生长至60%~70%时,加入不同浓度的SM(0、2、4、6、8 μmol/L),作用24 h后离心收集细胞,预冷PBS洗涤2次后加入100 μL结合缓冲液重新悬浮于细胞流式管中,再加入5 μL Annexin V-FITC混匀后加入5 μL PI溶液,混匀后室温避光孵育15 min,在反应管中加入400 μL结合缓冲液,混匀后使用流式细胞仪检测细胞凋亡情况。
1.2.4 Western blot检测相关蛋白的表达 取对数生长期细胞接种于培养皿(55 cm2)中,贴壁生长至60%~70%时,加入不同浓度的SM,作用24 h后,4℃PBS洗涤2次,冰上加入400 μL含蛋白酶抑制剂及磷酸化酶抑制剂的RIPA裂解液,冰上裂解15 min,收集蛋白,BCA法测定蛋白浓度,按等量蛋白上样,经SDS-PAGE电泳(5%浓缩胶,10%及12%分离胶)。电泳结束后转膜,5%脱脂牛奶室温封闭1h,加入一抗4℃孵育过夜。TBST洗膜3次,加入荧光二抗室温避光孵育1 h,TBST洗膜3次,红外荧光成像仪扫膜。
1.3 统计学分析 应用SPSS 20.0软件进行统计分析,定量资料以均数±标准差(xˉ± s)表示,采用one way ANOVA进行组间比较,以P≤0.05为差异有统计学意义。
2 结 果
2.1 SM对食管癌细胞株KYSE150的形态学影响 在光镜下,对照组细胞形态正常,细胞核完整,而2、4、6、8 μmol/L SM组随着SM浓度增加,细胞贴壁能力下降,细胞数目减少且细胞核出现皱缩,细胞轮廓不规则。见图1。
2.2 SM剂量依赖性抑制人食管癌细胞株KYSE150的细胞增殖 SM对食管癌细胞的抑制作用基本呈现与浓度呈正比,即与对照组相比,2、4、6、8 μmol/L SM组细胞增殖抑制率随着药物浓度的增加而逐渐升高(P<0.01)。见表1。
2.3 SM剂量依赖性诱导KYSE150细胞凋亡 随着药物浓度的增加,细胞的早期凋亡率及总凋亡率均升高,且4、6、8 μmol/L SM组的总凋亡率与对照组相比,差异具有统计学意义(P<0.05)。见图2,表1。

图1 不同浓度澳洲茄边碱对人食管癌KYSE150的细胞形态的影响(×200)Figure 1 Morphology of the human esophageal cancer KYSE150 cells in the blank control and solamargine-treated groups(×200)

图2 流式细胞仪检测不同浓度SM对KYSE150细胞凋亡的影响Figure2 Apoptosis of the human esophageal cancer KYSE150 cells in the blank control and solamargine-treated groups by flow cytometry
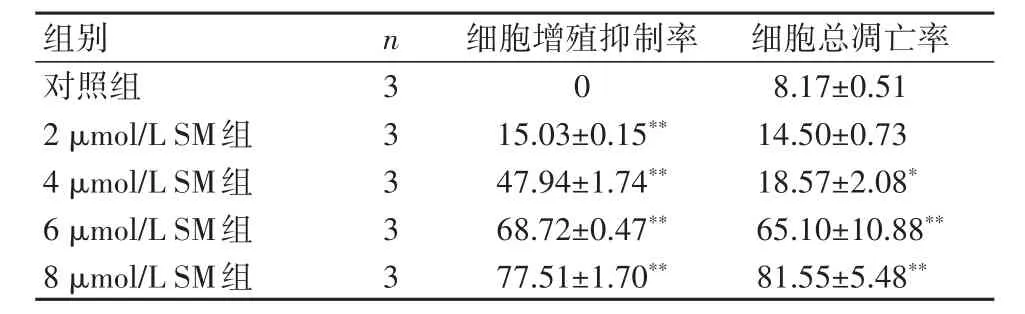
表1 各组食管癌KYSE150细胞增殖抑制率和细胞总凋亡率比较(xˉ±s,%)Table 1 Proliferation-inhibition and total apoptosis rates of the human esophageal cancer KYSE150 cells in the blank control and solamargine(SM)-treated groups(xˉ±s,%)
2.4 SM对KYSE150细胞中细胞凋亡相关蛋白及NF-κB经典通路蛋白的影响 使用Western blot法检测细胞凋亡及NF-κB经典通路相关蛋白表达情况,结果显示不同浓度(0、2、4、6、8 μmol/L)的SM作用于KYSE150细胞24 h后,Bax、Caspase3及Cleaved-caspase3蛋白的表达量随着药物浓度的增加而逐渐增加,而Bcl-2、IKKα、IKKβ、p-IkBα蛋白的表达量随着药物浓度的增加而逐渐减弱,并且SM(4、6、8 μmol/L)组与对照组相比,差异具有统计学意义(P<0.05)。与对照组的NF-κB、P-NF-κB、IkBα相比,SM(6、8 μmol/L)组对应的蛋白表达量差异具有统计学意义(P<0.05)。如图3、图4。
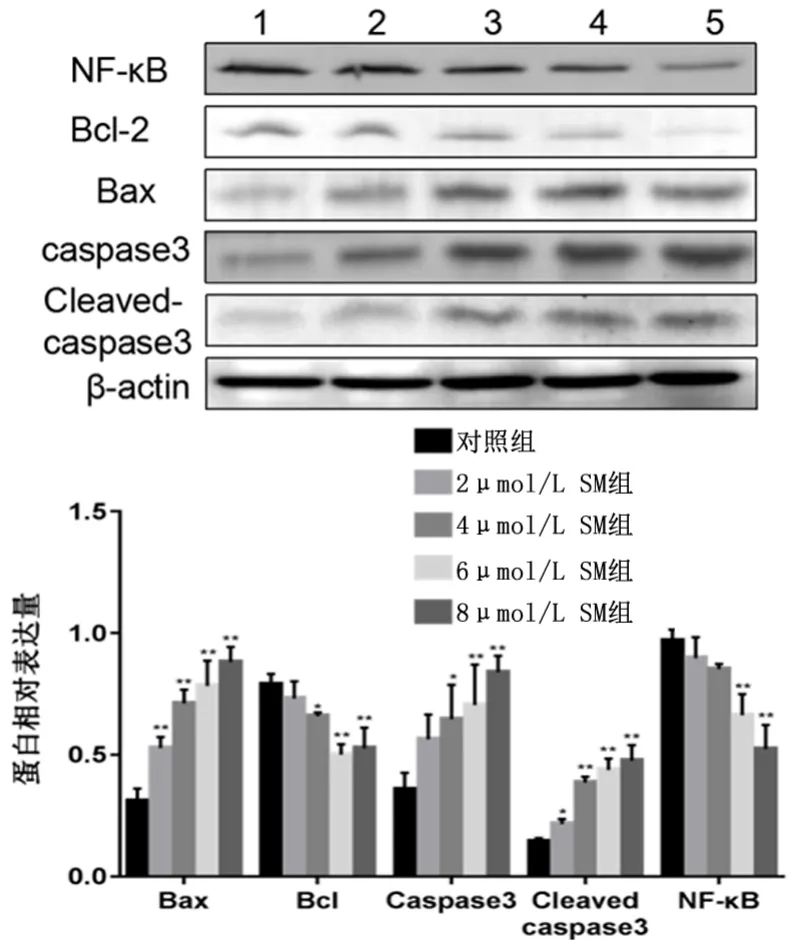
图3 Western blot检测NF-κB经典通路蛋白的表达水平及半定量分析Figure 3 Expression of the classical NF-κB signaling pathway-related proteins in the human esophageal cancer KYSE150 cells in the blank control and solamargine-treated groups

图4 Western blot检测凋亡相关蛋白的表达水平及半定量分析Figure 4 Expression of apoptosis-related proteins in the human esophageal cancer KYSE150 cells in the blank control and solamargine-treated groups
3 讨 论
药物治疗是肿瘤治疗的重要方法之一,而中药是目前肿瘤治疗方法研究的活跃领域。最近临床证据认为中医药治疗食管癌的短期效果尚不明确,但其可改善放化疗患者的生活质量,减少放化疗的不良反应[9]。药用龙葵为茄科植物龙葵的干燥全草。龙葵的甾体类生物碱的主要成分为SM和澳洲茄碱,它们水解后生成的澳洲茄胺,具有抗肿瘤活性,是一种具有良好药用前景的治疗肿瘤天然药物。SM作为龙葵总碱的主要成分,能引起肿瘤细胞凋亡或协同其他化疗药物达到抑制肿瘤细胞生长的作用。研究证明,SM可通过PGE2/EP4及其下游DNMT1/c-Jun调控肺癌细胞生长[10],在前列腺癌中还可通过激活MAPK信号通路调节下游MUC1的表达发挥抑癌作用[11]。不仅如此,PI3K/AKT,JAK-STAT,VEGF/VEGFR 及基质金属蛋白酶等多种途径都被发现在SM抑制肿瘤细胞的生长中起着重要作用[7,12-13]。但尚未有报道提及SM对食管癌细胞生长的作用,以及NF-κB经典通路在其中扮演的角色。故我们针对此方面进行了进一步的研究。
自我凋亡程序异常是肿瘤发生的重要特征之一。细胞凋亡受各种分子(如Bcl-2家族蛋白)调节,尤其是通过抗凋亡蛋白(如Bcl-2)及促凋亡蛋白(如Bax)调节。Bax表达上调,Bcl-2表达下调或Bax/Bcl-2比值增大,会促进细胞凋亡,抑制肿瘤发生。Caspase家族是细胞凋亡通路中最重要的调控因子。其中Caspase3是Caspase级联反应中最重要的凋亡执行因子,是细胞凋亡内外源性途径中共同的终末效应酶。Caspase3在细胞质中以酶原形式存在,不具有生物学功能,当被上游启动因子激活后裂解为活性小体(Cleaved caspase3),才可重新结合相关蛋白酶发挥凋亡作用[14]。我们在实验中检测了凋亡相关蛋白的表达,结果发现,随着药物浓度的增加,SM下调Bcl-2表达,上调Bax表达,并上调蛋白水解酶Caspase3及其活性形式Cleaved caspase3的表达。这提示我们SM可通过下调抗凋亡蛋白Bcl-2,上调促凋亡蛋白Bax来引起食管癌细胞KYSE150凋亡,并且这种效应呈剂量依赖性。
众多研究证明,NF-κB信号通路在消化道肿瘤中广泛活化,如食管癌、胃癌、结直肠癌、胰腺癌、肝癌等[15-20]。NF-κB信号通路分为经典通路和非经典通路。在经典通路中,IκBα作为NF-κB抑制因子IκB家族中的一员,与NF-κB相结合,使其处于无活性形式。NF-κB 活化涉及IκB激酶(IκB kinase,IKK)复合物的激活,IKK复合物由两种丝氨酸-苏氨酸激酶(IKKα和IKKβ)和调节亚基NEMO(也称为IKKγ)组成,整合来自所有NF-κB活化刺激的信号。当细胞受到刺激时,IKK激活后可导致IκB磷酸化而降解,活化的NF-κB得以进入胞核参与转录[21]。活化的NF-κB信号通路对肿瘤生长、转化、浸润及转移等有重要作用,因此抑制该通路可能有助于延缓肿瘤细胞的恶性进展。本研究使用Western blot法检测SM作用于食管癌KYSE150细胞24 h后,细胞中NF-κB经典通路相关蛋白的表达并进行半定量分析。结果发现细胞中IκBα及其激酶IKKα和IKKβ的水平随SM浓度的增加而降低,且p-IκBα水平的降低直接影响NF-κB的活化,与p-NF-κB水平的降低变化一致。这提示我们SM可以通过抑制IκBα激酶的活性来抑制IκBα磷酸化,使NF-κB难以解离,故而不能进入胞核参与转录。因此,SM可以抑制NF-κB经典信号通路的活化并且对食管癌细胞KYSE150的增殖及凋亡产生影响。
综上所述,我们的研究结果表明,SM可有效抑制KYSE150细胞增殖,诱导细胞发生凋亡,且该作用与NF-κB经典信号通路被抑制有关,SM有望作为NF-κB通路抑制剂为以后的肿瘤临床治疗提供另一种方法。

