水浴条件下乙酸乙酯制备实验的改进
鲍文亮 林美凤 刘丽君

摘要: 针对沪科版高中化学教材中水浴方式加热制取乙酸乙酯的实验所需时间较长,并且收集装置中分层现象并不明显的问题,从理论上分析浓硫酸在酯化反应中的作用,并设计实验证明酯化反应中氢离子的催化作用。通过改变硫酸浓度,调整浓硫酸用量以及对水浴加热装置的进一步优化,得出一种操作简便、能够在较短时间内有明显实验现象的方法,可供课堂演示实验作参考。
关键词: 乙酸乙酯制备; 水浴加热; 氢离子催化作用; 实验改进
文章编号: 10056629(2019)10006403中图分类号: G633.8文献标识码: B
1 问题的来源和提出
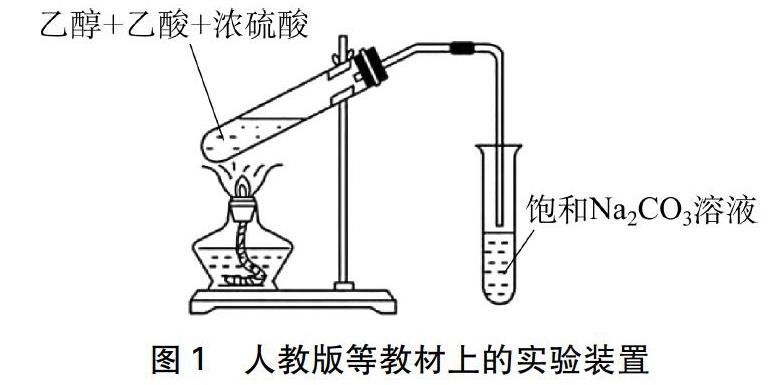
乙酸与乙醇的酯化反应实验是中学化学重要的有机实验。人教版、苏教版、鲁科版教材中有关乙酸乙酯的制取实验内容为: 在试管里加入3mL乙醇,然后一边摇动,一边慢慢地加入2mL浓硫酸和2mL冰醋酸,用酒精灯慢慢加热,将产生的蒸气经导管通到饱和碳酸钠溶液的液面上(如图1所示)。
该方法操作虽简便,制得乙酸乙酯所需的时间也较短,但是试管内溶液的颜色不断加深,最终变为棕褐色,而且直接加热副反应很多,可能生成乙醚、乙烯、二氧化碳、二氧化硫等杂质。由于直接加热,反应速率过快,难以控制。
而沪科版化学教材高二年级第二学期12.2节中有关乙酸乙酯制取的实验在药品及用量均不变的情况下,选择了水浴加热的方式(如图2所示)。
尽管水浴加热避免了溶液炭化以及副反应过多的问题,但在实际实验过程中,实验耗时过多,一般要10min左右才会出现少许乙酸乙酯,并且试管内的分层现象也不明显。故教师一般还是会采用直接加热的方式来进行该实验。
已知乙酸与乙醇的酯化反应所需温度在80℃左右,理论上在水浴的条件下,是可以生成大量乙酸乙酯的,为什么实际上却几乎很难在较短时间内看到明显的分层现象?应该采用怎样的实验方案可以在水浴条件下,在收集试管中较快地出现明显的分层现象?
2 酯化反应中浓硫酸的作用
酯化反应一般认为经过加成、消去的历程。质子活化的羰基被亲核的醇进攻发生加成,在酸作用下脱水成酯,该反应为可逆反应[1]。具体原理如图3[2]所示:
酯化反应速率很慢且反应可逆,需要酸催化加快反应速率,而提高酯的产率的措施则是增加反应物的浓度或除去反应生成的水,即随时把水除去,使得平衡不断向生成酯的方向移动,以提高产率。浓硫酸可做该反应的催化剂和吸水剂,能促使平衡向生成酯的方向移动。尽管浓硫酸能提高反应物的转化率,但由于以分子形态为主,氢离子浓度较小,反应速率很慢,这是水浴加热时乙酸乙酯在短时间内产量较低的主要原因。
3 浓硫酸的浓度对酯化反应影响的探究
3.1 实验仪器
酒精灯、恒温水槽、大试管、量筒、长导管、胶头滴管、单孔橡皮塞、铁架台
3.2 实验药品
98%浓硫酸、无水乙醇、冰醋酸、蒸馏水、饱和碳酸钠溶液、浓盐酸、饱和硫酸钠溶液
3.3 实验过程和数据
该实验中浓硫酸与水的体积比例共分七组,各反应试管中均加入乙醇2mL和乙酸2mL,水浴采用恒温槽(98℃左右),反应时间设置为5分钟,七组实验在同一个恒温水槽中进行。实验结果见表1。
3.4 实验讨论
(1) 按照该实验反应药品的体积配比,直接使用浓硫酸在水浴条件下进行酯化反应实际上几
乎观察不到实验现象,在课堂演示实验效果很差,这也是为什么在演示实验中教师大都愿意选择直接加热进行酯化反应的原因。
(2) 浓硫酸与水的体积比为2∶3时,产生乙酸乙酯的量最多,在1分钟左右即很快开始产生乙酸乙酯,3分钟左右收集试管内油层液面高度1.40cm。由于是在水浴中进行该实验,温度稳定在98℃左右,整个反应过程中没有炭化现象,溶液始终为无色,副反应也很少。
(3) 当硫酸浓度很稀之后,出现分层现象的时间较晚,且分层现象逐渐不明显。
4 浓硫酸在酯化反应中实际作用的分析
当硫酸浓度很大时,此时几乎没有酯化现象。随着浓硫酸浓度的降低,浓硫酸逐渐电离出大量的氢离子,氢离子浓度的增大,使有机物分子中的羰基氧或羟基氧质子化,为反应提供了一个酸性活化中心,从而推动酯化反应的进程。而当硫酸浓度再进一步降低之后,体积的稀释作用大于硫酸的电离作用,氢离子浓度减少导致酯化反应的进程缓慢。
综上所述,在乙酸乙酯制取实验中起催化作用的是氢离子。当然浓硫酸在该实验中还是存在一定的吸水作用,使酯化反应正向移动,产生相对更多的乙酸乙酯。不过因为乙酸乙酯的沸点(77℃)在各反应试剂中最低,实验时将乙酸乙酯蒸出也同样能促使乙酸与乙醇反应正向进行,可见反应中浓硫酸的吸水作用相对催化作用并非很重要[3]。
为了证实氢离子在酯化反应中起催化剂作用,设计先用饱和硫酸钠溶液代替浓硫酸,实验结果是未生成任何油状酯类物质,因此排除硫酸根离子对酯化反应的影响;再用浓盐酸做酯化反应催化剂,进一步证实氢离子在酯化反应中的作用。实验结果见表2。
相对来说,用浓盐酸作催化剂,尽管同样生成了乙酸乙酯,但是相比之前的浓硫酸与水的体积比2∶3,开始出现酯的时间需要更长,最终酯的体积也少。笔者认为,一方面是两者的氢离子浓度不完全相同,另一方面浓盐酸具有易挥发的特点,也使得用浓盐酸做催化剂酯化效果并不很理想。
5 水浴条件下酯化反应最佳条件的探究
在实验中将教材中所用的2mL的浓硫酸改为2滴浓硫酸,却发现,实验开始不到1分钟就产生了乙酸乙酯,且酯层高度1.6cm。不仅节约了药品,还较快出现明显的实验现象。其原因可能是,如果浓硫酸用量过多,尽管酯化反应会生成少量的水,但硫酸浓度变化不大,硫酸主要以分子状态存在,氢离子浓度仍然较小;但当浓硫酸用量较少时,则反应生成的水稀释浓硫酸后,硫酸电离氢离子的能力增强,氢离子起到了催化的作用,从而加快了反应速率。
从实际教学效果出发,恒温水槽是整个实验的关键,但是作为演示实验,拿到教室进行操作并不方便。所以尝试在烧杯中倒入沸水,将反应试管放入该沸水浴中,重复上述实验,希望能尽量简化该实验,但结果几乎没有任何分层现象。其原因可能是烧杯中的热水无法持续保持在较高温度,很容易因为环境温度较低而迅速降温,即使生成大量乙酸乙酯,也无法保证能够全部在试管中收集。若用酒精灯进行水浴加热,装置不免有些复杂。故笔者想到用生活中的保温杯作为“恒温水槽”(里面的水最好是刚烧开的沸水),药品及用量分别为无水乙醇2mL、乙酸2mL、浓硫酸2滴。结果发现,1分钟左右就出现了乙酸乙酯,2~3分钟酯层高度已达1cm左右,现象非常明显,仪器和实验操作也相对简单。为课堂演示实验找到了一个既好又快的简易方法,节省了课堂中的宝贵时间。
本实验的研究过程中还发现,最终乙酸乙酯收集体积的多少除了与浓硫酸的体积、硫酸的浓度有关,实际上还与试管上部的冷凝导管长度、恒温水槽的温度、乙醇与乙酸的体积比都存在一定的关系,只是影响的权重不尽相同,例如: 当实验反应温度高于90℃时,影响制取乙酸乙酯产量的因素的排序为: 浓硫酸的体积(浓度)>试管上部冷凝导管的长度>乙醇与乙酸的体积比>反应温度[4]。建议可以根据自己实验的具体情况合理改变实验的条件,得到满意的实验现象和效果。
参考文献:
[1]王海勋, 薛德兴. 乙酸乙酯制备中催化剂的探讨[J]. 化学教學, 2009, (10): 20~21.
[2]朱志荣. 乙酸乙酯制备演示实验的改进[J]. 化学教学, 2015, (2): 59~62.
[3]惠大超. 乙酸乙酯制备实验的教学优化探索[J]. 化学教学, 2014, (12): 68~69.
[4]孔令琦, 丁伟. 正交试验优选实验室制备乙酸乙酯的方法[J]. 化学教学, 2014, (4): 51~53.

