低温等离子体诱变耐高温氧化亚铁硫杆菌的试验研究
李先艳 李茹 张晴 桑田

摘 要: 为培育出耐高温的氧化亚铁硫杆菌(Thiobacillus ferrooxidans,简称T.f菌),通过低温等离子体诱变试验探讨T.f菌高温诱变的可行性,研究结果表明:低温等离子诱变过后的T.f菌经PCR鉴定确认为氧化亚铁硫杆;T.f菌生长规律符合在有限环境容量下微生物的“S”型生长曲线;低温等离子的诱变可以提高T.f菌对高温的耐受性,但诱变功率60、70 W的诱变效果无明显差异;T.f菌活性均随温度的升高而减小,诱变过后的菌株也无法逆转这一生长规律;35、38、42 ℃三个诱变温度相比较,38 ℃诱变效果最好,诱变组Fe2+氧化率比对照组高13%。
关 键 词:氧化亚铁硫杆;低温等离子体;邻啡罗啉比色法
中图分类号:Q691.5 文献标识码: A 文章编号: 1671-0460(2019)04-0712-04
Abstract: To cultivate high temperature resistant thiobacillus ferrooxidans (T.f.),the feasibility of high temperature mutagenesis of T.f strain was investigated by low temperature plasma mutagenesis test. Experimental results showed that strains after low temperature plasma mutagenesis were confirmed as T.f by PCR identification.The oxidation rate of Fe2+ was proportional to the activity of T.f and its growth activity changed with "S" type over time.Therefore, the growth pattern of T.f was consistent with the "S" growth curve of microorganisms under limited environmental capacity. Although low temperature plasma mutagenesis produced high temperature resistant T.f strain, there was no significant difference in the mutagenic effects of 60 and 70 W.The activity of T.f bacteria decreased with increasing temperature,and Mutagenesis did not reverse this growth law. Among three mutagenic temperatures of 35, 38 and 42 ℃,the mutagenic effect at 38℃ was the best, Fe2+ oxidation rate of the mutagenized group was 13% higher than the control group at 38 ℃.
Key words: Thiobacillus ferrooxidans; Low temperature plasma; Phenanthroline colorimetry
氧化亞铁硫杆菌(Thiobacillus ferrooxidans,简称T.f菌)是一种嗜酸性专性好氧化能自养菌,适宜在温度30 ℃左右、pH值为2~2.5的环境中生长,能够通过氧化S2-、S0及Fe2+的化合物等来获得生长所需要的能量[1,2]。一直以来T.f菌在生物冶金和生物处理污泥中的重金属方面应用广泛,并已取得一定进展,近期的一个热门研究方向是利用T.f菌的脱硫性能进行烟道脱硫,但目前尚在实验室研究阶段,并未能实现工业化应用。其中如何使T.f菌在烟道的高温环境下正常工作是一个技术难点,高温条件下T.f菌的生物活性会大大降低,生长速度缓慢[3],甚至直接死亡。本实验通过低温等离子体诱变技术(这种诱变技术通过中性活性粒子来改变微生物遗传特性,可直接改变核苷酸水平的分子结构也可通过作用于细胞而间接影响胞内遗传物质,故诱变所得突变株具有良好的遗传稳定性)对T.f菌进行诱变,通过实时监测诱变后菌液的pH值、Fe3+和Fe2+的浓度变化情况,研究菌种的生长规律与氧化效率,进一步论证利用低温等离子体技术诱变耐高温T.f菌的可行性,找出合适的诱变条件,培养出可适应烟道高温环境的菌种,为推动T.f菌的广泛应用提供技术支持。
1 实验部分
1.1 菌种来源与培养基
菌种来自于陕西延安黄陵某煤矿排水口采集酸性水样。
9K液体培养基[4]:A液:3 g磷酸氢二铵,0.1 g氯化钾,0.5 g硫酸镁,0.01 g硝酸钙,400 mL蒸馏水,pH调至2.0、120 ℃高温灭菌30 min;B液:44.78 g硫酸亚铁,600 mL蒸馏水,pH调至2.0,紫外灭菌30 min,灭菌完成后A液、B液混合。9K固体培养基则加入15 g琼脂溶于200 mL蒸馏水,其他条件不变。
1.2 仪器与材料
UV-1800紫外可见分光光度计(上海析谱仪器有限公司);低温等离子反应器DBD-300(南京苏曼等离子体科技有限公司)。
1.3 实验方法
1.3.1 培养菌液
9K液体培养基接入10%氧化亚铁硫杆菌菌液(菌液质量浓度在108 g/L左右),pH调至2.0,于30 ℃恒温水浴振荡箱中120 r/min转速条件下进行培养,每6 h测定菌液的吸光度[5],绘制细菌生长曲线。
1.3.2 低温等离子体诱变
去除Fe3+:吸取适量对数期菌液于离心管中,4 000 r/min 离心30 min,弃上清液,用生理盐水洗涤沉淀,再次离心,重复此步骤3次,制成无铁细菌悬液。
诱变:将细菌悬液用无菌水稀释至OD 600 nm值略大于1,即细菌个数约为108个/mL,将稀释过的悬液均匀涂布在载玻片上,使用无菌风吹干[6]。待细菌悬液在载玻片上形成菌斑后,放入石英器皿中置于等离子体反应器内进行诱变。诱变时间设置为60 s,等离子发射源与样品的间距设置为4 mm,将诱变功率设置为自变量,分别为30,40,50,60W,70,80 W每组做3个平行,共计18个样,以不诱变的菌种作为对照组。诱变结束以后用无菌水冲洗菌斑[7],接种在9K固体培养基上避光培养(防止T.f菌在光源的照射下自我修复),计算死亡率,并利用PCR技术鉴定是否为氧化亚铁硫杆菌。
性能测定:挑取长势良好的诱变后菌落接种在9K液体液体培养基中,于35、38、42 ℃条件下120 r/min恒温震荡箱中培养,每24小时测一次菌液的亚铁(Fe2+)、总铁(TFe)以及pH值。待Fe2+完全被细菌氧化以后,对菌液做除Fe3+处理,第一次为一期培养,再按照上述步骤进行二期、三期培养,依此类推。
1.4 分析方法
亚铁(Fe2+):邻啡罗啉比色法(GB7873-87,3)[8,9]。
准确吸取铁标准液0、1.0、2.0、3、4、5 mL于6支50 mL比色管中,分别加入5 mL 22%醋酸铵缓冲溶液,摇晃均匀,加入2 mL质量分数为0.5%邻菲罗啉溶液,加水至50 mL刻度,静止20 min后测定OD 510 nm值,绘制铁溶液的标准曲线。
用移液枪吸取20 μL菌液于50 mL的比色管中,迅速加入两滴浓硫酸(防止Fe2+被氧化产生操作误差)[10],在按照制作标准曲线的操作步骤测定溶液的吸光度,通过铁溶液标准曲线获得相应亚铁的含量,计算出亚铁的浓度。
总铁(TFe)[11]:在菌液样本中加入2 mL 2 mol/L盐酸羟胺,摇晃均匀后加入5 mL 22%醋酸铵缓冲溶液,加入质量分数为0.5%邻菲罗啉溶液2 mL,再次摇晃均匀,测定510 nm处的吸光度,根据铁溶液的标准曲线获得相应总铁的含量。
2 结果与分析
2.1 菌种鉴定
经30、40、50、60、70、80 W诱变后的菌种中,30 W诱变组的死亡率为70%,40 W诱变组的死亡率为76%,50 W诱变组的死亡率为81%,60 W诱变组的死亡率为92%,70 W诱变组的死亡率为94%,80 W诱变组的死亡率达到了100%。低死亡率说明诱变力度不够,大部分原始细菌可以存活下来,达不到预期诱变效果。细菌整体死亡,说明诱变功率太大,得不到有效诱变菌株。因此本实验选用了60 W诱变组与70 W诱变组作为分析对象,并对诱变后存活的菌株做PCR鉴定。
从60 W诱变组与70 W诱变组中分别挑取两株长势形态均良好的菌株,分别命名为L1、L2、Q1、Q2交送至生工生物工程(上海)股份有限公司进行PCR扩增测序,将测序结果由NCBI-Blast进行对比,对比结果表明四株菌均为氧化亚铁硫杆菌,将与分离出的四株菌序列一致性在95%~100%的16SrDNA序列,用Clustal X2.1进行剪切,使得所有序列大小一致,再用MEGA 6.0软件进行多重序列对比分析,以Neighbor-Joining的数据统计方法法构建分子系统发育树,如图1所示。
系统发育树分为两个大枝,Q1、L1、L2和Thiobacillus ferrooxidans strain TGS為一枝,Q1与Thiobacillus ferrooxidans strain XJF-8为一枝,由此可见选出的四株菌均为氧化亚铁硫杆菌。
2.2 38 ℃培养条件下等离子诱变T.f菌结果分析
实验分别以35、38、42 ℃的高温条件培养诱变菌种,分别测定了在培养期间各温度条件下pH值,Fe2+浓度和TFe浓度的变化情况,以38 ℃培养条件为例分析诱变后T.f菌各时期的生长活性,测定结果如表1-3所示。
由表1可知,在三期培养中pH值的变化规律都是呈先增大后减小的趋势,这是因为菌种在适应新环境以后,开始快速生长,消耗大量Fe2+并将其氧化为Fe3+,这一过程使培养基中的H+浓度减小,pH值升高。当细菌经过对数期之后,消耗Fe2+的速度开始减慢,Fe3+逐渐水解生成沉淀,产生大量H+,产生H+的速度远大于消耗H+的速度,因此pH值上升。由表2可知Fe2+浓度随培养时间的增长而减少,表3中TFe浓度在每个培养时期的前1~2 d变化不大,第三天开始呈现减少的趋势,TFe浓度减小是由于Fe3+的水解,但Fe3+水解周期长,短期实验达不到预期效果。因此能反应T.f菌生长状态的主要是Fe2+的氧化速率(见表4),Fe2+浓度越低,Fe2+的氧化速率越快,T.f菌的活性就越强。Fe2+的氧化速率与T.f菌活性呈正比,随时间呈“S”型变化,因此T.f菌生长规律符合在有限环境容量下微生物的“S”型生长曲线。由表4可见,实验组Fe2+的氧化速率略大于对照组,说明诱变组的活性强于对照组,这可能是由于高温抑制了对照组菌种的生长活性,而诱变组对高温表现出了较强的耐性。
通过表5可见对照组与诱变组相比较,诱变组在第2、3 d Fe2+的氧化率均高于对照组,呈现出了较为显著的优势,产生这一结果的原因可能是T.f菌刚接种到新的环境有一个争夺养料和适应环境的过程。在第2、3 d以后,诱变组相比于对照组更适应高温环境,生长状态趋于稳定,而对照组生长受到高温环境的抑制,部分细菌死亡,存活的细菌生长缓慢,Fe2+氧化速率低,氧化周期也相对较长。但60 W诱变组与70 W诱变组总体Fe2+氧化率变化无明显差距,这表明等离子体的诱变可以增加T.f菌对高温的耐受性,但诱变功率对细菌高温耐受程度的影响无明显差异。由表6可知TFe三期培养最终的沉淀率并与太大差异,这是由于Fe3+的水解反应才刚刚开始,且本身水解周期较长,早期数据无参考价值。
2.3 35、38、42 ℃培养条件下低温等离子诱变T.f菌结果对比分析
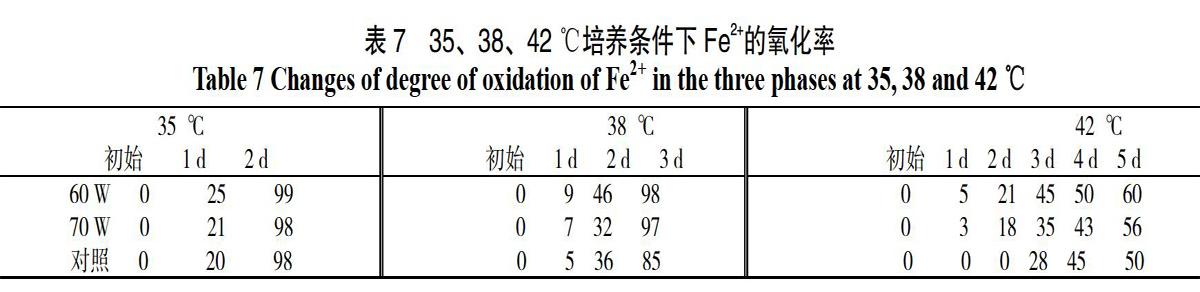
取各高温培养条件下第三期Fe2+的氧化率为样本,如见表7所示,Fe2+氧化速率随温度的增加而减小,诱变过后的菌株也无法逆转T.f菌活性随温度升高而减小的趋势。在35 ℃条件下T.f菌活性最强,氧化速率最快,但诱变组与对照组亚铁氧化率差别不大,均可以在第2 d氧化完全部Fe2+。这可能是因为培养温度35 ℃与T.f菌最适生长温度相近,诱变组与对照组生长受抑制程度小。在38 ℃条件下,诱变组显示出了较为明显的优势,在生长稳定的第3 d诱变组Fe2+氧化率比对照组高13%。42 ℃条件下,诱变组与对照组的亚铁氧化率均受到抑制,直到第5 d诱变组与实验组的亚铁仍未氧化完全,这表明在42 ℃高温条件下绝大部分T.f菌失活,只有少部分存活下来的T.f菌生长缓慢,生长活性低。
3 结 论
(1)低温等离子诱变过后的T.f菌经PCR鉴定后为氧化亚铁硫杆,故等离子体诱变氧化亚铁硫杆菌是可行的;
(2)Fe2+的氧化速率与T.f菌活性呈正比,随时间呈“S”型变化,因此T.f菌生长规律符合在有限环境容量下微生物的“S”型生长曲线。
(3)低温等离子的诱变可以提高T.f菌对高温的耐受性,但诱变功率对细菌高温耐受程度的影响无明显差异。
(4)诱变前后T.f菌活性均随温度的升高而减小,诱变过后的菌株也无法逆转这一生长规律。
(5)35、38、42 ℃三个诱变温度相比较,38 ℃诱变效果最好,诱变组Fe2+氧化率比对照组高13%。
参考文献:
[1]马振,万皓.燃煤烟气用时脱硫脱硝方法的研究进展及分析[J].环境工程,2017,02(35):78-82.
[2]Kelly D P,Wood A P.Reclassification of some species of Thiobacillus to the newly designated genera Acidithiobacillus gen. nov.,Halothiobacillus gen.nov. and Thermithiobacillus gen. nov[J]. International Journal of Systematic and Evolutionary Microbiology,2000,50: 489-500.
[3]高丹,傅金祥,王英刚.氧化亚铁硫杆菌生长测定方法研究[J].沈陽大学学报,2007,19(2):66-68.
[4]李翰林,李茹.氧化亚铁硫杆菌的生长特性及驯化[J].西安工程大学学报,2017,31(01):44-51.
[5]赵苗苗,李茹,李翰林,等.低温等离子体诱变选育高效脱硫菌的研究[J].应用化工,2016,45(2):240-244.
[6]王明伟,梁嘉琦,曾伟民,等.嗜酸氧化亚铁硫杆菌和嗜酸氧化硫硫杆菌联合浸出高锡多金属硫化矿[J].有色金属科学与工程,2018,3(9):76-83.
[7]李翔.等离子体诱变微生物育种[J].现代商贸工业,2017,35(93):195-196.
[8]李兰松,杨利擎,刘旭光.低温等离子体对镍吸附细菌B8的诱变[J].高校化学工程学报,2013,3(27):462-468.
[9]崔国艳,陈五岭,周美红.激光诱变选育耐高温耐酸乳酸菌[J].中国酿造,2012,10(31):153-156.
[10]吴李川,陈茂,邓佳禹,等.氧化亚铁硫杆菌及其应用研究进展[J].山东化工,2017,05(46):53-54+58.
[11]蔡莹瀛,夏苗苗,董会娜.常压室温等离子体(ARTP)诱变及高通量筛选维生素B12高产菌株[J].天津科技大学学报,2018,02(22):20-26.

