有机磷农药广谱降解菌A1A18菌株(Brevundimonas sp.)的筛选、鉴定与降解特性分析
顾 欣,刘文辉,杨环羽,柳强娟,孙 权,王 锐,王新谱
(宁夏大学 农学院,银川 750021)
有机磷农药(Organophosphorus pesticide,OP)是应用最广的一类有机农药[1],其毒性给人类、其他生物和环境带来一系列问题[2]。农业生产中使用的OP大部分进入耕作环境,其中土壤是农药残留累积的主要场所。由于农药自身物理化学性质、使用频次和土壤环境的差异,不同OP的自然降解过程长短不一,从数天到数百天[3-4]。为了避免土壤农药残留过量累积对人类和环境造成更大的危害,研究OP的加速降解技术迫在 眉睫。
目前,OP的降解主要有微生物降解、光降解和氧化降解3个途径[5]。其中,微生物降解方法以其环境友好、无二次污染、使用便捷等优点而获得人类的青睐。因此,具有OP降解功能的微生物研究成为热点。目前,已知多种OP降解菌,如假单胞菌属(Pseudomonas)、芽孢杆菌属(Bacillus)、黄杆菌属(Flavobacterium)、木霉属(Trichoderma)、曲霉属(Aspergillus)和青霉属(Penicillium)等微生物,都是针对某种单一OP进行定向筛选分离获得的[6-8]。在农业生产实践中,由于耕作方式和环境变化导致不同害虫在同一田块中发生,造成不同种类的OP同时或先后被施用并累积于土壤。因此,筛选对多种OP都具有降解能力的广谱降解菌,有利于提高农田土壤修复效率,同时降低修复成本。部分学者在这方面开展了研究,如Pino等[9]通过选择富集法,从农药污染土壤中获得对毒死蜱和甲基对硫磷都具有较好降解效果的菌系。某些真菌,如淡紫青霉(Penicilliumlilacinum)BP303菌株产生的酶可以使OP的P-O和PS键发生裂解,从而具有同时降解对氧磷、对硫磷、甲基对硫磷的功能,其中对氧磷是该菌株的优选底物[10]。3株蜡状芽孢杆菌(Bacilluscereus)对毒死蜱、甲基对硫磷和三唑磷具有不同的降解能力[11]。1株施氏假单胞菌(Pseudomonasstutzeri)对甲基对硫磷具有较高降解率,对氧化乐果、甲拌磷和辛硫磷也具有一定降解效果[12]。
本研究选择毒死蜱、氧化乐果和水胺硫磷作为目标降解物,开展OP广谱降解菌的分离筛选和初步鉴定,确定其对不同种类农药的降解效果及其降解功能的遗传稳定性,为OP高效降解菌的进一步开发和研究提供菌种资源和理论依据。
1 材料与方法
1.1 土壤样品
用于OP降解菌富集、筛选的土壤样品采集自银川市军马场农田、银川市区周边农田、贺兰县菜田和果园,都曾经施用过毒死蜱、氧化乐果或水胺硫磷。取表层土5~20 cm,剔除其中的石块、植株残体,阴凉处摊开自然风干,过2.0 mm筛,备用。
非耕作土壤采集自银川市军马场荒地,经过预处理后,用于OP加标回收试验及盆栽试验。该土壤样品质地为砂壤,酸碱度为8.57,全盐质量分数为0.60 g·kg-1,有机质质量分数为2.87 g·kg-1,碱解氮质量分数为1.05 g·kg-1,速效磷质量分数为32.32 g·kg-1,速效钾质量分数为203.39 g·kg-1。
1.2 有机磷农药
购自银川市农资市场,基本情况见表1。

表1 有机磷农药基本情况Table 1 Organophosphorus pesticides
1.3 主要培养基和试剂
牛肉膏蛋白胨液体培养基:牛肉膏3.0 g,蛋白胨10.0 g,NaCl 5.0 g,蒸馏水1 000 mL,pH 7.0~7.4,用于菌种活化。
牛肉膏蛋白胨固体培养基:在牛肉膏蛋白胨液体培养基中加琼脂15.0~20.0 g·L-1,用于菌种保存、活化和传代培养。
固体选择培养基:牛肉膏蛋白胨固体培养基经高压蒸汽灭菌后,冷却至约40 ℃加入试验用OP(毒死蜱、氧化乐果或水胺硫磷,下同),使OP终质量浓度为1 g·L-1,用于降解菌的初筛和 纯化。
液体选择培养基:牛肉膏蛋白胨液体培养基经高压蒸汽灭菌后,冷却至约40 ℃加入试验用OP,使OP终质量浓度为1 g·L-1,用于降解菌的复筛。
淀粉琼脂培养基,用于淀粉水解试验。葡萄糖发酵培养基,用于葡萄糖发酵试验。葡萄糖蛋白胨水培养液,用于乙酰甲基甲醇(V-P)试验。葡萄糖蛋白胨水培养基,用于甲基红试验。柠檬酸铁铵培养基,用于硫化氢试验。硝酸盐培养基,用于硝酸盐还原试验。营养明胶培养基,用于明胶液化试验。尿素培养基,用于脲酶试验。蛋白胨水培养基,用于吲哚试验。苯丙氨酸脱羧酶培养基,用于苯丙氨酸脱羧酶试验[13]。
主要试剂与标准品:二氯甲烷(分析纯),石油醚(分析纯),购自国药集团化学试剂有限公司;细菌基因组提取试剂盒和DNA片段快速回收纯化试剂盒,购自天根生化科技(北京)有限公司。其余试剂均为标准品,为毒死蜱、氧化乐果(纯度99%)和水胺硫磷(纯度98%),购自宁夏恒元创科贸有限公司。
1.4 降解菌的富集与分离纯化
采用不同的OP液体选择培养基,加入质量比为1∶100的土壤样品,于30 ℃、200 r·min-1恒温避光振荡培养6 d。将培养液以φ=10%接种量转接至新的OP液体选择培养基中,使其中OP终质量浓度逐级增加,分别为1.5、2.0、2.5、3.0 g·L-1。至培养结束,取培养液1 mL与 19 mL 50 ℃左右的OP固体选择培养基混匀,冷却制平板,于30 ℃恒温箱避光倒置培养。对长出的菌落经3次划线分离纯化,获得纯培养菌种,置于4 ℃冰箱冷藏保存。
1.5 降解菌初筛
采用牛肉膏蛋白胨液体培养基于30 ℃、200 r·min-1振荡培养菌种,活化18 h。摇匀后,用无菌水制备菌悬液,于37 ℃、200 r·min-1振荡2 h,稀释后使其中细菌终数量密度为0.2×108CFU·mL-1。采用固体平板培养法,在固体选择培养基表面以辐射对称方式放置8个无菌牛津杯,每个杯内注入110 μL菌悬液。于37 ℃恒温避光培养24 h,牛津杯内的液体几乎全部自然蒸发。取出牛津杯,于原培养条件倒置培养2~4 d,以等量无菌水为对照,每处理设5个重复。观察牛津杯外侧有无降解圈,以不同角度用游标卡尺测量降解圈外径3次,取均值作为降解圈外径。以降解圈外径大小作为初筛依据,选择降解圈最大和较大的菌株进入复筛。
1.6 降解菌复筛
活化菌种,制备菌悬液,方法同“1.5”。取 1 mL菌悬液接种于99 mL OP液体选择培养基中,37 ℃、200 r·min-1恒温避光振荡培养72 h,检测其中OP残留量。以不接种的液体选择培养基为空白对照,每处理设3个重复。降解率计算公式如下:
降解率=(空白对照OP残留量-降解菌处理OP残留量)/空白对照OP残留量×100%
比较各菌株对3种OP的降解率,以降解率较高的菌株作为目标菌株。
1.7 降解菌降解能力的遗传稳定性
活化目标菌株,方法同“1.5”。进行传代培养,分别测定初始菌、第5代和第10代对3种OP的降解率,检测方法同“1.6”。每处理设3个重复。以降解率较稳定的菌株为OP广谱降解菌株。
1.8 降解菌鉴定
1.8.1 形态学鉴定 采用平板划线法活化目标菌株,牛肉膏蛋白胨固体培养基、37 ℃恒温倒置培养18 h,形成单一菌落。观察菌落的形态、颜色、直径大小及菌落边缘是否整齐;经革兰氏染色,镜检观察菌体形态,测量长短径,芽孢有无等。
1.8.2 生理生化鉴定 包括葡萄糖发酵试验、淀粉水解试验、明胶液化试验、硫化氢试验、吲哚试验、甲基红试验和菌膜形成试验。参照东秀珠《常见细菌系统鉴定手册》进行分类鉴定[13]。
1.8.3 分子鉴定 提取细菌总DNA[14]。引物为27F:AGAGTTTGATCCTGGCTCAG,1492R:GGTTACCTTGTTACGACTT。PCR 条件为:95 ℃预变性5 min;95 ℃变性30 s,57 ℃退火30 s, 72 ℃延伸2 min,30个循环;72 ℃最后延伸 8 min,16 ℃保温。PCR产物经检测扩增效果后在10 g·L-1琼脂糖凝胶上做电泳分析,回收 16S rDNA,委托广州赛哲生物技术公司完成 测序。
1.8.4 系统发育地位确定 将测序获得的菌株16S rDNA基因序列提交到NCBI总数据库,经BLAST软件在线比对,进行同源性分析。选择同源性关系比较近的序列,采用MEGA 5.0建立进化树。
1.9 降解菌对土壤中OP的降解能力
1.9.1 降解菌菌悬液制备 活化降解菌,方法同“1.5”。用无菌水制备有效活菌数量密度为 1.0×108CFU·mL-1的菌悬液。
1.9.2 土壤中OP降解试验 于避光处,在预处理后的非耕作土壤中,用小型喷雾器添加3种OP,边喷边搅拌,充分混匀,使土壤中3种OP原药的质量分数分别达到1.0 mg·kg-1干土,制成试验用污染土。用同样方法喷入菌悬液,搅拌均匀,使降解菌在试验土壤中的初始数量密度为0.2×108CFU·g-1干土。立即将混匀后的土壤装花盆。花盆上、下口直径分别为16.0 cm和11.0 cm,高14.0 cm,装土量为1.0 kg。用无菌水调节土壤湿度为20%。置于温室,正常光照,每日根据蒸发量补水。以不添加降解菌的OP污染土为对照。每处理3个重复。分别于装盆后的0(装盆后4 h)、1、3、5、7、14、21 d取0 ~10 cm的土样,每处理采用多点混合,四分法取样,用密封袋装好,放入有冰袋的保温箱内,立即带回实验室进行OP质量分数检测。
1.10 菌液数量密度及土壤理化性质检测
菌液数量密度:采用梯度稀释平板培养法。用无菌生理盐水制备菌液的梯度稀释液,分别取1 mL稀释液倒入50~60 ℃、15 mL牛肉膏蛋白胨固体培养基中,立即混匀,静置冷却,37 ℃倒置培养 24 h,菌落计数。每个数量密度梯度3个重复,计算菌液的活菌数量密度。
土壤的理化性质:采用烘干法测含水量;采用电位法测pH;采用重铬酸钾容量法测有机质质量分数[15]。
1.11 样品中OP残留量的检测
1.11.1 OP残留量的检测 参照NY/T 761-2008中OP农药残留的提取方法处理培养液样品[16];参照Fang等[17]的方法处理土壤样品。采用气相色谱分析法。仪器条件为Agilent 7980A-ECD;色谱柱为HP-5石英毛细柱,30 m×0.32 mm×0.25 μm;毒死蜱、氧化乐果检测时的进样口温度220 ℃,检测器温度320 ℃,柱温270 ℃;水胺硫磷检测时的进样口温度220 ℃,检测器温度200 ℃,柱温170 ℃;载气均为高纯氮气(纯度99.999%),流速为1.0 mL·min-1。采用不分流进样,进样体积1 μL。用外标法计算样品中OP的残留量。
1.11.2 土壤中OP加标回收试验 取预处理后的非耕作土壤样品,避光称取3种OP标品分别与之混匀,制成OP初始质量分数分别为0.1、 0.5、1.0、5.0 mg·kg-1干土的含农药土壤,以不加OP为对照,每处理3个重复。按照“1.11.1”的方法检测土壤中OP的质量分数,分别计算3种OP的加标回收率。
1.12 统计分析
采用Excel 2016软件处理数据和绘图;采用SPSS 17.0软件进行方差分析,在P<0.05水平上进行差异显著性检验。采用MEGA 5.0建立进化树。
2 结果与分析
2.1 降解菌初筛
初筛共获得菌株12株,见表2。各菌株在不同培养基上形成的降解圈外径不同。牛津杯内径为6 mm,降解圈外径越大,说明该菌株在相应OP选择培养基上的生长状况越好。因此,依据降解圈外径的大小可以对各菌株的农药降解性能进行初步比较。试验目标是选择对3种OP都具有一定降解能力的菌株,故选择3种OP培养基上都具有降解圈,且降解圈外径最大和较大的菌株作为目标菌株。在毒死蜱、氧化乐果和水胺硫磷固体选择培养基上的降解圈外径最大的菌株编号分别为A1A18、A5C2和B2C6,且3个菌株对3种OP均有一定的降解能力,说明不同菌株对不同农药的降解性能具有差异,以这3个菌株作为目标菌株进入复筛。
表2 初筛菌株的来源土壤及其在3种OP选择培养基上的降解圈外径Table 2 Source soil and outer diameter of degradation circle of strains in three kinds of OP selection media in preliminary screening mm
注:不同的小写字母表示差异显著(P<0.05),下同。
Note:Different lowercase letters represent significant difference (P<0.05),the same below.
2.2 降解菌复筛
将初筛获得的3个菌株在毒死蜱、氧化乐果和水胺硫磷液体选择培养基中进行培养,检测各菌株在液体环境中对农药的降解率,结果如图1。3个菌株对3种OP都有一定降解能力,但降解效果具有差异。比较毒死蜱的降解率,3个菌株由高到低是A1A18、A5C2、B2C6,A1A18的降解率最高,为45.82%。比较氧化乐果的降解率,3个菌株由高到低是A5C2、A1A18、B2C6,A5C2和A1A18的降解率分别为9.90%和9.52%,其差异未达显著水平。比较水胺硫磷的降解率,3个菌株由高到低是B2C6、A1A18、A5C2,B2C6的降解率最高,为24.64%,A5C2对水胺硫磷的降解能力很低。由此可知,在3株细菌中菌株A1A18对3种OP均具有一定的降解能力,降解率分别为45.82%、9.52%和13.96%。以菌株A1A18作为目标菌株,开展降解能力遗传稳定性研究。

图1 液体培养条件下目标菌株对3种OP的降解率Fig.1 Degradation rate of three kinds of OP by 3 strains in liquid fermentation
2.3 A1A18菌株降解能力的遗传稳定性
对复筛获得的目标菌株A1A18进行传代培养。该菌株的第1、5、10代对试验用3种OP的降解率如图2。菌株A1A18对毒死蜱和氧化乐果的降解能力在第5、10代分别较第1代下降 1.90%~3.40%和14.18%~16.18%,但各代之间差异在统计学上未达显著水平。由此可知,菌株A1A18对毒死蜱、氧化乐果和水胺硫磷的降解能力遗传稳定性较好。

图2 菌株A1A18对3种OP降解能力的遗传稳定性Fig.2 Degradation capacity genetic stability of strain A1A18 to five kinds of OP
2.4 A1A18菌株鉴定
2.4.1 形态学鉴定 A1A18菌株在琼脂培养基表面形成菌落。菌落颜色为灰白色,直径为 0.5~0.8 cm,圆形,表面光滑,不透明,侧面观似草帽状,中部具有凸起,边缘较整齐具有蜡质感。菌体为直杆状,大小为(0.3~0.5) μm×(1.5~ 2.5) μm,具圆端,无芽孢(图3)。

图3 菌株A1A18的菌落形态(A)和菌体形态(B)Fig.3 Colony(A) and bacteria(B) morphology of strain A1A18
2.4.2 生理生化鉴定 依据菌株A1A18的形态特征及生理生化试验结果(表3)进行鉴定,初步判断该菌株与短波单胞菌属(Brevundimonas)细菌的主要特征一致。
2.4.3 分子鉴定 菌株A1A18的16S rDNA基因序列长度为1 357 bp,NCBI系统中GenBank登录号为MK110476。将该序列录入NCBI,进行Blast比对,结果与短波单胞菌属(Brevundimonassp.)相应基因序列具有99%的同源性。选取该基因库中同科近缘的7个属典型代表菌种进行16S rDNA序列比对,通过MEGA 5.0软件构建系统发育树(图4)。通过对系统发育树的分析,可知该菌株为短波单胞菌(Brevundimonassp.)。
2.5 A1A18菌株对土壤中OP的降解能力
2.5.1 土壤中OP加标回收率 毒死蜱、氧化乐果和水胺硫磷3种OP在土壤样品中的加标回收率见表4。空白对照中未检测出3种OP残留。毒死蜱、氧化乐果或水胺硫磷在试验土样中的平均加标回收率分别为91.039%~100.703%、 89.215%~99.762%、87.996%~99.702%,相对标准偏差分别为1.906%~4.415%、 1.986%~ 3.830%、2.763%~4.718%。表明使用该方法检测试验土壤样品中的毒死蜱、氧化乐果和水胺硫磷,回收率较高,相对标准偏差较小,符合农药残留检测方法对加标回收率70%~110%的要求[18]。
2.5.2 A1A18菌株对土壤中3种有机磷农药的降解能力 试验土壤中添加降解菌A1A18,对土壤中毒死蜱、氧化乐果和水胺硫磷3种OP的降解均具有促进作用(图5)。
对添加A1A18菌株处理与未添加降解菌的对照进行比较,随着试验时间的增加,土壤中毒死蜱的降解率显著提高。第3天时,施菌处理和CK的毒死蜱降解率分别为38.75%和21.97%,增幅为76.39%;第5天的降解率分别为63.02%和38.72%,增幅为62.76%。随后,二者差异呈缩小的趋势,到第21天,毒死蜱降解率分别为88.81%和76.40%,增幅为16.24%。
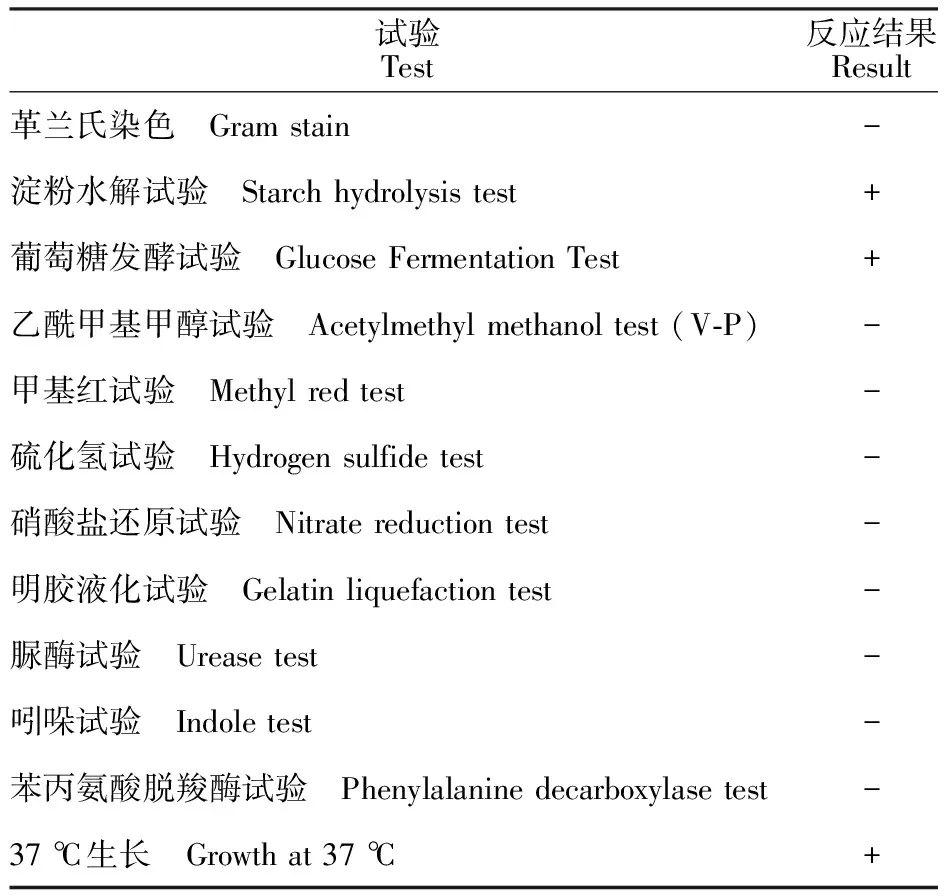
表3 菌株A1A18的生理生化试验结果Table 3 Physiological and biochemical identification results of strain A1A18
注:“+” 表示反应阳性,“-”表示反应阴性。
Note: “+” positive reaction,“-” negative reaction.

图4 基于A1A18菌株16S rDNA序列构建系统发育树Fig.4 Phylogenetic tree of strain A1A18 based on 16S rDNA sequence analysis

OP加标质量分数/(mg·kg-1) Mass fractionof OP毒死蜱 Chlorpyrifos平均加标回收率/%Average recovery of standard addition相对标准偏差/%RSD氧化乐果 Folimat平均加标回收率/%Average recovery of standard addition相对标准偏差/%RSD水胺硫磷 Isocarbophos平均加标回收率/%Average recovery of standard addition相对标准偏差/%RSD0.191.0393.01289.2152.74087.9964.7180.594.6421.90698.7092.86190.4593.2911.095.7572.64496.3743.83099.7022.7635.0100.7034.41599.7621.98697.6683.184
在氧化乐果处理组中,添加A1A18菌株与CK的氧化乐果降解率进行比较,二者在前期均表现出较高的降解率,第1天时分别为19.21%和11.98%,增幅为60.38%,第3天的降解率分别为58.29%和42.51%,增幅为37.12%,第7天的降解率分别已达86.19%和76.48%,增幅为12.69%。随着时间的增加,两处理的差异逐渐趋于减少,至第14天,二者的降解率均大于 89.62%,且差异均未达显著水平。至第21天,两处理的降解率达到94.59%及以上,接近完全降解。
在水胺硫磷处理组中,施菌后显著提高土壤中农药的降解率。添加A1A18菌株处理的降解率为第1天的11.85%,第7天的51.46%,第21天的87.75%;CK的降解率为第1天的 6.07%,第7天的29.68%,第21天的70.40%。降解率的增幅从95.25%(第1天)逐渐降低至 73.37%(第7天),进而降低至26.64%(第21天)。

图5 添加降解菌A1A18对土壤中毒死蜱(A)、氧化乐果(B)和水胺硫磷(C)降解率的影响Fig.5 Effects of strain A1A18 on degradation rate of chlorpyrifos(A),folimat(B) and isocarbophos(C) in tested soil
3 讨 论
本试验所用土壤来自非耕作地,质地为砂壤,具有偏碱性、有机质质量分数较低、组成成分较简单,3种OP在该土壤中的平均加标回收率均满足农药残留检测方法的要求,表明该试验方法的精确度可用于检测试验土壤中3种OP的残留量。
不同的微生物对不同种类OP的降解机制具有差异[19-20]。毒死蜱和水胺硫磷具有P=S双键,氧化乐果具有P=O双键。有的微生物利用有机磷酸水解酶、磷酸三酯酶等催化断裂磷硫键、磷氧键和磷氟键[19,21];有的微生物采用共代谢作用、矿化作用、种间协同代谢作用等降解OP[22]。研究表明,短波单胞菌属细菌具有磷酸三酯酶[23],对毒死蜱、乐果和对硫磷等多种OP均具有降解作用[24-26]。分子生物学研究证明,短波单胞菌细胞有关OP的水解酶位于细胞质膜的周质面,其对有机磷的水解机制涉及双精氨酸转运通路[27]。本试验菌株为短波单胞菌A1A18,对毒死蜱、水胺硫磷和氧化乐果均具有一定的降解能力,由此推测,该菌株对3种OP的降解机制可能与此有关。
除了生物学因素,光照强度、时间,土壤的物理、化学性质,以及OP的自身特性均影响其在土壤中的降解率。毒死蜱、氧化乐果和水胺硫磷都有光降解现象[28-30]。土壤质地砂壤较粘壤、pH呈碱性较酸性或中性更有利于OP的降解[31],有机质质量分数高有利于OP的吸附[32]。本试验条件为正常温室光照,土壤为砂壤、碱性、有机质质量分数较低,加之土壤中原有土著微生物对OP具有一定降解作用,因此,土壤试验对照组中3种OP的降解率都较液体培养试验更高。尤其氧化乐果,施药后第14天,无论是否添加降解菌,降解率都高于89.62%,至第21天时,几乎完全降解。这可能是由于氧化乐果中含有P=O双键,较毒死蜱和水胺硫磷中的P=S双键具有更强的极性,更易发生断裂[33],导致氧化乐果在碱性环境中较其他2种OP更易降解。
目前,国内外对短波单胞菌属细菌降解OP的研究多涉及单一种类的OP,如Brevundimonassp.Dsp-7对毒死蜱具有一定降解功能[24];Brevundimonassp.MCM B-427在适宜的pH下对乐果具有较好的降解效果[25];多株B.diminuta具有对硫磷水解酶,降解能力较强[26]。涉及多种OP底物的该属降解菌研究较少,如Brevundimonassp.MM1,可以水解苯胺磷、苯胺磷亚砜和苯胺磷砜的P-O-C键,对3种OP具有较好的降解能力[34]。采用该属中的降解菌株用于毒死蜱、氧化乐果和水胺硫磷3种OP污染土壤的修复研究尚未见报道。试验结果表明,施药后第7天,添加A1A18菌株处理的土壤中氧化乐果降解率达86.19%,较CK提高12.69%。施药后第21天,该菌株处理的土壤中毒死蜱和水胺硫磷的降解率均超过87.75%,较CK提高16.24%和24.62%;说明短波单胞菌A1A18菌株促进3种OP的降解,具有较好的田间应用潜力。综上所述,短波单胞菌属细菌是具有多种OP降解潜力的微生物,在多种OP底物降解机制和应用开发等诸方面有待开展进一步研究。
4 结 论
有机磷农药广谱降解菌短波单胞菌A1A18菌株对毒死蜱、氧化乐果和水胺硫磷具有一定降解能力。在液体培养环境中,该菌株对3种有机磷农药的降解率分别为45.82%、9.52%和 13.96%。经10代培养,确定其农药降解能力具有很好的遗传稳定性。在有机磷原药质量分数为1.0 mg·kg-1干土的土壤中施用A1A18菌株,降解菌初始数量密度为0.2×108CFU·g-1干土,施药后第21天,土壤中毒死蜱和水胺硫磷的降解率分别达到88.81%和87.75%,较CK提高 16.24%和24.62%;施药后第7天,土壤中氧化乐果降解率达86.19%,较CK提高12.69%。因此,短波单胞菌A1A18作为西北地区农药污染土壤的修复菌株具有较好的田间应用潜力。

