白介素10对人mDCs细胞骨架及其结合蛋白的影响
夏 雪,许筱莉,龙金华,2,王 赟,3,张世超,欧阳燕,朱贵明,胡祖权,曾 柱,3
树突状细胞(dendritic cells, DCs)是机体内功能强大的抗原呈递细胞[1],临床上利用DCs治疗免疫相关疾病已经取得大量进展,在肿瘤治疗领域的成功应用更是令人瞩目[2-3]。研究[4-5]表明肿瘤微环境中高表达的抑制性细胞因子能够影响DCs的免疫学功能,白介素10(interleukin-10, IL-10)在肿瘤患者体内的表达量较高,是一种具有免疫抑制特性的细胞因子,动物实验显示IL-10的活性能够抑制DCs的分化成熟,并影响抗肿瘤免疫治疗的效果[6-7]。从生物物理学的观点来看,结构决定功能,细胞骨架重构在DCs的迁移和发挥免疫功能中起重要作用[7]。该文研究IL-10对人成熟树突状细胞(mature DCs, mDCs) 细胞骨架的影响,为研究肿瘤微环境中DCs的免疫学功能以及探索提高DCs肿瘤疫苗的治疗效率提供理论依据。
1 材料与方法
1.1 主要试剂RPMI 1640培养基、胎牛血清购自美国Gibco公司;细胞裂解液、淋巴分离液均购自北京索莱宝公司;免疫磁珠分选试剂盒购自德国MACS公司;兔抗人丝切蛋白(Cofilin)、兔抗人磷酸化丝切蛋白(phosphorylation cofilin,p-Cofilin)购自美国CST公司;小鼠抗人肌动蛋白丝束蛋白(Fascin-1)购自美国Santa公司;小鼠抗人β-actin单克隆抗体购自北京全式金公司;重组人粒细胞巨噬细胞集落刺激因子(rhGM-CFS)、重组人白细胞介素4(rhIL-4)、肿瘤坏死因子α(rhTNF-α)、IL-10购自美国PeproTech公司;罗丹明标记的鬼笔环肽购自美国Thermo-Fisher Scientific公司。
1.2 方法
1.2.1CD14+单核细胞的分离 在50 ml离心管中加入15 ml淋巴细胞分离液,再缓慢加入30 ml的新鲜人外周血浓集白细胞,该新鲜人外周血浓集白细胞用2倍体积RPMI 1640培养基稀释,2 600 r/min离心15 min;吸取白膜层,与等量RPMI 1640培养基混匀,1 000 r/min离心10 min,弃上清液,重复2~3次洗涤细胞。随后,加入适量RPMI 1640培养基悬浮细胞,转入细胞培养瓶,置于CO2培养箱37 ℃培养2~3 h,用0.25%胰蛋白酶消化收集外周血单核细胞。
1.2.2mDCs诱导培养 用含鸡尾酒抗体的免疫磁珠阴性选择获得CD14+的单核细胞,加入150 ng/ml rhGM-CSF、100 ng/ml rhIL-4,培养5~7 d分化为未成熟树突状细胞(immature DCs, imDCs) 。然后,用RMPI 1640培养基漂洗imDCs 2次,加入含150 ng/ml rhGM-CSF、100 ng/ml rhIL-4和10 ng/ml TNF-α的细胞培养液,培养3 d获得mDCs。
1.2.3IL-10处理mDCs 用RPMI 1640培养基将mDCs稀释成1×106/ml,接种于24孔细胞培养板,加入含150 ng/ml rhGM-CSF、100 ng/ml rhIL-4和10 ng/ml TNF-α的细胞培养液,处理组再加入10 ng/ml IL-10,置于CO2培养箱37 ℃培养48 h。
1.2.4细胞骨架结构分析 取盖玻片置于6孔细胞培养板中,每孔加入1 ml 0.1 mg/ml多聚赖氨酸,37 ℃培养箱中放置2 h,每孔加入1 ml PBS漂洗盖玻片2次,去除多聚赖氨酸。加入细胞悬液,置于CO2培养箱中培养30 min,每孔加入1 ml 3.7%多聚甲醛固定细胞30 min。吸取上清液丢弃,加入1 ml 75 mg/ml甘氨酸室温孵育10 min,再换1% Triton X-100室温孵育10 min。随后,每孔加入1 ml PBS置于摇床上晃动清洗5 min,吸弃上清液,重复操作3次,每孔加入100 μl 1%BSA溶液室温封闭1 h;PBS漂洗3次,加入50 μl 150 U/ml罗丹明标记的鬼笔环肽,室温下避光静置40 min;PBS漂洗3次,加入50 μl DAPI溶液,室温下避光静置10 min。最后,PBS漂洗细胞3次,取出盖玻片,加50 μl抗荧光淬灭剂固定在载玻片上。利用激光共聚焦显微镜在630倍物镜下观察mDCs的细胞骨架结构。
1.2.5Western blot实验分析 用RIPA提取mDCs总蛋白,通过BCA法测定蛋白浓度后,取50 μg总蛋白进行SDS-PAGE电泳,转印至硝酸纤维素膜上,置于5%脱脂奶粉中封闭1 h。TBST溶液洗3次后,分别加入抗Fascin-1、抗Cofilin、抗p-Cofilin和抗β-actin抗体,室温2 h。TBST溶液洗涤3次,加入HRP标记的二抗,室温轻摇1 h。最后,用TBST和TBS洗涤3次,在暗室中加入化学发光显色试剂,曝光显影后利用Image J软件分析蛋白条带。
1.2.6免疫荧光实验 细胞处理同细胞骨架结构分析,在加入BSA溶液封闭后,分别加入抗Fascin-1、抗Cofilin、抗p-Cofilin抗体,37 ℃孵育2 h。用PBST和PBS洗涤3次后,加入500 μl荧光标记二抗,37 ℃培养箱放置1 h。随后,PBST和PBS分别洗涤细胞3次,取出盖玻片,加50 μl抗荧光淬灭剂固定在载玻片上,利用荧光显微镜分析细胞骨架结合蛋白在mDCs中的定位情况。
2 结果
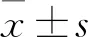
2.1 细胞形态观察在培养过程中,外周血单核细胞分化为imDCs后,细胞体积比单核细胞略大,形态为多边形,细胞表面伸出许多毛刺样突起,细胞抱团,呈集落样生长(图1A)。当细胞成熟为mDCs后,变为不规则形状,细胞表面伸出许多长短不一、粗细不等、疏密不同的树枝状、毛刺状或绒线状的突起(图1B)。
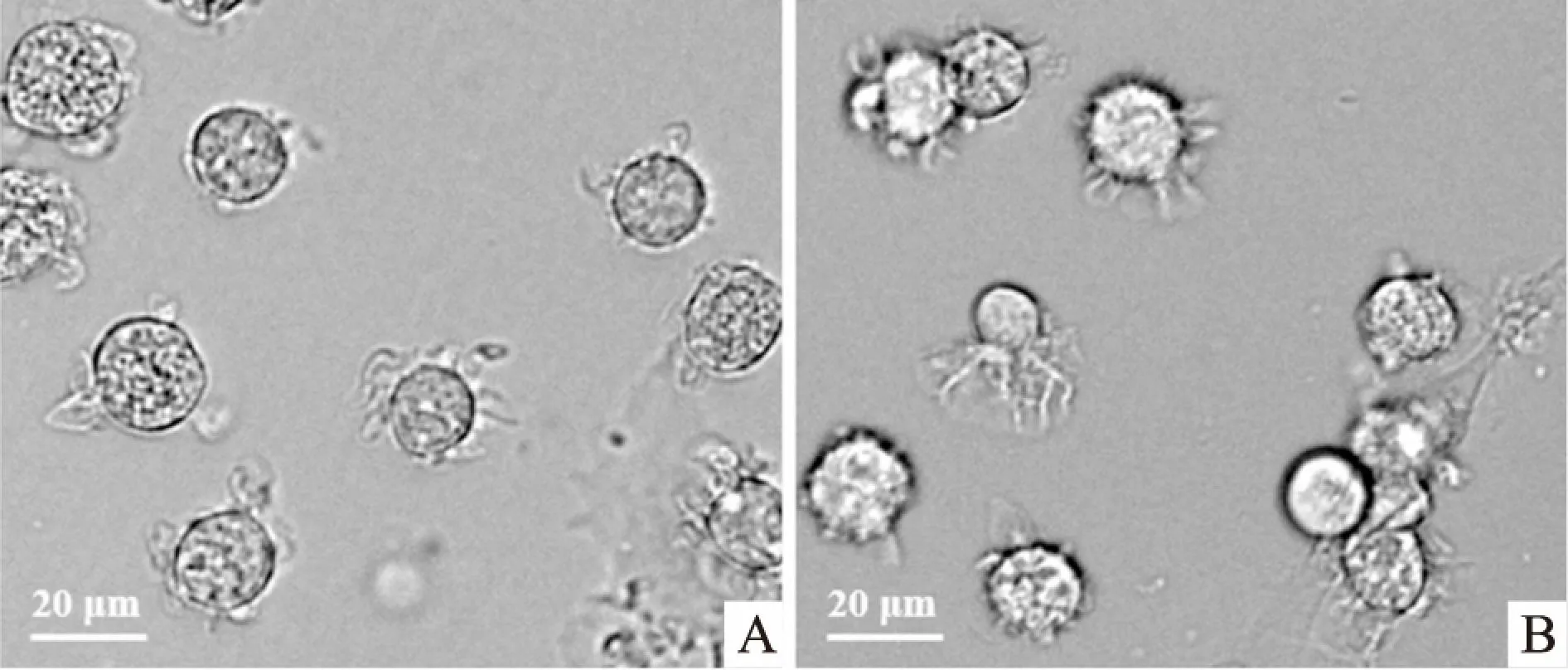
图1 显微镜明场下imDCs和mDCs的形态 ×40A:imDCs;B:mDCs
2.2 细胞骨架纤维状肌动蛋白(fibros actin,F-actin)结构的变化细胞经IL-10处理后,用罗丹明标记的鬼笔环肽特异性标记细胞内F-actin,通过激光共聚焦显微镜观察其结构。结果如图2所示,对照组mDCs的F-actin主要分布于细胞膜下,而IL-10处理后mDCs的F-actin多聚集于细胞表面的突起,提示细胞骨架结构发生了明显的重组,说明IL-10能够影响mDCs的细胞骨架重排。
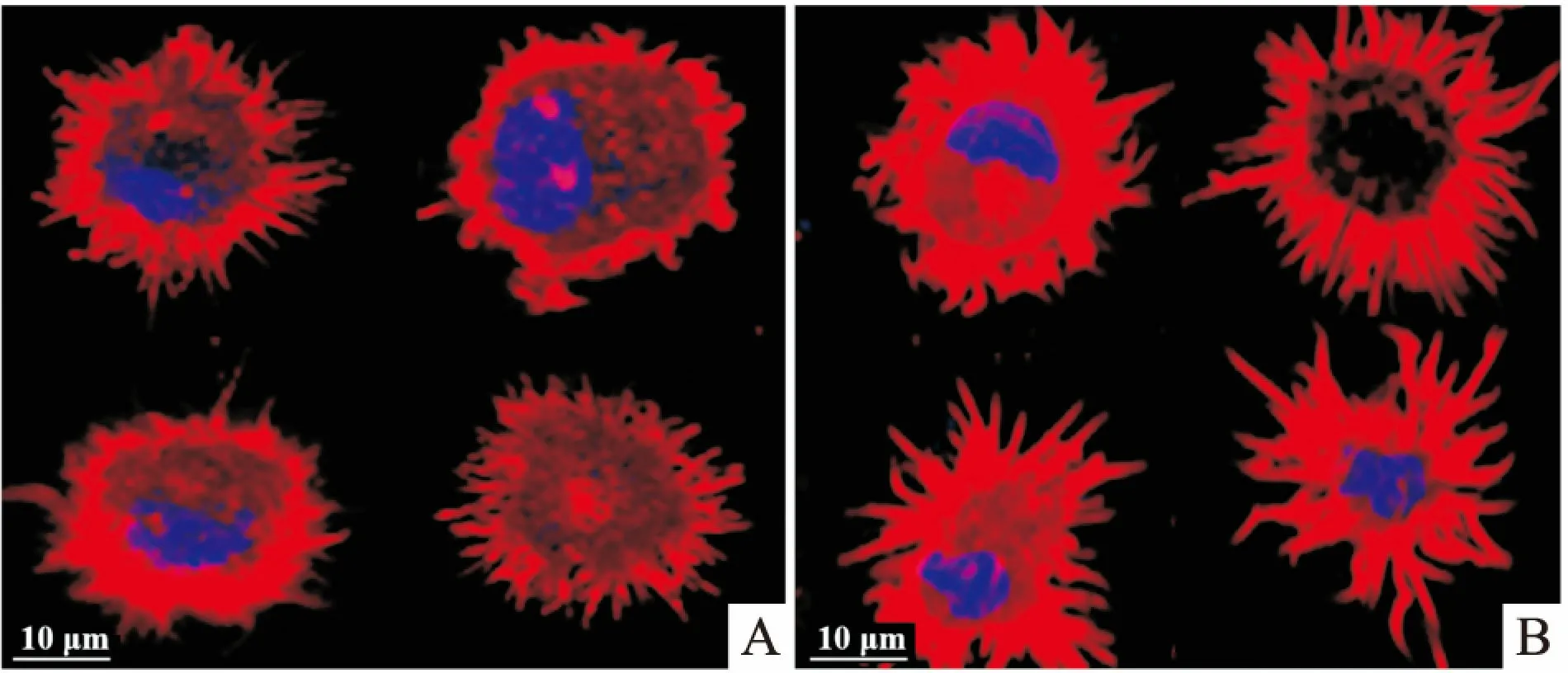
图2 mDCs细胞骨架F-actin结构的变化 ×630A:对照组;B:IL-10处理组
2.3 细胞骨架结合蛋白的表达细胞骨架结构及其结合蛋白的表达与细胞的生物物理学特性和运动能力密切相关。结合前期10 ng/ml的IL-10处理mDCs后基因芯片的结果,本实验利用Western blot实验分析IL-10对细胞骨架结合蛋白Fascin-1、Cofilin和p-Cofilin的表达影响(图3)。IL-10处理后,DCs中Cofilin的表达变化不明显,Fascin-1和p-Cofilin的表达上调,差异具有统计学意义(P<0.05),表明细胞骨架结合蛋白在mDCs的F-actin重排过程中的起到调节作用。

图3 Western blot检测细胞骨架结合蛋白的表达情况
A:Fascin-1;B: Cofilin; C:p-Cofilin;D:蛋白相对表达量分析结果;与对照组比较:*P<0.05
2.4 细胞骨架结合蛋白的定位分析细胞骨架结合蛋白在发挥其功能的过程中,除了表达量外,在细胞中的定位也起着重要作用。10 ng/ml的IL-10处理mDCs后,免疫荧光实验分析Fascin-1、Cofilin和p-Cofilin在细胞中的定位情况。结果如图4所示,3种细胞骨架结合蛋白的定位都发生了明显的变化,其中Fascin-1定位于细胞张力纤维和细胞膜褶皱边缘的丝状伪足和微棘等细胞突起的核心肌动蛋白束上,而Cofilin和p-Cofilin位于质膜和胞质,与肌动蛋白丝共定位。
3 讨论
DCs是机体免疫系统中功能最强的专职抗原提呈细胞,在体内直接激活初始T细胞,生成辅助性T细胞和杀伤性T细胞,也能诱使B细胞生成抗体,基于DCs的抗肿瘤免疫治疗被认为是目前最有希望攻克癌症的方法之一,但是该治疗方法在临床试验的过程中还存在一些问题[2-3, 8],本实验以肿瘤微环境中高表达的IL-10为研究对象,分析其对mDCs细胞骨架的影响,这对深入理解DCs的免疫学功能以及提高DCs肿瘤疫苗的临床治疗效率来说具有重要意义。
细胞骨架是细胞核骨架、细胞质骨架、细胞膜骨架和细胞外基质所形成的网络体系,核骨架、核纤层与中间纤维在结构上互相连接,贯穿于细胞核和细胞质的网架体系,具有维持细胞形态,细胞内结构有序性的功能,在调控细胞运动、物质运输、能量转换、信号转导、细胞分化、基因表达以及生物物理学特性等方面起着关键的作用[9-11],这些过程还受到细胞骨架结合蛋白的精密调控[9,12]。研究[13]表明,肿瘤微环境中高表达的IL-10能够抑制DCs的分化成熟和免疫学功能,因此,研究IL-10对mDCs细胞骨架结构及其结合蛋白表达和定位的影响对于深入研究肿瘤细胞的免疫逃逸机理具有重要意义。
图4 免疫荧光分析mDCs细胞骨架结合蛋白的定位情况 ×630
Fascin-1是一种结构独特的细胞骨架结合蛋白,定位于肌动蛋白束的核心,通过与F-actin结合能够使细胞形成丝状、片状伪足及微棘,参与细胞黏附、迁移以及信号转导等,与细胞形态、迁移能力、应力纤维以及DCs的抗原提呈功能等具有密切联系。丝切蛋白Cofilin是一种高度保守的蛋白,同样能够与F-actin结合,使磷酸化的Cofilin失去活性。Cofilin可结合在微丝的负端使微丝解聚,在微丝快速组装和去组装的结构中具有重要的作用,涉及细胞的黏附、迁移和内吞等功能。本实验用IL-10处理mDCs 48 h后,DCs的F-actin表达量上升,丝状伪足的数量和长度有增加的趋势(图2),而且细胞骨架结合蛋白Fascin-1和p-Cofilin的表达量上调,Cofilin的表达量略有降低(图3),而且在细胞中的定位也发生明显变化,表明细胞骨架在此过程中发生了重组。
DCs是免疫细胞中最活跃的成员之一,存在imDCs和mDCs两种不同的功能状态,imDCs表面的突起短小而稀疏,而当其捕获抗原并成熟后,其细胞体积增大,突起变长且密度增加,细胞骨架发生了明显的变化。本课题组的前期研究[14]结果表明,在DCs两种不同的分化阶段,其生物物理学特性存在明显的差异:膜流动性、渗透脆性、电泳迁移率及细胞的变形能力均有所变化。由此可见,细胞骨架的重构与DCs的功能有着密切的关系。有研究[2,4,7,15]表明,细胞骨架的重构在DCs免疫作用过程中发挥了不可或缺的作用,包括吞噬、抗原提呈、迁移能力等。在肿瘤微环境中,DCs的运动能力下降,生物物理学特性受到损伤,其机制之一就是肿瘤微环境中的多种成分可以改变细胞骨架的结构[14-15]。因此,推测IL-10影响骨架结合蛋白的表达和定位,使细胞F-actin含量以及丝状伪足的数量和长度发生改变。mDCs的细胞骨架发生重构,打破了细胞骨架结合蛋白的平衡,直接影响mDCs的免疫学功能,这也可能是肿瘤细胞逃脱免疫监视的一种重要方式。

