siRNA-SRF对人肺癌A549增殖和侵袭的影响
华海侠 赵敏 顾涛 付占昭 白立立 刘瑞吉
研究表明,血清应答因子(serum response factor,SRF)在癌组织中高表达,伴随着E-钙粘蛋白(E-cadherin)、β-catenin(β-连环蛋白)表达的下调,与浸润深度和淋巴结转移关系密切,提示SRF可能是肿瘤侵袭和转移的重要调控机制之一[1]。SRF调控基因表达的主要信号转导通路有两条:一是与增殖有关的有丝分裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号,另外一条调控通路是Rho信号依赖的肌动蛋白的细胞动力学改变,提示SRF与肿瘤细胞增殖和细胞动力学改变可能有一定的关联[2]。因此本研究拟采用RNA干扰技术,构建多条特异性的针对SRF的siRNA并转染入肺癌A549细胞,采用realtime PCR筛选出干扰效率最高的siRNA-SRF。采用CCK-8法、流式细胞检测、侵袭实验、westernblot等方法,观察SRF表达的下调与细胞增殖和侵袭转移的关系,进一步研究SRF在肺癌细胞增殖、侵袭转移中的分子机制。
1 材料与方法
1.1 材料 A549细胞株购自于中科院上海细胞库;siRNA构建及合成购自于上海吉玛制药技术有限公司;细胞培养相关耗材耗材购自于广州洁特生物过滤制品有限公司;CCK-8细胞增殖试剂盒(日本同仁化学研究所);SRF一抗(sc-335,美国Santa Cruz公司);Trizol及PCR相关试剂(美国Invitrogen公司);免疫组化试剂盒(北京中杉金桥生物技术有限公司)。
1.2 方法
1.2.1 细胞转染:由上海吉玛制药技术有限公司设计并合成4条针对SRF基因的小干扰RNA(small interfering RNA,siRNA),各组基因序列详为:①SRF-900:sense:5’-GCCGCGUGAAGAUCAAGAUTT-3’,anti-sense:5’-AUCUUGAUCUU CACGCGGCTT-3’;②SRF-951:sense:5’-CGACCUUCAGCAAGAGGAATT-3’,anti-sense:5’-UUCCUCUUGCUCAAGGUCGTT-3’;③SRF-1107:sense:5’-GCAAGGCACUGAUUCAGACTT-3’,anti-sense:5’-GUCUGAAUCAGUGCCU UGCTT-3’;④SRF-1649:sense:5’-GCCACCAUCAUGACGUCAUTT-3’,anti-sense:5’-AUGACGUCAUGAUGGUGGCTT-3’;⑤阴性对照:sense:5’-UUCUCCGAACGUGUCACGUTT
-3’,anti-sense:5’-ACGUGACACGUUCGGA GAATT-3’。调整细胞密度至次融合状态(汇合率70%~80%),0.2% FBS同步化24 h,按照上海吉玛制药技术有限公司《RNA产品使用手册》进行转染,转染条件为siRNA∶RNAi-Mate为1∶3。实验分组:①空白对照组;②转染组:加入针对SRF的siRNA及转染剂siRNA-Mate;③转染对照组:仅加入与转染组等剂量的转染剂siRNA-Mate;④阴性对照组:加入针对阴性对照的siRNA及转染剂siRNA-Mate。
1.2.2 CCK-8法检测细胞增殖:调整细胞密度为1×104/孔种植于96孔板,次融合后同步化24 h,按照实验设计分组(每组10孔),48 h后加入10 μl/孔 CCK-8,37℃培养箱中培养3 h,酶标仪450 nm测定A值,计算抑制率(抑制率=1-试验组A值/空白对照组A值×100%)。
1.2.3 免疫细胞化学染色:按照文献[3]方法制备细胞爬片,按实验设计分组转染,24 h后4%多聚甲醛固定1 h。采用枸盐酸高压修复,一抗过夜(SRF稀释浓度为1∶100),按照SABC免疫组化试剂盒说明书进行,DAB显色,苏木素轻度复染,中性树胶封片。
1.2.4 流式细胞术检测细胞周期:按实验设计分组并诱导,48 h后,制备单细胞悬液,调整细胞密度至1×106/ml。70%乙醇44℃固定过夜,离心弃上清,PBS漂洗3次。加入200 μl 1 mg/ml RNA酶37℃处理30 min。加入400 μl 10 mg/ml PI工作液,避光染色30 min,上机检测。
1.2.5 基质胶侵袭实验检测侵袭能力收集细胞:离心重悬调整细胞密度为1×105cell/ml,在transwell小室上层加入200 μl单细胞悬液,下室沿侧壁加入600 μl含10%胎牛血清的1640培养基。37℃,5% CO2培养24 h。取出小室,小心去除滤膜表面未穿膜的肿瘤细胞。95%乙醇固定,吉姆萨染色。镜下计数侵袭细胞数,取5个视野的平均值。以侵袭细胞的相对数目反映细胞的侵袭能力。
1.2.6 Western blot检测蛋白表达:RIPA裂解细胞,收集上清12 000 g离心15 min,收集上清,分装冰冻保存。BCA法测定蛋白浓度,按30~50 μg蛋白/泳道上样并常规电泳、转膜,SRF一抗(1∶100)4℃过夜,二抗37℃孵育1 h,加入BCIP/NBT显色并扫描。采用Image J图像分析软件测定条带的OD值,各组蛋白经内参平衡后,采用与对照组的比值作为该蛋白的相对表达量。
1.2.7 Realtime PCR法检测mRNA的含量:Trizol提取总RNA,SRF、内参基因GAPDH引物由上海生工生物工程技术服务有限公司设计合成,分别为SRF:5’-CTTAACATGGCATCTTCGACACT-3’,5’-CTTAACCTC
TAATCCCCATTGCT-3’;GAPDH:5’-GGGAAACTGTGG
CGTGAT-3’,5’-TGGGTGTCGCTGTTGAA GT-3’。反应条件:逆转录反应(37℃ 15 min,8℃ 5 s),PCR反应(95℃预变性30 s,95℃变性5 s,58℃退火30 s,72℃延伸30 s,共30循环),由RCR仪自带程序进行分析(2-ΔΔCT法)。
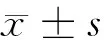
2 结果
2.1 siRNA-SRF对A549细胞mRNA表达的影响 Realtime PCR结果显示,对肺癌A549给予siRNA-SRF干扰后,4条siRNA均能下调SRF mRNA的表达,siRNA-SRF-900、siRNA-SRF-901、siRNA-SRF-1107、siRNA-
SRF-1649分别是对照组的56.4%、36.4%、25.0%和53.6%,相应的沉默效率分别为43.6%、63.6%、75.0%和46.3%,差异有统计学意义(F=66.042,P<0.05)。转染对照组、阴性对照组表达水平是空白对照组的94.5%和93.7%,差异无统计学意义(P>0.05)。其中siRNA-SRF-1107基因沉默效率最高,为75.0%。因此选用siRNA-SRF-1107进行后续实验研究。见表1。
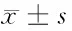

组别SRF mRNA空白对照组1.07±0.09转染对照组1.10±0.14阴性对照组1.07±0.15siRNA-SRF-9000.54±0.07*#△siRNA-SRF-9010.36±0.05*#△siRNA-SRF-11070.25±0.12*#△siRNA-SRF-16490.52±0.04*#△
注:与空白对照组比较,*P<0.05;与转染对照组比较,#P<0.05;与阴性对照组比较,△P<0.05
2.2 siRNA-SRF对A549细胞SRF蛋白表达的影响 SRF定位于肺癌A549细胞核内,予以siRNA-SRF-1107干扰后,SRF染色强度明显减弱。Western blot检测显示,予以siRNA-SRF-1107干扰后,转染组的SRF表达水平明显下调,是空白对照组的40.1%,差异具有统计学意义(F=142.735,P<0.05)。而阴性对照组和转染对照组表达水平与空白对照组差异无统计学意义(P>0.05)。见图1、2,表2。

图1 siRNA对A549细胞株SRF蛋白表达的影响(免疫细胞化学×200);A 空白对照组;B 阴性转染组;C 转染对照组;D siRNA-SRF转染组

图2 siRNA对A549细胞株SRF蛋白表达的影响(免疫印迹);A 空白对照组;B 阴性转染组;C 转染对照组;D siRNA-SRF转染组
2.3 siRNA-SRF对肺癌A549细胞增殖、细胞周期的影响 转染48 h以后,空白对照组、转染对照组、阴性对照组和转染组的OD值分别为(1.784±0.326)、(1.663±0.141)、(1.738±0.261)和(0.638±0.170)。转染入siRNA-SRF-1107后,A549细胞株增殖明显受限,抑制率为64.24%,与空白对照组相比,差异有统计学意义(P<0.05)。阴性对照组和转染对照组与空白对照组之间比较,细胞增殖抑制率分别为2.58%和6.78%,差异无统计学意义(P>0.05)。流式细胞仪检测空白对照组、转染对照组、阴性对照组和转染组细胞周期。各组S期细胞百分比分别为(44.72±0.60)%、(43.24±2.97)%、(43.73±1.41)%、(23.90±1.94)%。空白对照组、阴性对照组和转染对照组在G0/G1、S、G2期百分比方面差异无统计学意义(P>0.05)。而转染siRNA-SRF-1107后,A549细胞株S期百分比明显减少(P<0.05)。见表2、3。
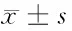

组别SRF蛋白表达水平细胞增殖空白对照组0.51±0.051.784±0.326转染对照组0.48±0.081.663±0.141阴性对照组0.47±0.151.738±0.261siRNA-SRF-11070.20±0.06*#△0.638±0.170*#△
注:与空白对照组比较,*P<0.05;与转染对照组比较,#P<0.05;与阴性对照组比较,△P<0.05
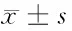

组别细胞周期(S)细胞侵袭空白对照组44.72±0.60144.83±17.42转染对照组43.24±2.97147.17±12.35阴性对照组43.73±1.41136.83±15.28siRNA-SRF-110723.90±1.94*#△60.50±14.21*#△
注:与空白对照组比较,*P<0.05;与转染对照组比较,#P<0.05;与阴性对照组比较,△P<0.05
2.4 siRNA-SRF对肺癌A549细胞侵袭能力的影响 通过transwell小室侵袭实验,检测空白对照组、转染组、阴性对照组和转染对照组的细胞侵袭能力,显微镜下计数侵袭细胞数,分别为(144.83±17.42)、(147.17±12.35)、(136.83±15.28)、(60.50±14.21),与空白对照组比较,siRNA-SRF-1107组侵袭细胞数明显减少(P<0.05),而阴性对照组和转染对照组与空白对照组比较,差异无统计学意义(P>0.05)。
3 讨论
体内研究多发现,SRF的高表达与E-cadherin、β-catenin的缺失(异位)表达密切相关[4,5],亦与基质金属蛋白酶(MMP)-2、-9表达上调有关[6],且与肿瘤预后相关[7]提示E-cadherin的表达缺失和β-catenin的异位表达(从细胞膜到细胞核)破坏了细胞间的连接,同时伴有MMP蛋白表达的上调,使细胞获得了更高的运动性和侵袭性,这可能是SRF促进肿瘤细胞转移和侵袭的机制之一。体外研究则发现采用过表达技术上调肝癌细胞株SRF的表达,能够使细胞获得间质细胞表型,促进肿瘤细胞的迁移和侵袭,而基因沉默SRF则引起相反效应,细胞增殖受抑,细胞数量和活力减少,S期细胞百分比下调,同时细胞迁移和侵袭能力下降;采用SRF沉默能产生类似的效果[8-10]。在前列腺癌细胞中,SRF是雄激素受体的重要决定簇,缺少SRF将会抑制前列腺癌细胞的增殖[11,12]。而近年来的文献也提示,抑制SRF的转录能够有效抑制肿瘤细胞的侵袭和转移[13-15],提示针对SRF的基因沉默能够有效抑制肿瘤细胞的增殖和迁移。
本研究选择了沉默效果最高的siRNA-SRF-1107,有效的下调SRF在肺癌A549mRNA和蛋白的表达水平。利用CCK-8法检测细胞增殖,发现转染组细胞增殖明显受抑,而阴性对照组和转染试剂对照组对细胞增殖无影响,进一步提示设计的siRNA特异性和靶向性强,采用的脂质体转染法对细胞增殖无影响。同时使用流式细胞仪检测细胞周期,发现转染组细胞被阻滞在G1期,提示SRF可能在A549细胞株中调控细胞周期,与肺癌细胞增殖密切相关。进一步检测细胞侵袭能力发现,转染的细胞侵袭能力明显下降,提示SRF mRNA和蛋白水平的下调能够减少肺癌A549细胞的侵袭能力。
综上所述,结合前期在体内实验结果,本研究提示基因沉默SRF,能够抑制肺癌A549的增殖,并降低其侵袭能力,SRF可能是防治肺癌治疗的一个有效靶点。

