褐球固氮菌在全红苋菜和小白菜叶际的定殖及其促生长效应
王燚凡 杨俊卿 吕耀 徐智敏 李取生

摘要:通过土培盆栽试验,研究了叶面接种褐球固氮菌(Ac63)在全红苋菜(Amaranthus tricolor L.)和小白菜(Brassica campestris L.)叶际的定殖与促生效果,评估了在贫/富氮土培养且不/喷施接种Ac63处理下作物地上部生物量、叶绿素a和b含量及叶片总氮含量的变化,设计了Ac63的nifD基因特异性引物并通过qPCR分析其在叶际的丰度。结果表明,接种Ac63明显促进了贫氮土培养的全红苋菜地上部生物量、叶绿素a、b含量及叶片总氮含量增加(P<0.05),但对富氮土培养的全红苋菜仅促进叶绿素a含量增加(P<0.05);接种Ac63对贫/富氮土培养的小白菜均无明显作用(P>0.05)。qPCR结果显示Ac63能定殖于全红苋菜叶际而不能定殖于小白菜叶际;此外土壤速效氮可能通过增加叶片氮含量在一定程度上抑制了Ac63在全红苋菜的定殖数量及促生作用。说明固氮菌Ac63的叶际定殖具有作物选择性,对于能够定殖的作物具有良好固氮效果。
关键词:褐球固氮菌;叶际;定殖;qPCR
中图分类号:S182,X172文献标识码:A文章编号:1000-4440(2020)02-0336-07
Abstract:The colonization of nitrogen-fixing bacteria (Ac63) in the phyllosphere of Amaranthus tricolor L. and Brassica campestris L. and growth-promoting effects were studied. A pot experiment was carried out to evaluate the changes of aboveground biomass, chlorophyll a and b contents, and total nitrogen content in leaves under different treatments nitrogen-poor and nitrogen-rich soil culture with and without spraying Ac63. The nifD-specific primers of Ac63 were designed, and their abundance in leaves was analyzed by qPCR. Results showed that inoculation with Ac63 could significantly promote the aboveground biomass, chlorophyll a and b contents, and total nitrogen content of A. tricolor L. cultured in nitrogen-poor soil (P<0.05). However, it only increased the chlorophyll a content of A. tricolor L. cultured in nitrogen-rich soil (P<0.05). Inoculation with Ac63 had no significant effect on B. campestris L. cultured in nitrogen-poor and nitrogen-rich soil (P>0.05). The qPCR results revealed that Ac63 could colonize in the phyllosphere of A. tricolor L. but not in the phyllosphere of B. campestris L. In addition, the soil available nitrogen could inhibit the colonization and growth of Ac63 in A. tricolor L. by increasing the nitrogen content of leaves to some extent. It is indicated that the phyllosphere colonization of nitrogen-fixing bacteria Ac63 has crop selectivity, and it has a good nitrogen fixation effect on the crop that can be colonized.
Key words:Azotobacter chroococcum;phyllosphere;colonization;qPCR
氮素在作物产量和品质形成中起着重要作用,但过度施氮会造成农田土壤板结、水体富营养化等环境问题[1-2]。生物固氮能为陆地生态系统提供每年195 Tg的氮输入,其中约32 Tg进入农业系统[3]。微生物肥料是代替化学氮肥的有效手段,非共生固氮菌是微生物肥料的重要组成部分,这类固氮菌能定殖在小麦和玉米等非豆科作物根际,从而促进作物的生长[4]。其主要接种方式为根际灌施,但复杂的土壤环境及菌株间竞争可能影响非共生固氮菌的根际定殖效果,在一定程度上制约了非共生固氮菌菌剂的推广应用[5]。
相比于土壤环境,叶际生理环境及菌群结构相对简单。有研究者发现叶际微生物能为宿主植物提供10%~25%的氮[6]。在叶面接种固氮菌Azosprillum brasilense能显著增加油菜、玉米和小麥的产量[7-8]。在叶面接种固氮菌Klebsiella variicola W12能增加玉米茎叶的氮含量[9]。在叶面喷施接种非共生固氮菌并实现叶际定殖可能是微生物肥料推广应用的新思路。非共生固氮菌Azotobacter chroococcum具有较强的固氮和分泌植物生长激素的能力,其广泛分布于水稻、小麦和棉花等作物的叶际[10]。另外南方常见的高营养价值蔬菜苋菜(Amaranthus tricolor L.)和小白菜(Brassica campestris L.)需要通过大量施用氮肥实现高产,但过量的氮肥会使这2种作物的成品率下降及硝酸盐累积[11-13],目前还没有在这2种作物的叶际接种固氮菌的定殖研究。
目前测定叶际定殖菌株数量的方法主要为平板涂布法[9,14],操作过程繁琐且费时,若叶际原生菌株与目标菌株形态相近则可能会造成计数准确度较低。而实时荧光定量(qPCR)法具有反应快速、特异性强和灵敏度高的优点,被广泛应用于细菌定殖数量的检测[15]。建立叶际细菌qPCR测定方法有望能快速、稳定地评估其在叶际的定殖情况。
本研究选择菌株Azotobacter chroococcum CICC 22663(Ac63)作为研究对象,建立使用qPCR测定Ac63在作物叶际中定殖数量的方法,通过盆栽试验评估叶面接种Ac63对贫氮土或富氮土栽培下苋菜和小白菜的促生效果,以期能够为农作物的氮肥施用减量化提供理论指导。
1材料与方法
1.1供试材料
褐球固氮菌A. chroococcum 22663(Ac63)购于中国工业微生物菌种保藏管理中心(CICC),可用作固氮菌肥,菌株保存于4 ℃冰箱中备用。用于Ac63培养的固氮培养基(液体)成分包括:酵母提取物0.50 g、甘露醇20.00 g、KH2PO4 0.20 g、K2HPO4 0.80 g、MgSO4·7H2O 0.20 g、CaSO4·2H2O 0.10 g、FeCl3 0.02 g、Na2MoO4·2H2O 0.02 g、去离子水1 L。选取全红苋菜(Amaranthus tricolor L.)及小白菜(Brassica campestris L.)为供试作物,种子购于江苏欢乐谷种业。
1.2Ac63在作物叶际定殖数量测定方法的建立
1.2.1引物设计采用qPCR方法测定Ac63在叶际的定殖。Ac63通过固氮酶将N2转化为铵,nifD基因编码Ac63的固氮酶钼铁蛋白的α链[16],因此基因的特异性序列可作为PCR扩增的靶标,通过qPCR特异性地评估Ac63在叶际的定殖数量。在NCBI中下载A. chroococcum的nifD基因的序列及与该序列相似度高但属于不同菌株的20组nifD基因的序列,利用MEGA7进行序列同源性比对,使用Oligo7软件根据比对得到的特异性序列设计特异性引物。
1.2.2引物特异性的验证为确保所设计的引物仅能评估作物叶际Ac63定殖数量,在GenBank进行引物primer-BLAST验证以确保引物特异性。对Ac63进行PCR验证:按照基因组提取试剂盒说明书提取Ac63基因组DNA,然后使用Ac63 nifD基因的特异引物对基因组进行PCR扩增。PCR体系(25 μl):12.5 μl PrimeSTAR Max Premix 2×(TAKARA,JAPAN),1.0 μl 正向引物(10 μmol/L),1.0 μl反向引物(10 μmol/L),1.0 μl DNA模板,9.5 μl DEPC水。PCR扩增条件:98 ℃变性10 s,55 ℃退火5 s,72 ℃延伸10 s,共35个循环。通过琼脂糖凝胶电泳确认扩增条带与预计产物大小相符,送上海生工公司进行测序及BLAST比对,确认特异性引物扩增的片段序列与设计序列相符。
1.2.3引物扩增效率的验证采用Ac63的nifD基因特异引物对含有Ac63 nifD基因片段的标准质粒(通过对Ac63的基因组进行PCR并克隆得到)进行qPCR以检测引物的扩增效率。qPCR体系(20 μl):10 μl SYBR Green PCR Mix(208054,QIAGEN),1 μl 正向引物(10 μmol/L),1 μl 反向引物(10 μmol/L),DNA(50 ng) 1 μl,DEPC水8 μl。qPCR程序:95 ℃預变性2 min;95 ℃变性5 s,55 ℃退火10 s,72 ℃延伸5 s,40个循环,随后以0.1 ℃/s的速度从65 ℃升至95 ℃。通过绘制熔解曲线和扩增曲线评估引物的扩增效率及特异性,将满足条件的引物作为测定Ac63叶际定殖数量的qPCR引物。
1.3土培盆栽试验
1.3.1供试土壤的采集与前处理用于盆栽试验的土壤采自广州市番禺区暨南大学南校区校内0~25 cm表层土。土壤的理化性质如下:pH 5.52,氨氮1.98 mg/kg、硝态氮1.26 mg/kg,速效磷2.54 mg/kg,速效钾66.10 mg/kg。新鲜土壤在阴凉处自然风干7 d,随后挑除大块石和植物残体,将土壤过2.0 mm(10目)筛备用。
1.3.2试验条件及处理试验设置的处理包括:每1 kg供试土壤以水溶液的形式施入KCl 95.4 mg(相当于钾50 mg)同时掺加过磷酸钙(含磷12%)833.3 mg(相当于磷100 mg)并混匀,该处理条件下的土壤称为贫氮土;每1 kg贫氮土再以水溶液的形式施入NH4NO3 57.1 mg(相当于氮20 mg),该处理条件下的土壤称为富氮土。选取全红苋菜(简称A)和小白菜(简称X)作为供试作物。每种作物分别设置4种处理:贫氮土培养,不接种Ac63(简称C)和喷施接种Ac63(简称P);富氮土培养,不接种Ac63(简称N)或喷施接种Ac63(简称NP)。各处理表示方式以作物简称+肥料处理简称命名,如AP代表全红苋菜在贫氮土培养并喷施接种Ac63。每种处理均设置3个花盆作为重复(共2×4×3=24盆)。
种子消毒及育苗:作物的种子在70%乙醇中表面消毒30 s,再在2%次氯酸钠中消毒3 min,然后用无菌水洗涤4次。消毒后的种子播种在含有未灭菌贫氮土的育苗板中,放置在白光16 h/d和(28±2 ) ℃的培养箱中育苗14 d,每天适当补水保湿。将长势相近的幼苗移栽至装有1.5 kg未灭菌的贫/富氮土的塑料花盆(直径20 cm)内,每盆移栽8株。
盆栽试验于2018年5月至7月在广州市番禺区暨南大学南校区的温室内进行(日均气温为27~33 ℃)。在移栽后每天进行浇水保湿,第5 d、10 d、15 d和30 d使用5 ml雾化喷壶对每组需要接种Ac63的处理组(P和NP处理组)的作物叶面喷施Ac63叶面接种剂5 ml(每盆接种约1.6 ml),不接种的处理组(C和N处理组)用5 ml无菌水代替。接种时土壤表面用铝箔覆盖,以避免接种剂进入土壤。Ac63叶面接种剂(>109CFU/ml)通过如下方式制备:Ac63接种固氮培养基(液体)后以28 ℃,180 r/min培养16 h,经6 000 r/min离心5 min后重悬于等体积无菌水中制成。
1.3.3作物收获与理化性质测定作物土培45 d后收获,分别剪取作物的根、茎和叶,称量同一盆内8株作物的茎叶总质量作为地上部鲜质量。采用Arnon光度法测定作物叶片中叶绿素a和叶绿素b含量[17]。采用国标LYT1269—1999的方法测定叶片总氮含量。需要进行Ac63定殖数量测定的叶片用液氮速冻并迅速转移至-80 ℃冰箱保存备用。
1.3.4作物叶际菌株Ac63定殖数量的评估将叶片从-80 ℃冰箱中取出并在液氮中研磨成粉末状,采用植物总DNA提取试剂盒(69104,QIAGEN) 提取叶片总DNA。通过琼脂糖凝胶电泳法测定DNA完整性,采用超微量分光光度计(Nanodrop One C,Thermo Fisher Scientific)测定DNA浓度,并使用DEPC水将DNA稀释至50 ng/μl。将方法1.2.3中确定的引物用于叶际DNA的qPCR扩增,扩增体系及程序同方法1.2.3。
1.4数据处理
采用Microsoft Excel 2016和SPSS 22.0进行数据平均值、标准差及方差分析计算;采用 SPSS Statistics 22.0 进行单因素方差分析(Turkey分析),P<0.05被认为组间有显著差异;采用Thonar等[18]的公式计算标准质粒的拷贝数,使用CFX manager 3.1软件进行qPCR计算并换算成每1 g叶片中nifD基因的拷贝数,确保引物或扩增条件达到绝对定量的标准(0.9
2结果与分析
2.1Ac63在叶际定殖数量测定方法的建立
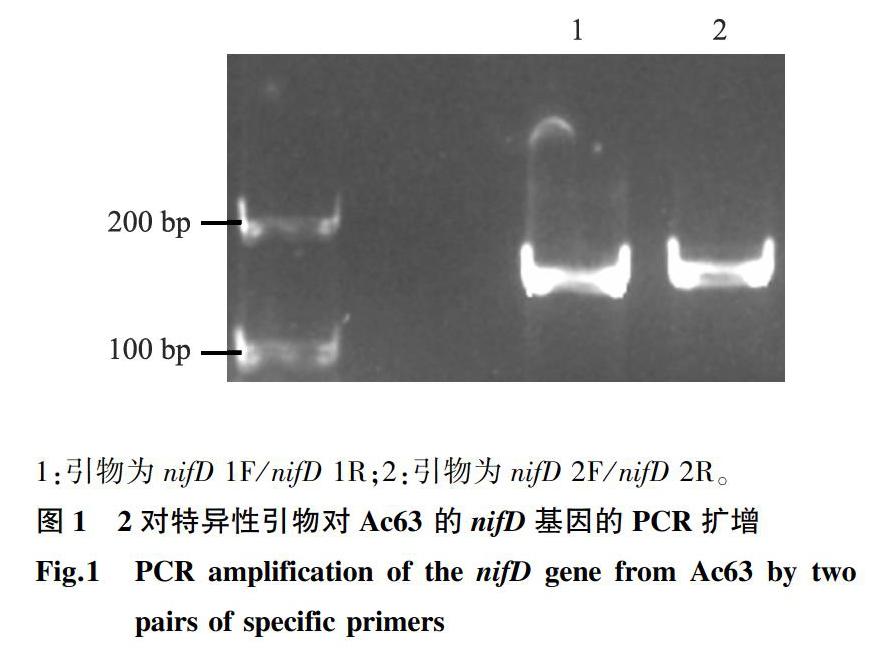
为实现对作物叶际Ac63定殖数量的测定,根据A. chroococcum nifD基因的特异序列设计了2对特异性引物,引物对的序列分别为nifD 1F:5′-TTACCCTGAGAAAGCCCGT-3′、nifD 1R: 5′-CCCTTGGAACCGGCGTAAG-3′及nifD 2F:5′-CCCTGAGAAAGCCCGTAAA-3′、nifD 2R: 5′-CCCTTGGAACCGGCGTAA-3′。BLAST比对结果显示,2对引物均只能扩增出A. chroococcum的nifD基因的片段。使用2对特异性引物对Ac63的基因组进行PCR扩增,电泳条带的大小均与设计大小一致,约为150 bp(图1)。测序结果验证了2对引物均能扩增出Ac63的nifD基因片段,但仅有nifD 1F/nifD 1R引物对的扩增效率(R2=0.99,E=98%)达到了绝对定量的标准。这表明引物对nifD 1F/nifD 1R及方法1.2.3的扩增条件可用于测定Ac63在叶际的定殖数量。
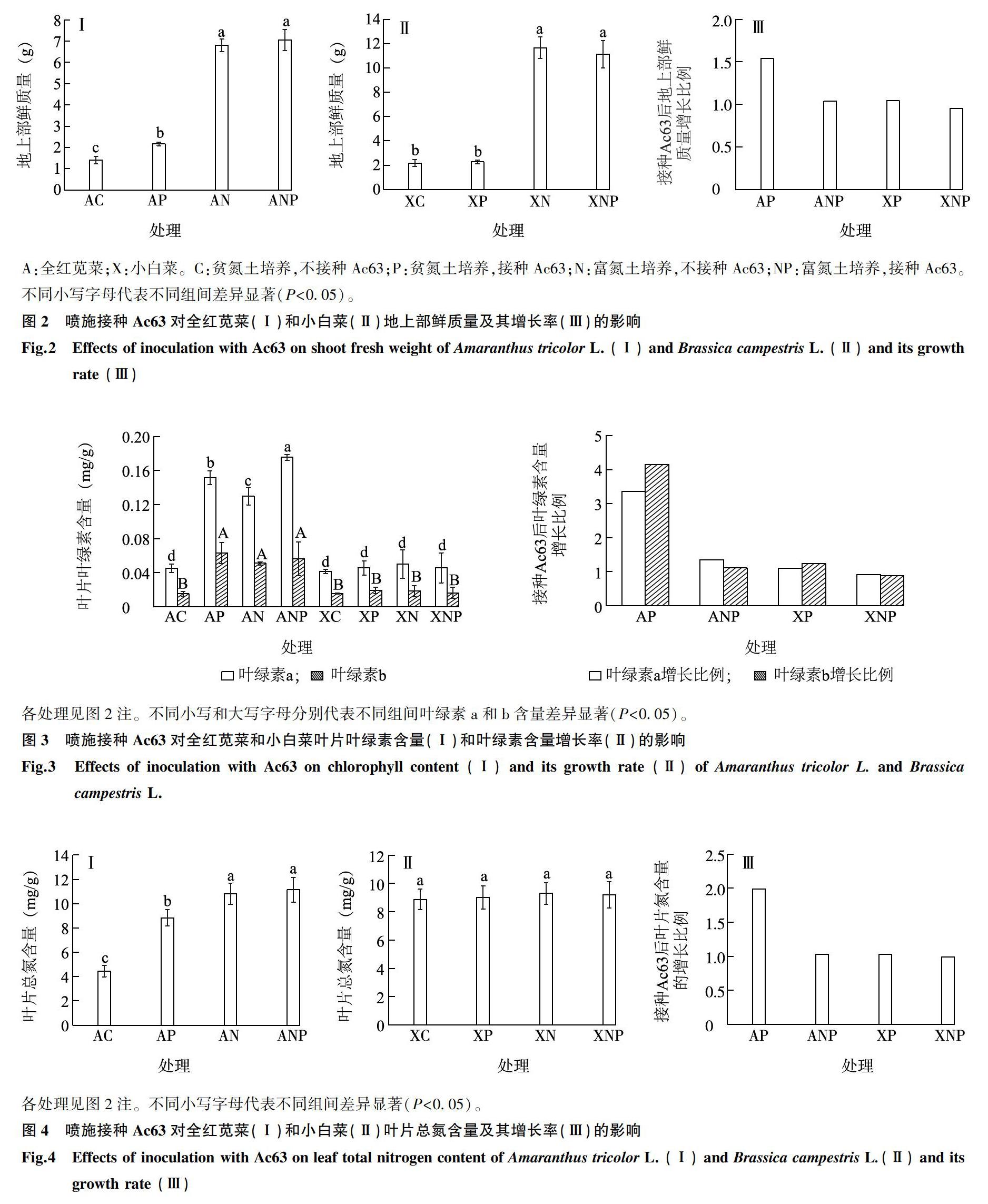
2.2叶面喷施接种Ac63对全红苋菜和小白菜生物量、叶绿素含量和叶片总氮含量的影响
如图2、图3、图4所示,在贫氮土中,喷施接种Ac63(AP处理)相比于不接种(AC处理)能显著增加全红苋菜的地上部鲜质量、叶绿素a、b含量和叶片总氮含量(P<0.05);在富氮土中,喷施接种Ac63(ANP处理)相比于不接種(AN处理)能显著增加全红苋菜叶绿素a含量(P<0.05),而对地上部鲜质量、叶绿素b含量及叶片总氮含量无显著影响(P>0.05)。这说明Ac63对全红苋菜有促生作用,但土壤速效氮的增加会降低Ac63对全红苋菜的促生效果。
无论在贫氮土或富氮土中,喷施接种Ac63(XP、XNP处理)相比于不接种(XC、XN处理)对小白菜的地上部鲜质量、叶绿素a、b含量和叶片的总氮含量的影响均无显著差异(P>0.05)。这说明Ac63对小白菜无明显促生作用。
贫氮和富氮土中,相比于不接种处理,喷施接种Ac63后全红苋菜地上部鲜质量、叶绿素a、b含量和叶片总氮含量的增长率均比小白菜高。这进一步说明接种Ac63对全红苋菜的促生作用较小白菜强。
2.3Ac63在全红苋菜和小白菜叶际的定殖情况
由于引物对nifD1F/nifD1R对Ac63的nifD基因具有较好的特异性,故叶际中nifD基因的丰度代表了Ac63的定殖数量。如图5所示,使用引物对nifD1F/nifD1R进行qPCR扩增的结果说明:贫氮土及富氮土中,全红苋菜叶面喷施接种Ac63后叶际nifD基因丰度分别达到1 g 7.27×105拷贝和6.34×105 拷贝,而小白菜叶面喷施接种Ac63后叶际nifD基因在贫/富氮土中均低于检出限。说明固氮菌Ac63能在全红苋菜的叶际定殖,而不能在小白菜的叶际定殖,Ac63在不同作物叶际定殖存在差异;另外在富氮土栽培条件下Ac63在全红苋菜叶际的定殖数量比贫氮土栽培条件下低,这可能是由于全红苋菜通过吸收土壤速效氮使得叶片中氮含量增加,进而抑制了Ac63的定殖。
3讨论
叶面接种Ac63显著提高了贫氮土培养的全红苋菜叶片总氮含量。有报道称固氮菌A. chroococcum利用固氮酶将空气中的N2固定为铵[19],在满足菌体自身氮需求后将多余的铵通过glnK-amtB操纵子分泌到胞外[20]。Ac63可能是通过固氮并分泌铵的方式使得全红苋菜叶片总氮含量增加。
喷施接种Ac63相比于不接种对全红苋菜有较显著的促生作用,而对小白菜无显著的促生作用。全红苋菜叶绿素含量及生物量上升的原因可能是叶片氮的增加促进了叶绿素的合成,同时叶绿素又是参与植物光合作用的一种主要色素[21],从而提高了作物的生物量。qPCR测定结果也显示Ac63能够在全红苋菜的叶际定殖,而不能在小白菜的叶际定殖。有报道称菌株与宿主植物的匹配度可能影响叶面接种固氮菌的定殖和促生效果[22]。最近的研究结果也表明Azosprillum brasilense叶面接种剂对不同作物的促生效果及定殖效果存在较大差异[7-8, 23]。这说明相比于在小白菜叶际,Ac63在全红苋菜叶际具有更强的环境适应力及微生物竞争力。
值得注意的是Ac63为何只在全红苋菜而不在小白菜的叶际定殖。叶际包括叶片表面及内部,叶际细菌首先通过形成生物膜定殖在叶面,随后部分细菌能从伤口或气孔侵入叶内实现更稳定的定殖[24]。细菌形成生物膜是叶际定殖的关键,如固氮菌P. stutzeri通过形成生物膜定殖在叶面[25]。部分关键的化学物质诱导了生物膜的形成,如沙拉叶片的渗出物中转铁蛋白能增强病原菌Salmonella enterica的铁载体合成,并促进菌株生物膜形成从而实现在沙拉叶面的定殖[26]。推测全红苋菜的叶面可能存在促进Ac63生物膜形成的物质,而小白菜叶面不存在。
目前仍不清楚Ac63是否侵入了叶内。有研究者发现使用绿色荧光表达质粒pHC60标记非共生固氮菌A. chroococcum(Azb19)后,菌株只能定殖在高粱的根表面而不能侵入根内[27]。申红妙等发现促生菌JL4-gfp在葡萄叶面及叶内均能定殖[14]。Peredo等通过原位熒光杂交技术发现植物促生菌Methylobacterium侵入了拟南芥的叶内并定殖在气孔的内壁[28]。A. chroococcum能否侵入叶内未见报道。
另外Ac63在贫氮土栽培的全红苋菜叶际定殖数量及Ac63对植物的促生效果显著高于富氮土栽培的,这可能由于土壤速效氮被作物吸收使得叶片氮含量增加,进而抑制了Ac63的促生效果及其在叶际的定殖能力。有研究者称施氮会降低甘蔗叶际内生固氮菌nifH基因的表达量[29]。Fuentes-Ramirez等也发现外源施加土壤速效氮会降低内生固氮菌G. diazotrophicus在甘蔗的定殖数量,并推测这是由于植物的生理状态改变造成的[30]。但目前还没有氮肥对固氮菌叶际定殖调控机制的报道。我们推测苋菜从土壤中吸收了更多的速效氮导致减少了对Ac63的定殖依赖。外源施加速效氮可能会影响固氮菌在叶际的定殖和促生能力,应考虑氮肥与固氮菌接种剂的配比。
综上所述,Ac63在全红苋菜和小白菜叶际的定殖能力存在较大差异,Ac63能够定殖于全红苋菜叶际并显著促进其生长,同时土壤速效氮含量在一定程度上会影响Ac63对作物的促生效果。研究结果为减少农业生产中化学氮肥施用量提供了可能性,也为发掘固氮菌Ac63在叶际定殖的机制奠定了基础。
参考文献:
[1]孙丽,马友华,何传龙,等. 巢湖流域减量施肥对番茄产量品质和土壤硝态氮的影响[J].中国农学通报,2011,27(25):250-255.
[2]CARPENTER S R,CARACO N F,CORRELL D L,et al. Nonpoint pollution of surface waters with phosphorus and nitrogen[J]. Ecological Applications,1998,8(3):559-568.
[3]GALLOWAY J N,DENTENER F J,CAPONE D G, et al. Nitrogen cycles:Past, present, and future[J]. Biogeochemistry,2004,70(2):153-226.
[4]SAIKIA S,JAIN V. Biological nitrogen fixation with non-legumes: An achievable target or a dogma?[J]. Current Science,2007,92(3): 317-322.
[5]BASHAN Y,DE-BASHAN L E,PRABHU S,et al. Advances in plant growth-promoting bacterial inoculant technology: formulations and practical perspectives (1998-2013) [J]. Plant and Soil,2014,378(1/2):1-33.
[6]BENTLEY B L,CARPENTER E J. Direct transfer of newly-fixed nitrogen from free-living epiphyllous microorganisms to their host plant[J]. Oecologia,1984,63(1):52-56.
[7]AHMADI-RAD S,GHOLAMHOSEINI M,GHALAVAND A,et al. Foliar application of nitrogen fixing bacteria increases growth and yield of canola grown under different nitrogen regimes[J]. Rhizosphere,2016,2:34-37.
[8]FUKAMI J,NOGUEIRA M A,ARAUJO R S,et al. Accessing inoculation methods of maize and wheat with Azospirillum brasilense[J]. AMB Express,2016,6(1):3.
[9]葛安辉,方萍,熊超, 等. 联合固氮菌叶面接种剂的优化及其在玉米叶际的定殖[J].微生物学通报,2018,45(6):1303-1313.
[10]RASHID A,MIR M R,HAKEEM K R. Biofertilizer use for sustainable agricultural production[M]. Cham,Springer:Plant,Soil and Microbes, 2016:163-180.
[11]杨佩,赵中华. 氮肥对小白菜生长及硝酸盐累积的影响[J].中国果菜,2017,37(10):20-23.
[12]黄小云,徐伟,苏唯,等. 氮肥施用对小白菜产量和品质的影响分析[J].农村经济与科技,2016,27(14):38-39.
[13]李卫泳,王志强,巩万合,等. 苋菜氮磷钾肥最佳用量试验[J].蔬菜,2015(2):29-31.
[14]申红妙,李正楠,贾招闪,等. 内生枯草芽孢杆菌JL4在葡萄叶上的定殖及其对葡萄霜霉病的防治[J].应用生态学报,2016,27(12):4022-4028.
[15]ZHANG Y,GAO X,WANG S,et al. Application of Bacillus velezensis NJAU-Z9 enhanced plant growth associated with efficient rhizospheric colonization monitored by qPCR with primers designed from the whole genome sequence[J]. Current Microbiology,2018,75(12):1574-1583.
[16]JACOBSON M,PREMAKUMAR R,BISHOP P. Transcriptional regulation of nitrogen fixation by molybdenum in Azotobacter vinelandii[J]. Journal of Bacteriology,1986,167(2):480-486.
[17]蘇正淑,张宪政. 几种测定植物叶绿素含量的方法比较[J].植物生理学通讯,1989(5):77-78.
[18]THONAR C,ERB A,JANSA J. Real-time PCR to quantify composition of arbuscular mycorrhizal fungal communities-marker design,verification,calibration and field validation[J]. Molecular Ecology Resources,2012,12(2):219-232.
[19]ROBSON R L,JONES R,ROBSON R M,et al. Azotobacter genomes:the genome of Azotobacter chroococcum NCIMB 8003 (ATCC 4412)[J]. PLoS One,2015,10(6):e0127997.
[20]RADCHENKO M V,THORNTON J,MERRICK M. Control of AmtB-GlnK complex formation by intracellular levels of ATP,ADP,and 2-oxoglutarate[J]. Journal of Biological Chemistry,2010,285(40):31037-31045.
[21]BOJOVIC B,MARKOVIC A. Correlation between nitrogen and chlorophyll content in wheat(Triticum aestivum L.)[J]. Kragujevac Journal of Science,2009,31:69-74.
[22]HUANG H,BREMER E,HYNES R,et al. Foliar application of fungal biocontrol agents for the control of white mold of dry bean caused by Sclerotinia sclerotiorum[J]. Biological Control,2000,18(3):270-276.
[23]方萍,张丽梅,贾小明,等. 固氮螺菌(Azosprillum brasilense)NO40在红壤性水稻土上的接种效应[J].浙江大学学报(农业与生命科学版),2001,27(10):35-38.
[24]POTNIS N,TIMILSINA S,STRAYER A,et al. Bacterial spot of tomato and pepper:Diverse X. anthomonas species with a wide variety of virulence factors posing a worldwide challenge[J]. Molecular Plant Pathology,2015,16(9):907-920.
[25]KASTELEIN P,KRIJGER M,CZAJKOWSKI R,et al. Development of Xanthomonas fragariae populations and disease progression in strawberry plants after spray-inoculation of leaves[J]. Plant Pathology,2014,63(2):255-263.
[26]KOUKKIDIS G,HAIGH R,ALLCOCK N,et al. Salad leaf juices enhance Salmonella growth,colonization of fresh produce,and virulence[J]. Appl Environ Microbiol,2017,83(1):2416.
[27]SULTANA U,DESAI S,REDDY G. Successful colonization of roots and plant growth promotion of sorghum(Sorghum bicolor L.)by seed treatment with Pseudomonas putida and Azotobacter chroococcum[J]. WJ Microbiol,2016,3:43-49.
[28]PEREDO E L,SIMMONS S L. Leaf-FISH:Microscale imaging of bacterial taxa on phyllosphere[J]. Frontiers in Microbiology,2018,8:2669.
[29]李佳慧,袁丹,陆建明,等. 氮肥对甘蔗叶片内生固氮菌nifH基因表达的影响[J].生物技术通报,2017,33(7):100-106.
[30]FUENTES-RAMIREZ L E,CABALLERO-MELLADO J,SEPULVEDA J,et al. Colonization of sugarcane by Acetobacter diazotrophicus is inhibited by high N-fertilization[J]. FEMS Microbiology Ecology,1999,29(2):117-128.
(责任编辑:张震林)

