江苏地区奶牛场blaNDM阳性大肠杆菌的分子流行病学
王警 张雪寒 郭芸芸 张碧成 吴庆侠 何孔旺


摘要:為了调查江苏地区奶牛场大肠杆菌中blaNDM基因的分子流行病学特征。从江苏部分地区3个奶牛场采集样品134份,使用PCR和测序的方法筛选blaNDM阳性大肠杆菌,同时对其进行超广谱β-内酰胺酶类基因的检测,采用药敏试验检测blaNDM阳性大肠杆菌对19种常用抗生素的敏感性,通过多位点序列分型(MLST)和脉冲场凝胶电泳(PFGE)对携带NDM基因的大肠杆菌进行亲缘关系分析,通过质粒结合试验验证blaNDM基因的可转移性。结果显示,从134份奶牛场样品中共分离15株blaNDM阳性大肠杆菌,包括NDM-1和NDM-5 2种变体。15株blaNDM阳性大肠杆菌对多种抗生素均呈现不同程度的耐药,奶牛场15株blaNDM阳性大肠杆菌包括7种ST型,分别是ST410、ST846、ST206、ST101、ST1642、ST3076、ST1626,同一种ST型在粪便样品和环境样品中同时存在,表明相同ST型blaNDM阳性大肠杆菌可在动物与环境间相互传播。PFGE试验结果表明,15株blaNDM阳性大肠杆菌可以分为11个簇,同一样品的分离株倾向于相同的簇,在比较小的范围内存在PFGE图谱相同的现象;对15株菌株的结合子进行blaNDM基因的转移性试验结果表明,15株大肠杆菌的blaNDM耐药基因均通过质粒结合转移至受体菌J53。表明,blaNDM阳性大肠杆菌在江苏省部分地区奶牛场中流行相对较为严重,存在多重耐药现象,推测blaNDM基因主要通过质粒结合转移的方式进行水平传播,这为食品源耐药菌的监测及风险评估提供了依据。
关键词:NDM耐药基因;大肠杆菌;多位点序列分型;药敏试验
中图分类号:S852.61+2文献标识码:A文章编号:1000-4440(2020)02-0391-07
Abstract:To investigate the epidemiology and molecular characteristics of blaNDM gene in Escherichia coli from dairy farms in Jiangsu province, a total of 134 samples were collected from three dairy farms in Jiangsu province. The blaNDM-positive E. coli was screened using PCR and sequencing, and the extended-spectrum β-lactamase gene was detected. The antimicrobial susceptibility testing was used to detect the sensitivity of blaNDM-positive E. coli to 19 commonly used antibiotics. The genetic relationship of E. coli carrying NDM gene was analyzed by multi-locus sequence typing (MLST) and pulsed-field gel electrophoresis (PFGE). The transferability of blaNDM gene was verified by conjugation experiments. The results showed that fifteen strains of blaNDM-positive E. coli were isolated from 134 dairy samples, including NDM-1 and NDM-5. All fifteen strains of blaNDM-positive E. coli exhibited different resistance to multiple antimicrobials and belonged to seven STs, namely ST410, ST846, ST206, ST101, ST1642, ST3076, ST1626. The same ST was involved in both fecal and environmental samples, indicating that blaNDM-positive E. coli with the same type of ST could be transmitted from animals to environment. The results of PFGE showed that fifteen strains of blaNDM-positive E. coli could be divided into 11 clusters, isolates of the same sample tended to have the same PFGE cluster, and the same PFGE pattern existed in a relatively small range. The blaNDM gene of fifteen strains of E. coli was transferred to receptor bacterium J53 by binding with plasmids. The blaNDM-positive E. coli is relatively more prevalent in dairy farms in Jiangsu, and there is multi-drug resistance. The blaNDM gene is mainly transmitted by means of combined transfer, which provides a basis for monitoring and risk assessment of drug-resistant bacteris.
Key words:drug-resistant gene NDM;Escherichia coli;multi-locus sequence typing(MLST);antimicrobial susceptibility testing
新德里金属β-内酰胺酶(NDM)能够水解除单环β-内酰胺酶类外的所有金属内酰胺酶(MBL)[1-2],包括碳青霉烯酶。碳青霉烯酶是治疗许多革兰氏阴性细菌引起的严重感染的主要抗微生物剂[3-4],是在临床治疗中的最后一道防线。目前临床上无法获得NDM酶水解内酰胺类药物的抑制剂,包括克拉维酸,他唑巴坦和舒巴坦。NDM-1最初是在2008年从印度新德里住院的瑞典患者中分离出的肺炎克雷伯菌中鉴定出来的,此后陆续在肠杆菌科、不动杆菌属和假单胞菌的各种物种中发现NDM-1,并已鉴定出24种NDM变体,其中肺炎克雷伯菌和大肠埃希菌是blaNDM基因主要携带者,对于大肠杆菌,其ST410、ST167、ST617是最流行的[5]。NDM阳性菌株已在世界范围内传播并被发现,在印度次大陆,中东和巴尔干各岛地区的流行率最高,对临床管理和公共卫生构成了重大挑战[6-7]。
不仅在医院,这种携带blaNDM基因的菌株在社区和环境中也有发现。近些年来,已在食品源动物、伴侣动物、野生动物中发现NDM阳性菌[8]。2017年Wang等[9]对肉鸡产业链中blaNDM基因进行流行病学调查研究,发现NDM阳性大肠杆菌来源于商品鸡场,并可在商品鸡场的鸡、狗、人、家燕和苍蝇等不同生物间传播。2019年Liu等[10]在鹅场的水样中发现了ST48型的携带blaNDM-5的大肠杆菌,这是第一次在水禽环境中发现NDM阳性大肠杆菌。2017年He等[11]首次在江苏省奶牛粪便和生牛乳中发现携带blaNDM-5的肺炎克雷伯菌。在国外,2013年Ghatak等[12]在牛奶样品中发现了携带有blaNDM的大肠杆菌,同年欧洲科学家分别在野生鸟类和宠物狗中分离得到NDM阳性沙门氏菌和NDM阳性大肠杆菌[13-14]。这些都表明伴侣动物和食品动物已成为携带blaNDM 的细菌储库,对公共卫生安全造成潜在威胁。
对于NDM阳性细菌来说,优势克隆菌株的扩散传播或质粒在动物、动物性食品和人之间进行快速传播是导致NDM基因流行的主要分子机制。中国作为食品动物大国,加强对食品源动物中碳青霉烯酶耐药基因NDM流行状况的监测显的尤为重要,对国家控制细菌耐药性具有重要的意义。本研究从江苏部分地区奶牛场中采集样品,分离碳青霉烯酶耐药大肠杆菌,对blaNDM耐药基因在食品动物源大肠杆菌中的流行状况和传播特征进行了调查研究。
1材料与方法
1.1样品和菌株来源
2018年6月从江苏淮安2个奶牛养殖场采集样品104份,包括粪便样品和环境样品,2018年5月在徐州某奶牛养殖场采集粪便样品和环境样品共30份,其中环境样品包括皮肤擦拭子和环境水样品。3个奶牛养殖场均使用过β-内酰胺酶制剂来处理牛乳腺炎,例如阿莫西林和头孢噻呋。大肠埃希菌ATCC25922和J53均由江苏省农业科学院农产品质量安全与营养研究所何涛博士提供。
1.2主要试剂及培养基
头孢噻呋、头孢他啶、亚胺培南、美罗培南和氨曲南均购自北京索莱宝科技有限公司,EC肉汤、麦康凯培养基、MH琼脂以及 MH肉汤购自青岛海博生物技术有限公司,PCRmix购自广州东盛生物技术有限公司,限制性核酸内切酶XbaⅠ购自大连宝生物工程(TaKaRa)有限公司,引物由南京金斯瑞生物科技有限公司合成。
1.3blaNDM阳性大肠杆菌的分离与鉴定
将粪便样品和环境擦拭子用PBS处理后,以1%的比例加入到100 ml含新生霉素的EC肉汤中37~40 ℃增菌8~12 h,然后在含有1 μg/ml美罗培南的麦康凯琼脂板上划线,37 ℃培养16~24 h,挑取平板上的红色单菌落用16S rRNA引物和微生物鉴定仪(Aris2×)来鉴定菌属,煮沸法制取模板。鉴定成功的大肠杆菌用PCR方法扩增blaNDM基因,NDM特异性引物按照参考文献[15]合成,对扩增的阳性NDM进行测序,测序结果使用DNAMAN软件进行比对确定NDM变体。
1.4耐药基因的检测
对携带有blaNDM基因的大肠杆菌进行其他ESBL类基因的检测,引物按参考文献[16]合成,分别检测了blaSHV、blaTEM、blaCTX-M-1、blaCTX-M-2、blaCTX-M-9、blaCTX-M-25、blaPER-1、blaPER-2、blaVEB、blaGES、blaKPC、blaOXA-2-group、blaOXA-10-group。
1.5毒力基因的检测
对携带有blaNDM基因的大肠杆菌进行相关毒力基因的检测,三重PCR检测stx1、stx2、hly基因,二重PCR检测stx2v、eae基因,引物由本实验室保存。
1.6药敏试验
按照美国临床试验室标准委员会CLSI(2013)推荐的琼脂稀释法测定大肠杆菌对临床感染常用的抗感染药物β-内酰胺酶类药物(头孢他啶、头抱噻呋、美罗培南、亚胺培南和氨曲南)以及四环素、氨基酸糖苷类药物(庆大霉素)、氟喹诺酮类(环丙沙星)等几类药物的敏感性。大肠埃希菌ATCC25922作为质控菌株,同时设MH肉汤为阴性对照。每株菌株做2个重复。操作步骤及结果判定按照标准药敏实驗标准进行。
1.7多位点序列分型(MLST)
本研究对15株blaNDM阳性大肠杆菌进行MLST分型,7对管家基因引物[17]详见表1,PCR扩增后进行琼脂糖凝胶电泳,再送南京思普金公司进行测序。把一代测序的结果参照E.coli MLST的数据库(https://pubmlst.org/bigsdb?db=pubmlst_escherichia_seqdef)进行分型。
1.8脉冲场凝胶电泳试验(PFGE)
参照美国CDC(Centers for disease control and prevention )Pusle Net大肠杆菌标准PFGE操作规程,对携带有blaNDM基因的大肠杆菌进行PFGE分型。
1.9质粒结合试验
使用膜接合转移的方法对blaNDM基因的传播方式进行验证,分别以携带blaNDM基因大肠杆菌和J53作供体菌和受体菌,用含 1 mg/L的美罗培南和100 mg/L的叠氮化钠的麦康凯平板筛选携带blaNDM基因阳性接合子,通过PCR方法验证结合子blaNDM基因是否被成功结合转移。
2结果
2.1NDM阳性大肠杆菌的分离与鉴定
2018年5月至6月在江苏省淮安市和徐州市奶牛场134份样品中共分离出15株blaNDM阳性大肠杆菌,经测序,并在DNAMAN上与24种NDM变体比对,发现包括NDM-1和NDM-5 2种变体(13株NDM-1,2株NDM-5),其中有5份来自环境样品,10份来自粪便样品。blaNDM样品阳性率达7.23%(9/134),blaNDM阳性大肠杆菌的阳性率为 25.00%(15/60)。
2.2耐药基因检测结果统计
对15株blaNDM阳性大肠杆菌进行13种ESBL类基因的检测,结果发现所有blaNDM阳性大肠杆菌携带一种或多种ESBL类基因,有1株从粪便样品中分出的菌株同时携带NDM基因和多黏菌素耐药基因mcr-1,由表2可知,环境样品比粪便样品含有ESBL类基因种类多。
2.3药敏试验
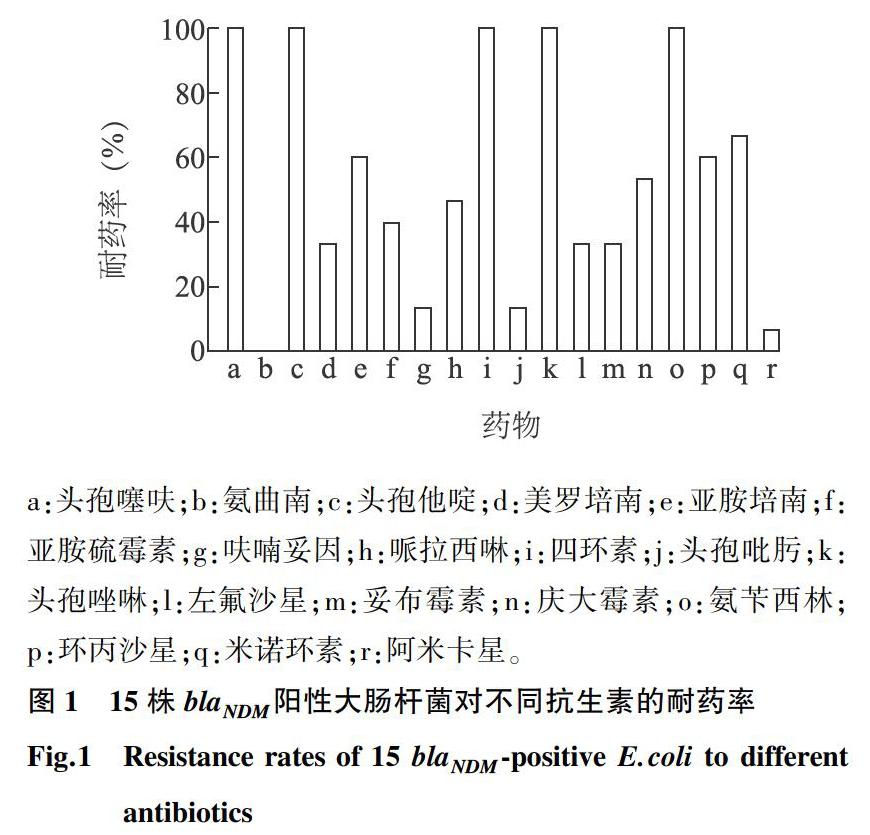
由图1可看出,15株blaNDM阳性大肠杆菌对头孢类(头孢噻呋、头孢他啶、头孢唑啉)、四环素、氨苄西林都呈现100%的耐药率,对氨曲南的耐药率为0;15株菌对β-内酰胺酶类药物美罗培南和亚胺培南的耐药率分别为33.3%(5/15)和60%(9/15),对亚胺培南的耐药率高于美罗培南;对氨基酸糖苷类药物庆大霉素、妥布霉素和阿米卡星的耐药率分别为53.3%(8/15)、33.3%(5/15)和6.7%(1/15);对四环素类抗生素米诺环素的耐药率达66.7%(10/15);对喹诺酮类药物环丙沙星和左氟沙星的耐药率分别为60%(9/15)和33.3%(5/15)。
2.4多位点序列分型结果
通过多位点序列分型将15株blaNDM阳性大肠杆菌共分成7种ST型,包括ST206(2株)、ST846(4株)、ST410(1株)、ST1626(1株)、ST101(1株)、ST3076(1株)、ST1642(1株),以ST206和ST846较为流行(表3)。
2.5PFGE分型结果
如图2所示,将15株blaNDM阳性大肠杆菌使用XbaⅠ酶进行PFGE分型,根据PFGE聚类结果,15株大肠杆菌可以分为11个簇,菌株1-28-139和菌株1-28-144具有相同的PFGE型别。菌株M3-1、M3-21和菌株M3-27具有相同的PFGE型别。菌株M1-41和菌株1-5-106具有相同的PFGE型别。其他8个型别分别只包含1株菌株。同一样品的分离株倾向于相同的PFGE型别,在小范围内存在相同的PFGE图谱。
2.6质粒结合试验
通过PCR方法对结合子进行blaNDM基因的验证,15株大肠杆菌的blaNDM耐药基因全部结合转移至大肠杆菌J53中。这表明NDM耐药基因可能会在不同的ST型大腸杆菌中以质粒转移的方式进行传播扩散。
3讨论
本研究对江苏省部分地区奶牛场的blaNDM耐药基因的流行状况及其传播规律进行了研究。本研究从3个不同的奶牛场共采集样品134份,其中blaNDM样品阳性率达7.23%(9/134),blaNDM阳性大肠杆菌的阳性率25.00%(15/60),主要流行NDM-1和NDM-5 2种变体,在粪便样品和环境样品中均检测到这2种变体的存在,表明blaNDM基因可能在动物体与环境间相互传播,并存在从动物向人群扩散的风险。blaNDM-5阳性大肠杆菌相比blaNDM-1阳性大肠杆菌对以美罗培南为代表的碳青霉烯酶类抗生素,MIC高出14倍,推测NDM-5变体的酶活性高于NDM-1,可诱导菌株产生更强的耐药能力;同时发现在环境样品分离的菌株中携带有比较多种类的β-内酰胺酶基因。
碳青霉烯酶类药物作为治疗肠杆菌科细菌感染效果最好的抗菌药物之一,治疗效果都好于三、四代头孢[18],从本研究结果看,blaNDM阳性大肠杆菌除对单环β-内酰胺酶类抗生素氨曲南耐药率为0外,几乎对所有的碳青霉烯酶类抗生素都表现为不同水平的耐药性,对头孢类药物已达到比较高的耐药水平,对亚胺培南和美罗培南的耐药率分别达60.0%和33.3%,这与报道一致[19]。不仅如此,15株blaNDM阳性大肠杆菌对氨基酸糖苷类药物、四环素类抗生素、喹诺酮类药物都有不同水平的耐药性;作为在兽医临床上使用率较高的药物,本研究中15种blaNDM阳性大肠杆菌对庆大霉素和环丙沙星的耐药率分别为53.3%和60.0%,这可能跟牛场的饲养管理有关,3个奶牛养殖场的养殖方式均是农户散养,饲养管理水平比较落后,使得奶牛源大肠杆菌存在多重耐药性,这也更有利于blaNDM基因从动物扩散到环境。
15株blaNDM阳性大肠杆菌共分成7种ST型,包括ST410、ST206、ST846、ST1626、ST101、ST3076、ST1642,奶牛场以ST206和ST846较为流行。除ST410外,其余都鲜少在奶牛中报道,只在人医临床中有报道。不同ST型对各种药物的最小抑菌浓度无明显差异,但当携带相同blaNDM基因时,大肠杆菌ST206对美罗培南MIC值比大肠杆菌ST846高出4倍。15株blaNDM阳性大肠杆菌使用XbaⅠ酶进行PFGE分型,根据PFGE聚类结果,15株大肠杆菌可以分为11个簇,小范围内存在相同的PFGE图谱[20-21]。从质粒结合转移试验结果中看出,15株大肠杆菌的blaNDM耐药基因可全部结合转移至大肠杆菌J53中,推测NDM耐药基因可在不同的ST型中以质粒转移的方式进行传播,为确定NDM耐药基因位于哪种质粒以哪种方式进行的传播,后续需要做S1-PFGE和Southernblot进行验证。
近年來,随着抗菌药物在人医临床及动物养殖中的广泛使用,多重耐药现象普遍存在。2017年世界经济全球风险报告指出,病菌对抗生素的耐药性己经成为人类健康的最大威胁之一,同时也给环境微生态平衡以及养殖产业的健康发展带来了巨大损害[22]。本研究通过在江苏部分地区奶牛场采集134份样品,分离到15株碳青霉烯酶耐药大肠杆菌,对blaNDM耐药基因在奶牛场的流行状况和传播特征进行了调查研究,为食品动物源blaNDM阳性大肠杆菌的流行病学调查研究提供依据,加强了兽医临床动物中blaNDM基因的流行监测,对控制耐药性的扩散具有重要意义。
参考文献:
[1]NORDMANN P, POIREL L, WALSH T R, et al. The emerging NDM carbapenemases[J]. Trends in Microbiology, 2011, 19(12):588-595.
[2]YONG D, TOLEMAN M A, GISKE C G, et al. Characterization of a new metallo-beta-lactamase gene, bla(NDM-1), and a novel erythromycin esterase gene carried on a unique genetic structure in Klebsiella pneumoniae sequence type 14 from India.[J]. Antimicrob Agents Chemother, 2009, 53(12):5046-5054.
[3]MARRS E C L, DAY K M, PERRY J D. In vitro activity of mecillinam against Enterobacteriaceae with NDM-1 carbapenemase[J]. Journal of Antimicrobial Chemotherapy, 2014, 69(10):2873-2875.
[4]NICOLAU DP. Carbapenems: a potent class of antibiotics[J]. Expert Opinion on Pharmacotherapy, 2008, 9(1):23-37.
[5]KHAN A U, MARYAM L, ZARRILLI R. Structure, genetics and worldwide spread of new delhi metallo-β-lactamase (NDM): a threat to public health[J]. BMC Microbiology, 2017, 17(1):101.
[6]MOELLERING R C J . NDM-1 - a cause for worldwide concern.[J]. N Engl J Med, 2010, 363(25):2377-2379.
[7]DORTET L, POIREL L, NORDMANN P. Worldwide dissemination of the NDM-type carbapenemases in Gram-negative bacteria[J]. Biomed Research International, 2014, 2014(350):249856.
[8]GUERRA B, FISCHER J, HELMUTH R. An emerging public health problem: acquired carbapenemase-producing microorganisms are present in food-producing animals, their environment, companion animals and wild birds[J]. Veterinary Microbiology, 2014, 171(3/4):290-297.
[9]WANG Y, ZHANG R M, LI J Y, et al. Comprehensive resistome analysis reveals the prevalence of NDM and MCR-1 in Chinese poultry production[J]. Nature Microbiology, 2017, 2:16260.
[10]LIU Z Y, XIAO X, LI Y, et al. Emergence of IncX3 plasmid-harboring blaNDM-5 dominated by Escherichia coli ST48 in a goose farm in Jiangsu, China[J]. Frontiers in Microbiology,2019,10:2002.
[11]HE T, WANG Y, SUN L C, et al. Occurrence and characterization of blaNDM-5-positive Klebsiella pneumoniae isolates from dairy cows in Jiangsu, China[J]. J Antimicrob Chemother, 2016, 72(1): 90-94.
[12]GHATAK S, SINGHA A, SEN A, et al. Detection of new delhi metallo-beta-lactamase and extended-spectrum beta-lactamase genes in Escherichia coli isolated from mastitic milk samples[J]. Transbound Emerg Dis,2013, 60(5): 385-389.
[13]FISCHER J, SCHMOGER S, JAHN S, et al. NDM-1 carbapenemase-producing Salmonella enterica subsp. enterica serovar Corvallis isolated from a wild bird in Germany[J]. J Antimicrob Chemother, 2013, 68(12):2954-2956.
[14]SHAHEEN B W, NAYAK R, BOOTHE D M. Emergence of a new delhi metallo-β-lactamase (NDM-1)-encoding gene in clinical Escherichia coli isolates recovered from companion animals in the United States[J]. Antimicrobial Agents & Chemotherapy, 2013, 57(6):2902-2903.
[15]周萌萌. NDM-4和NDM-5型金属β-内酰胺酶在肠杆菌科细菌中传播流行的分子机制[D].郑州:郑州大学,2017.
[16]GARREC H, DRIEUX-ROUZET L, GOLMARD J L, et al. Comparison of nine phenotypic methods for detection of extended-spectrum β-lactamase production by enterobacteriaceae[J]. Journal of Clinical Microbiology, 2011, 49(3):1048-1057.
[17]WIRTH T, FALUSH D, LAN R T, et al.Sex and virulence in Escherichia coli: an evolutionary perspective[J].Molecular Microbiology,2006,60(5):1136-1151.
[18]顾红燕. 我院住院病房2008-2010年碳青霉烯类抗生素应用分析[J]. 中国药房, 2011(22):35-37.
[19]JOHNSON A P, WOODFORD N. Global spread of antibiotic resistance: the example of New Delhi metallo-β-lactamase (NDM)-mediated carbapenem resistance[J]. Journal of Medical Microbiology, 2013, 62(4):499-513.
[20]CHENG P, LI F, YANG Y, et al. Prevalence and molecular epidemiology characteristics of carbapenem-resistant Escherichia coli in Heilongjiang province, China[J]. Infection and Drug Resistance,2019,12:2505-2518.
[21]朱家杭,蔡潤茂,卢跃溦,等. 家禽中blaNDM阳性大肠杆菌的筛查和传播特征分析[J].中国兽医学报,2019,39(9):1735-1743.
[22]孙坚,刘雅红,冯友军. 动物源细菌耐药性研究现状与对策[J]. 生物工程学报, 2018, 34 (8):51-63.
(责任编辑:陈海霞)

