骆马湖大银鱼、太湖新银鱼线粒体Cytb和CO Ⅰ基因序列多态性分析
李大命 唐晟凯 刘燕山


摘要:为了解江苏省骆马湖大银鱼(Protosalanx hyalocranius)和太湖新银鱼(Neosalanx taihuensis)遗传多样性水平,科学管理保护大银鱼和太湖新银鱼种质资源,利用线粒体DNA Cytb和CO Ⅰ基因序列作为分子标记,研究了骆马湖大银鱼和太湖新银鱼的遗传多样性。采用PCR扩增和序列测定获得长度为1 141 bp和630 bp的Cytb和CO Ⅰ基因序列。64条大银鱼Cytb基因序列检出10个多态性位点,定义9个单倍型,单倍型多样性和核苷酸多样性分别为0824±0.025和0.001 49±0.000 13,碱基平均差异数为1.696;64条大银鱼CO Ⅰ基因序列检出5个多态性位点,定义6个单倍型,单倍型多样性和核苷酸多样性分别为0.753±0.025和0.001 98 ±0.000 13,碱基平均差异数为1247。大银鱼遗传多样性具有高单倍型多样性和低核苷酸多样性特征。35条太湖新银鱼Cytb基因序列检出11个多态性位点,定义8个单倍型,单倍型多样性和核苷酸多样性分别为0.449±0.103和0.000 92 ±0.000 30,碱基平均差异数为1.045;35条太湖新银鱼CO Ⅰ基因序列检出5个多态性位点,定义6个单倍型,单倍型多样性和核苷酸多样性分别为0.361±0.103和0.000 62±0.000 20,碱基平均差异数为0.393。太湖新银鱼遗传多样性具有低单倍型多样性和低核苷酸多样性特征。大银鱼及太湖新银鱼的Cytb和CO Ⅰ基因单倍型间的遗传距离较小,分子系统进化树聚为一支,说明大银鱼和太湖新银鱼单倍型未出现遗传分化。大银鱼和太湖新银鱼的Tajimas D和Fus Fs中性检测结果为负值,且核苷酸错配分布图呈现单峰型,表明骆马湖大银鱼和太湖新银鱼进化历史上经历过种群扩张,研究结果为骆马湖银鱼资源可持续发展和利用提供了科学依据。
关键词:遗传多样性;细胞色素b基因;细胞色素c氧化酶亚基Ⅰ基因;大银鱼;太湖新银鱼;骆马湖
中图分类号: S917.4 文献标志码: A 文章编号:1002-1302(2020)11-0047-06
收稿日期:2019-05-15
基金项目:江苏省水生生物资源重大专项(编号:ZYHB16-3);江苏省内陆省管渔业水域渔业资源监测项目。
作者简介:李大命(1981—),男,江苏南京人,博士,副研究员,主要从事渔业生态环境及渔业资源研究。E-mail:ldm8212@126.com。
通信作者:張彤晴,硕士,研究员,主要从事渔业资源监测及增养殖方面的研究。E-mail:zhtq3@126.com。 银鱼是银鱼科鱼类简称,具有较高的经济价值和营养价值。我国是银鱼多样性最为丰富的国家,拥有世界17种银鱼中的15种,其中6种为中国特有种[1-2]。大银鱼(Protosalanx hyalocranius Abbott,1901)和太湖新银鱼(Neosalanx taihuensis Chen,1956)分别隶属于鲑形目(Salmoniformes)银鱼科(Salangidae)的大银鱼属和新银鱼属,主要分布在我国黄河、淮河和长江中下游及其附属湖泊,是我国重要的经济鱼类,成为重要的渔业捕捞对象[1]。2种银鱼均为1年生小型鱼类,具有生长快且世代离散特征,对水环境变化敏感,种群年际间波动较为显著。近几十年来,由于过度捕捞、环境污染、水利工程建设及生境破碎化等不利因素影响,银鱼天然资源呈现大范围、长时间持续衰退趋势,种群数据急剧下降,逐渐失去捕捞价值[2]。因此,开展银鱼天然资源保护成为亟待解决的问题。
迄今,关于银鱼的研究主要集中在生殖发育、移植增殖和种群生态等方面[3-7],而有关银鱼分子方面的研究相对较少[8]。了解鱼类的遗传多样性对于科学保护和合理利用渔业资源具有重要理论和应用价值。脊椎动物线粒体DNA因具有自主复制、结构紧密、编码效率高、无重组现象、无组织特异性、进化速率快以及遵循严格的母系遗传等特点,被广泛地应用于系统发育、物种分类和群体遗传进化等领域中,成为最常用的分子标记之一[9]。线粒体细胞色素b (Cytb)和细胞色素c氧化酶亚基Ⅰ(CO Ⅰ)是线粒体DNA的蛋白质编码基因,具有良好的系统发育信息,且进化速率适中,被广泛应用于鱼类种群遗传多样性及分子系统进化研究[10-12]。
骆马湖(34°00′~34°14′N,118°06′~118°18′E)地处江苏省北部,地跨宿迁、徐州2市,水位23.0 m时,平均水深约3.3 m,湖泊面积约260 km2,是江苏省第4大淡水湖,属于典型的人工控制型过水性湖泊,兼具渔业、供水、防洪等多重功能。近期的骆马湖渔业资源调查共监测到57种鱼类,与历史资料相比,骆马湖鱼类种类明显减少,群落结构组成趋于单一,且小型化、低龄化现象严重[13-14]。历史上骆马湖银鱼资源较为丰富,近年来银鱼天然资源急剧衰减并趋于枯竭[14-15]。到目前为止,尚未发现有关骆马湖银鱼遗传多样性的资料。本研究采用线粒体DNA的Cytb和CO Ⅰ基因序列作为分子标记,首次探究骆马湖大银鱼和太湖新银鱼的遗传多样性水平及遗传结构组成,研究结果不仅有利于丰富骆马湖银鱼的遗传学资料,同时可为科学保护和合理利用骆马湖银鱼资源提供重要参考依据。
1 材料与方法
1.1 试验材料
2018年8—12月在骆马湖采集大银鱼64尾和太湖新银鱼35尾。每尾样本剪取肌肉组织,放入离心管中,加入无水乙醇固定,样本保存于4 ℃冰箱中。
1.2 基因组DNA提取
采用广谱性基因组 DNA 提取试剂盒 (TaKaRa,大连)提取大银鱼和太湖新银鱼基因组 DNA,将DNA 溶于100 μL超纯水中,置于-20 ℃保存备用。
1.3 PCR扩增与测序
扩增Cytb和CO Ⅰ基因序列的引物见表1,由生工生物工程(上海)股份有限公司完成。PCR反应总体积为50 μL,其中包括2×Premix 25 μL(1.25 U Taq聚合酶,0.4 mmol/L dNTP,3 mmol/L Mg2+),模板DNA 2 μL,正反向引物各 2 μL (10 μmol/L),其余超纯水补足。PCR反应程序为:94 ℃预变性 4 min;94 ℃变性40 s,55 ℃退火 50 s,72 ℃延伸 90 s (Cytb)或60 s(CO Ⅰ),共30个循环;反应结束后在72 ℃再延伸10 min,最后4 ℃保存。
PCR产物经1.5%琼脂糖凝胶电泳检测,选择带有目的条带且条带清晰的产物送至生工生物工程(上海)股份有限公司纯化并双向测序,测序引物为扩增引物。
1.4 数据处理
使用BioEdit软件[18]和Clustal X软件[19]测序结果进行序列编辑、比对和排序。
使用DnaSP 5.0软件[20]计算单倍型数目、多态位点数目、单倍型多样性(haplotype diversity,Hd)、核苷酸多样性(nucleotide diversity,Pi)、变异位点、单一突变位点、简约信息位点等。使用Mega 7.0软件[21]计算序列的碱基组成、种群内遗传距离,采用邻接法(Neighbor-Joining,NJ),构建单倍型系统发育树。使用Arlequin 3.0软件[22]进行Tajimas D和Fus Fs中性检验。采用Tajimas D和Fus Fs中性检验及核苷酸不配对分布(Mismatch distribution)分析来检测种群历史动态。
2 结果与分析
2.1 大银鱼和太湖新银鱼Cytb和CO Ⅰ基因序列变异分析
经 PCR 扩增、测序和校对,获得骆马湖大银鱼线粒体Cytb基因全长序列,其长度为1 141 bp,碱基T、C、A和G的平均含量分别为29.3%、32.4%、217%和16.6%,碱基A+T的含量(51.0%)略大于碱基G+C的含量(49.0%)。64条Cytb基因序列检出10个多态性位点,其中3个是单一信息位点(分别位于第210、438、 897位点),7个是简约信息位点(分别位于第180、429、471、585、837、1 017、1020位点),未插入和缺失位点。经分析获得骆马湖大银鱼CO Ⅰ基因序列片段,长度为630 bp,碱基T、C、A和G的平均含量分别为29.3%、32.4%、217%和16.6%,碱基A+T的含量(51.0%)略大于碱基G+C的含量(49.0%)。64条CO Ⅰ基因序列检出5个多态性位点,其中1個是单一信息位点(位于第180位点),4个是简约信息位点(分别位于第156、270、348、360位点),未插入和缺失位点。
经PCR扩增、测序和校对,获得骆马湖太湖新银鱼线粒体Cytb基因全长序列,其长度为 1 141 bp,碱基T、C、A和G的平均含量分别为281%、33.5%、21.1%和17.3%,碱基A+T的含量(49.2%)略小于碱基G+C的含量(50.8%)。35条Cytb基因序列检出11个多态性位点,其中6个是单一信息位点(分别位于第85、124、159、217、837、1138位点),5个是简约信息位点(分别位于第27、28、126、352、1 102位点),未插入和缺失位点。经分析获得骆马湖大银鱼CO Ⅰ基因序列片段,长度为630 bp,碱基T、C、A和G的平均含量分别为25.4%、34.3%、19.5%和20.8%,碱基A+T的含量(44.9%)略小于碱基G+C的含量(551%)。35条CO Ⅰ基因序列检出5个多态性位点,其中3个是单一信息位点(分别位于第84、183、519位点),2个是简约信息位点(分别位于第3、477位点),没有插入和缺失位点。
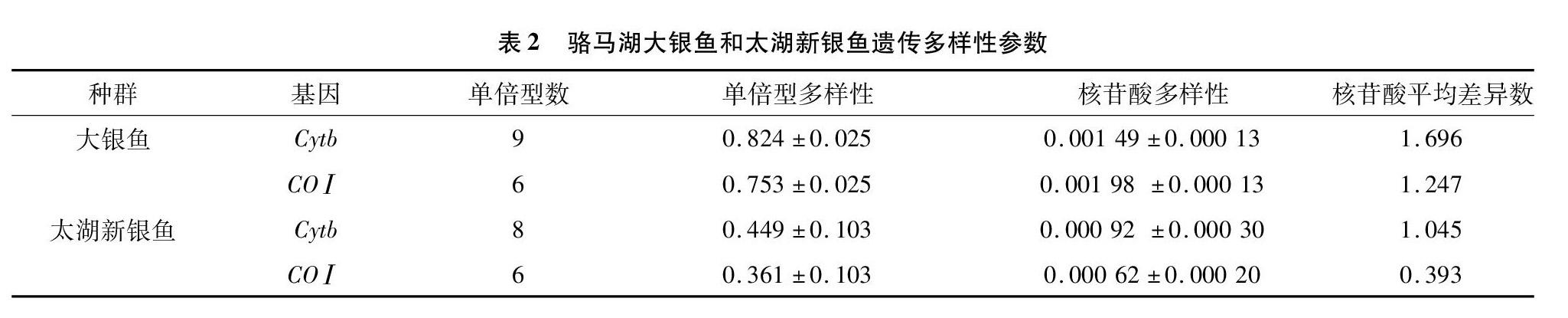
2.2 骆马湖大银鱼和太湖新银鱼遗传多样性
由表2可知,64尾大银鱼定义9个Cytb基因单倍型,分别命名为PHB1~PHB9(GenBank登录号:MK354248~MK354256),其数量分别为7、10、2、12、20、1、1、3、8个,其中PHB5为数量最多的单倍型,占比为31.3%。单倍型多样性和核苷酸多样性分别为0.824±0.025和0.001 49±0.000 13,平均核苷酸差异数为1.696;64尾大银鱼定义6个CO Ⅰ基因单倍型,分别命名为PHC1~PHC6(GenBank登录号:MK354257~MK354262),其数量分别为22、8、1、2、19、12个,其中PHC1是数量最多的单倍型,占比为34.4%。单倍型多样性和核苷酸多样性分别为0.753±0.025和0.001 98 ±0.000 13,平均核苷酸差异数为1.247。
35尾太湖新银鱼定义8个Cytb基因单倍型,分别命名为NTB1~NTB8(GenBank登录号:MK354263~MK354270),其数量分别为26、1、3、1、1、1、1和1个,其中NTB1是数量最多的单倍型,占比为74.3%。单倍型多样性和核苷酸多样性分别为0.449±0.103和0.000 92 ± 0.000 30,平均核苷酸差异数为1.045;35尾太湖新银鱼定义6个 CO Ⅰ 基因单倍型,分别命名为NTC1~NTC6(GenBank登录号:MK361021~MK361026),其数量分别为28、1、1、2、1和2个,其中NTC1是数量最多的单倍型,占比为80.0%。单倍型多样性和核苷酸多样性分别为0.361± 0.103和0.00 062± 0.000 20,平均核苷酸差异数为0.393。
2.3 大银鱼和太湖新银鱼单倍型系统进化树
骆马湖大银鱼线粒体Cytb和CO Ⅰ基因单倍型之间的Kimura-2双参数遗传距离分别在0.001~0.004和0.002~0.005之间,相应地,太湖新银鱼2个基因单倍型之间的遗传距离分别在0.001~0005和0.002~0.003之间。大银鱼和太湖新银鱼Cytb单倍型之间的Kimura-2双参数遗传距离在0.117~0.123之间,相应地,大银鱼和太湖新银鱼COⅠ 单倍型之间的遗传距离在0.124~0.130之间。
采用邻接法构建大银鱼和太湖新银鱼Cytb和CO Ⅰ基因单倍型分子系统进化树,由图1和图2可知,大银鱼和太湖新银鱼单倍型均聚为2个明显分支。
2.4 大银鱼和太湖新银鱼种群历史动态
对骆马湖大银鱼和太湖新银鱼Cytb和CO Ⅰ基因序列进行 Tajimas D 和 Fus Fs 中性检验,由表 3
可知,大银鱼Cytb基因序列的2种中性检验结果均为负值, 但并未达到显著性水平。 大银鱼 CO Ⅰ基
因序列的Tajimas D中性检验结果为正值,而Fus Fs中性检验结果为负值,且均未达到显著性水平;太湖新银鱼的2种中性检验结果均为负值,且均达到显著性水平。
对骆马湖大银鱼和太湖新银鱼Cytb和CO Ⅰ基因序列进行核苷酸错配分布分析,由图3和图4可知,大银鱼和太湖新银鱼Cytb和CO Ⅰ基因序列的核苷酸错配分布图均呈单峰型。结合中性检测结果,可以推断出骆马湖2种银鱼近期历史上经历过种群扩张。
3 讨论
遗传多样性是指生物种内和种间的遗传变异度,是生物进化与适应环境的基础。物种遗传多样性高低与其适应能力、生存能力和进化潜力密切相关。丰富的遗传多样性意味着较高的适应生存潜力,蕴藏着较大的进化潜能、丰富的育种和遗传改良潜力。物种遗传变异减少可能导致严重的后果,如成活率、生长与繁殖效率变低,降低种群个体对环境变化的适应能力。单倍型多样性和核苷酸多样性是衡量一个物种或群体遗传多样性的重要指标。骆马湖大银鱼64尾样本共定义9个Cytb基因单倍型,单倍型多样性和核苷酸多样性分别为0824±0.025和0.001 49±0.000 13;定义6个 CO Ⅰ 基因单倍型,单倍型多样性和核苷酸多样性分别为0.753±0.025和0.001 98±0.000 13,显示出较高的单倍型多样性和较低核苷酸遗传多样性。太湖新银鱼35尾样本共定义8个Cytb基因单倍型,单倍型多样性和核苷酸多样性分别为0.449±0.103和0.00 092±0.000 30;定义6个CO Ⅰ基因单倍型,单倍型多样性和核苷酸多样性分别为0361±0.103和0.000 62±0.000 20,显示出较低的单倍型多样性和较低核苷酸遗传多样性。已有文献报道我国不同水域、水体大银鱼遗传多样性,如,三峡库区(Cytb,Hd:0.804±0.032,Pi:0.0014 6±0.000 09)[23]、太湖(Cytb,Hd:0.850±0.045,Pi:0002 96±0.000 17)[11]、微山湖(Cytb,Hd:0.684±0.120,Pi:0.000 9±0.000 2)、巢湖(Cytb,Hd:0.853±0.001,Pi:0.001 5±0.000 5)[24]、洪泽湖(Cytb,Hd:0.755±0.045,Pi:0.001 29±0.000 10;CO Ⅰ,Hd:0.700±0.047,Pi:0.002 07±0.000 16)[12]、黑龙江水域(Cytb,Hd:0.827±0.03,Pi:0.002 02±0.000 28)、松花江水域(Cytb,Hd:0876±0.038, Pi: 0.001 87± 0.000 23)、 兴凯湖(Cytb,Hd:0.667±0.041,Pi:0.001 88±0.000 27)、莲花湖(Cytb,Hd:0.823±0.026,Pi:0.001 41±0000 10)[25];已有文献报道太湖新银鱼的遗传多样性,比如三峡库区(Cytb,Hd:0.671±0.061,Pi:0002 28±0.000 24)[23]、长江中下游8个地理群体(CO Ⅰ,Hd:0.576±0.036,Pi:0.001 12±0.002 04)[26]及珠江流域(Hd:0.622±0.064,Pi:0001 1± 0.000 3)、长江流域(Hd:0.781±0.017,Pi:0.002 7±0.001)和淮河流域(Hd:0.464±0057,Pi:0.001 0±0.000 2)3大水系(Cytb,Hd:0713±0.022,Pi:0.022±0.000 1)[27]。通过比较可得出,骆马湖大银鱼遗传多样性处于中等水平,而太湖新银鱼遗传多样性处于较低水平。反过来,较低的遗传多样性会降低银鱼种群对环境的适应能力和进化潜能,导致种群数量持续下降。近年来,受过度捕捞、环境污染、富营养化和采沙等活动影响,导致栖息环境破坏等不利结果[28-30],骆马湖银鱼资源量急剧减少,有效种群数量降低,进而导致银鱼遗传多样性水平较低。
根据单倍型多样性和核苷酸多样性的大小,可将鱼类的进化模式分为4种类型。第一种类型(Hd≥0.5,Pi<0.005)是受瓶颈效应后种群数量的迅速扩张导致;第二种类型(Hd≥0.5,Pi≥0.005)表示种群稳定,具有比较悠久的进化历史;第三种类型(Hd<0.5,Pi≥0.005)表示种群经历了轻微的瓶颈效应,但几乎未影響到核苷酸变异;第四种类型(Hd<0.5,Pi<0.005)表明种群近期经历了瓶颈效应[31]。本研究结果表明,骆马湖大银鱼单倍型多样性Hd>0.5,而核苷酸多样性Pi<0.005,属于第一种进化模式。由于核苷酸多样性积累所需时间比积累单倍型时间漫长,提示骆马湖大银鱼种群是从一个有效种群数量较小的种群经快速扩张而来,但是仍然未达到积累核苷酸变异所需要的时间。太湖新银鱼单倍型多样性Hd<0.5,核苷酸多样性Pi<0.005,属于第四种进化模式,反映出该种群受多种不利因素影响所导致的个体数量急剧减少,甚至面临灭绝危险。另外,通过Tajimas D和Fus Fs中性检测可以推断种群进化历史,当Tajimas D和Fus Fs呈负值,并且在统计学上有较显著的标准,说明序列中含有比中性进化模型更多的核苷酸位点变化,预示着被研究种群经历过一个扩张的历史[32-33]。本研究中骆马湖大银鱼和太湖新银鱼的Tajimas D和Fus Fs值均为负值,但大银鱼没有显著偏离中性进化,太湖新银鱼与中性进化的差异显著(表3)。同时,2种银鱼的核苷酸歧点分布曲线呈单峰型(图3和4),说明骆马湖大银鱼和太湖新银鱼种群在历史上出现过扩张。
研究結果显示,大银鱼Cytb和CO Ⅰ单倍型之间的遗传距离分别在0.001~0.004和0.002~0005之间。太湖新银鱼2种基因单倍型之间的遗传距离分别在0.001~0.005和0.002~0.003之间,表明大银鱼及太湖新银鱼种群内没有产生遗传分化。这是因为不同单倍型个体间存在广泛的基因交流,没有地理隔离的限制。另外,银鱼自身具有较强的活动能力,加之生产捕捞、水流的影响能够促进银鱼的运动,有利于银鱼个体间基因交流。已有研究表明,太湖大银鱼、太湖新银鱼和寡齿新银鱼6湖区群体的遗传相似性指数和遗传距离都十分接近,群体间的遗传差异很小[34]。从单倍型数量组成来看,骆马湖银鱼遗传结构不合理,尤其是太湖新银鱼,其Cytb和CO Ⅰ基因单倍型中优势单倍型的比例高达76.3%和80%,而其他单倍型所占的比例均较低。相比较而言,数量少的单倍型个体更容易丧失遗传基因,从而导致银鱼遗传多样性丢失和遗传结构发生改变。
本研究借助于线粒体DNA Cytb和CO Ⅰ基因序列首次调查了骆马湖遗传多样性水平,结果显示,骆马湖银鱼种质资源遗传多样性较低,遗传结构组成不合理。为维持骆马湖银鱼资源的可持续发展,需要采取措施恢复和保护骆马湖银鱼资源,提高其遗传多样性水平。比如,加强银鱼资源量和遗传多样性动态监测,开展针对性的银鱼增殖放流;控制捕捞强度、延长禁渔期,对银鱼资源采取定额捕捞、限额捕捞;控制环境污染和富营养化,禁止采沙活动,减少人类干扰。
参考文献:
[1]解玉浩,解 涵. 银鱼科鱼类的分类分布和种群生态[J]. 水产学杂志,1997,10(2):11- 19.
[2]王忠锁,傅萃长,雷光春. 中国银鱼的多样性及其保护对策[J]. 生物多样性,2002,10(4):416-424.
[3]孙帼英. 大银鱼卵巢的成熟期和产卵类型[J]. 水产学报,1985,9(4):363- 368.
[4]解玉浩. 大银鱼的繁殖生物学特性及移植放流的主要措施[J]. 水利渔业,1996(1):6-8,20.
[5]顾良伟. 我国太湖银鱼移植现状[J]. 现代渔业信息,1998,13(9):23- 25.
[6]王玉芬,蒋全文. 太湖大银鱼生长特性的研究[J]. 湖泊科学,1992,4(1):56- 62.
[7]赵丽爽,程 飞,张 磊,等. 洪泽湖大银鱼和太湖新银鱼的生长、死亡参数及资源利用状况[J]. 水生生物学报,2018,42(2):240- 249.
[8]郭 立,李 隽,王忠锁,等. 基于4个线粒体基因片段的银鱼科鱼类系统发育[J]. 水生生物学报,2011,35(3):449-459.
[9]李建华,王继文.动物线粒体DNA在进化遗传学研究中的应用[J]. 生物学通报,2005,40(2):5-7.
[10]孙 鹏,彭士明,尹 飞,等. 利用CO Ⅰ和Cytb序列探讨东海区3种鲳属鱼类的种群遗传结构[J]. 海洋渔业,2011,33(4):398-404.
[11]李大命,张彤晴,唐晟凯,等. 太湖大银鱼(Protosalanx chinensis)细胞色素b基因序列多态性分析[J]. 江苏农业学报,2015,31(4):840-845.
[12]李大命,李 康,张彤晴,等. 洪泽湖大银鱼(Protosalanx hyalocranius)Cytb和CO Ⅰ基因序列多态性分析[J]. 渔业科学进展,2017,38(6):25- 31.
[13]周化民,白延明. 骆马湖鱼类的初步研究[J]. 徐州师范学院学报(自然科学版),1994,12(2):53- 56.
[14]唐晟凯,张彤晴,李大命,等. 骆马湖夏季鱼类群落结构及其空间分布[J]. 江苏农业科学,2018,46(1):107- 111.
[15]倪 勇,伍汉霖. 江苏鱼类志[M]. 北京:中国农业出版社,2006:35-36.
[16]Zhang J,Li M,Xu M Q,et al. Molecular phylogeny of icefish salangidae based on complete mtDNA cytochrome b sequences,with comments on estuarine fish evolution[J]. Biological Journal of the Linnean Society,2007,91(2):325-340.
[17]Ward R D,Zemlak T S,Innes B H,et al. DNA barcoding Australias fish species[J]. Philosophical Transactions of the Royal Society of London(Series B,Biological Sciences),2005,360(1462):1847-1857.
[18]Hall T A. BioEdit:A user-friendly biological sequence alignment editor and analysis program for Windows 95/98/NT[J]. Nucleic Acids Symposium Series,1999,41:95-98.
[19]Larkin M A,Blackshields G,Brown N P,et al. Clustal W and clustal X version 2.0[J]. Bioinformatics,2007,23(21):2947-2948.
[20]Librado P,Rozas J. DnaSP v5:a software for comprehensive analysis of DNA polymorphism data[J]. Bioinformatics,2009,25(11):1451-1452.
[21]Kumar S,Stecher G,Tamura K. MEGA7:molecular evolutionary genetics analysis version 7.0 for bigger datasets[J]. Molecular Biology and Evolution,2016,33(7):1870-1874.
[22]Excoffier L,Lischer H L. Arlequin suite ver 3.5:A new series of programs to perform population genetics analyses under Linux and Window[J]. Molecular Ecology Resources,2010,10(3):564-567.
[23]罗宏伟,段辛斌,王 珂,等. 三峡库区3种银鱼线粒体DNA细胞色素b基因序列多态性分析[J]. 淡水渔业,2009,39(6):16-21.
[24]薛 丹. 基于细胞色素b的中国9个大银鱼群体遗传多样性研究[D]. 广州:暨南大学,2015.
[25]Tang F J,Li D M,Liu W,et al. Evolutionary tendency of clearhead icefish Protosalanx hyalocranius inferring mitochondrial DNA variation analyses in Amur (Heilongjiang) river catchment,China[J]. Interational Journal of Agriculture & Biological,2018,20(10):2329-2334.
[26]张 迪,雷光春,龚 成,等. 基于CO Ⅰ基因序列的太湖新银鱼遗传多样性[J]. 湖泊科学,2012,24(2):299-306.
[27]Zhao L,Zhang J,Liu Z J,et al. Complex population genetic and demographic history of the salangid,neosalanxtaihuensis,based on cytochrome b sequences[J]. BMC Evolutionary Biology,2008,8:201.
[28]黄文钰,许朋柱,范成新. 网围养殖对骆马湖水体富营养化的影响[J]. 农村生态环境,2002,18(1):22-25.
[29]申 霞,洪大林,谈永锋,等. 骆马湖生态环境现状及其保护措施[J]. 水资源保护,2013,29(3):39-43,50.
[30]張 芹,张圣虎,汪 贞,等. 骆马湖表层水体中32种PPCPs类物质的污染水平、分布特征及风险评估[J]. 环境科学,2017,38(1):162- 169.
[31]Grant W S,Bowen B W. Shallow population histories in deep evolutionary lineages of Marine fishes:Insights from sardines and anchovies and lessons for conservation[J]. Journal of Heredity,1998,89(5):415-426.
[32]Tajima F. Statistical method for testing the neutral mutation hypothesis by DNA polymorphism[J]. Genetics,1989,123(3):585-595.
[33]Fu Y X. Statistical tests of neutrality of mutations against population growth,hitchhiking and background selection[J]. Genetics,1997,147(2):915-925.
[34]夏德全,曹 萤,吴婷婷,等. 太湖中大银鱼、太湖新银鱼和寡齿新银鱼群体的遗传结构[J]. 水产学报,1999,23(3):254-260.涂 枫,赵为民,曹 静,等. 木聚糖酶基因(XynB)肠道特异表达载体的构建及鉴定[J]. 江苏农业科学,2020,48(11):53-57.

