川牛膝多糖联合维生素C体外抑制HepG-2肿瘤细胞活性的作用
郝婧玮 张 蕾 秦金玲


摘要:为了解川牛膝多糖联合维生素C抑制肿瘤细胞活性作用,采用超声波提取法从川牛膝根中提取川牛膝多糖(RCP),经Sevage法除去蛋白,并采用30%双氧水脱色、浓缩、冻干,得到川牛膝粉针剂,通过苯酚硫酸法制作葡萄糖标准曲线,进而测得多糖含量。体外联合维生素C作用于肝癌HepG-2细胞,采用噻唑蓝(MTT)法研究对 HepG-2 细胞的抑制作用。结果表明,川牛膝多糖与维生素C均可抑制肝癌HepG-2细胞的增殖,当多糖质量浓度为5、50、100、200 mg/mL时,对肝癌HepG-2的抑制率分别为19.7%、62.1%、59.1%、65.1%。当维生素C的浓度为0.1、02、0.3、0.4 mmol/L时,对肝癌HepG-2的抑制率为10%、11%、12%、54%。研究结果提示两者对肿瘤的抑制均呈剂量依赖性,当两者联合用药时,两者呈协同增效抗肿瘤作用,随着两者浓度的增加抑制率逐渐增強,对HepG-2细胞的最大抑制率可达84.2%。
关键词:川牛膝多糖;维生素C;肝癌;HepG-2细胞
中图分类号: R735.7;R285.5 文献标志码: A 文章编号:1002-1302(2020)11-0192-04
收稿日期:2019-05-17
基金项目:黑龙江省教育厅项目(编号:1353MSYQN009);黑龙江省牡丹江市科学技术计划(编号:Z2018s074);黑龙江省大学生创新创业训练计划(编号:201810233031)。
作者简介:郝婧玮(1985—),女,辽宁宽甸人,硕士,讲师,主要从事肿瘤药理学研究。Tel:(0453)6511042;E-mail:swxhjw@126.com。 牛膝为苋科多年生草本植物,主要分为怀牛膝(Achyrnthes bidentata)和川牛膝(Cyathula capitata)2种。《中华人民共和国药典(2015年版)》上记载,牛膝有补肝肾、强筋骨、逐痕通经、引血下行之功效[1]。川牛膝主产于四川省、贵州省、云南省、福建等地,具有活血、利尿、降血糖、保肝、增强机体免疫力等功效。近年来,对川牛膝的抗肿瘤研究较多,其多糖成分[3] CoPS1、CoPS2、CoPS3被认为是其主要活性成分并具有抗肿瘤作用[4]。陈红等人观察了川牛膝多糖对小鼠肉瘤、小鼠肝癌的抑制作用及对环磷酰胺(Cy)所致正常及荷瘤小鼠外周白细胞减少的影响[5],表明川牛膝多糖对小鼠肝癌(S180)的抑制率为21.99%~42.21%;对环磷酰胺(Cy)所致正常或荷瘤小鼠外周血白细胞减少有极显著的回升作用,说明川牛膝多糖不仅有抗肿瘤作用,还能减轻Cy所致外周白细胞减少。宋军等对川牛膝多糖对小鼠肝癌细胞H22抑制作用研究表明,Cy对肝癌细胞H22(腹水型)有强烈的抑制作用[6]。川牛膝多糖对小鼠肝癌细胞H22(腹水型)有一定的抑制作用,其抑瘤作用及机理有待进一步研究。
作为生物体内普遍存在的一类生物大分子,来源于中药的多糖[7-9]已超过200种,诸多研究表明多糖具有促进机体免疫力、抗菌、抗病毒、抗寄生虫、抗肿瘤、抗辐射、抗衰老、抗炎、降血脂等生物活性,目前在临床上已用于治疗肝炎、艾滋病、癌症和许多其他疾病[10-15]。有研究发现,维生素C不仅可以保护细胞,还可以抑制和杀伤肿瘤细胞,维生素C有抗胃癌、宫颈癌[16-17]作用。本研究以川牛膝根中提取的川牛膝多糖(RCP),在体外联合维生素C作用于肝癌HepG-2细胞,研究对HepG-2细胞的抑制作用,旨在探讨川牛膝多糖抗肿瘤作用机制,为抗肿瘤药物机制的研究提供参考。
1 材料与方法
1.1 试验材料
1.1.1 细胞株与试剂 细胞株,人肝癌HepG-2,由哈尔滨工业大学传代保种。川牛膝,产地为四川。维生素C,天津市永大化学试剂有限公司;胎牛血清,赛默飞世尔生物化学制品(北京)有限公司;PBS冲液,瑞楚生物;胰蛋白酶-EDTA溶液,源叶生物;DMSO,岳阳湘茂医药化工有限公司;DMEM培养基,美国Gibco公司。
1.1.2 主要仪器 超声波清洗机(SB-5200DT),购于宁波新芝生物科技有限公司;冷冻干燥机(FD-1),购于北京博医康技术公司;旋片真空泵(2XZ-2),浙江黄岩求精真空泵厂制造;电热恒温水浴锅(HWS28),购于上海一恒科技有限公司;超级恒温水浴(HH-601),购于江苏省金坛市荣华仪器制造有限公司;手提式压力蒸汽灭菌器(XFS-280),购于浙江新丰医疗器械有限公司;电热鼓风干燥箱(DHG-9055A),购于上海一恒科学技术有限公司;循环水真空泵(SHZ-D3),购于巩义市予华仪器有限责任公司;生物安全柜(BHC-1300IIA2),购于蓟州净化;超低温冰箱(U410-86),购于Peppercorn公司;紫外分光光度计(722N),购于北京普析通用仪器有限公司;电子天平(BSA224S-CW),购于赛多利斯科学仪器(北京)有限公司;Synergy HTX(SILFTA),购于美国伯腾仪器有限公司。
1.2 方法
1.2.1 牛膝多糖粗提取物的提取 称取川牛膝粉末500 g,按料液比1 g ∶ 13 mL加入蒸馏水浸泡 1.5 h,60 ℃ 超声提取2 h,过滤、弃滤渣,合并提取液。90 ℃ 浓缩,待浓缩液呈黏稠状,冷却,按照浓缩液与乙醇比1 ∶ 9的体积比加入无水乙醇,搅拌均匀,静置过夜。弃上清、取沉淀、洗涤,即为川牛膝多糖粗提取物。将多糖粗提取物加适量蒸馏水使其溶解,得多糖粗提取液。
1.2.2 牛膝多糖粗提取物的精制与冻干 按5 ∶ 1(多糖粗提取液∶ 30%过氧化氢)体积比加30%过氧化氢脱色素,温度控制在50 ℃,脱色2~4 h,期间用氨水调pH值保持在8.0左右。重复处理5次后,溶液由橙黄变为近透明状,视为脱色完成。按Sevage试剂与多糖粗提取液以1 ∶ 3的体积比于分液漏斗中萃取3次,分离上层多糖提取物。将处理后的多糖置于50 ℃恒温水浴锅中水浴、浓缩,将浓缩液倒在若干培养皿中,使溶液铺满皿底薄薄一层,放在 -80 ℃ 冰箱中预冻24 h,取出放置冷冻干燥机中-200 ℃,8 h冻干,密封冷藏,备用。
1.2.3 苯酚硫酸法制定葡萄糖标准曲线 称取01 g葡萄糖,倍比稀释得100 μg/mL的葡萄糖溶液。称取5 g苯酚,置100 mL容量瓶中定容,制得5%苯酚溶液,避光保存。分别取9支25 mL干燥的具塞比色管,编号依次为0~8号,0号作空白组校正,1~8 号分别加入0.4、0.6、0.8、1.0、1.2、1.4、16、1.8 mL葡萄糖溶液,再加蒸馏水补至2 mL,后加入0.8 mL 5%苯酚试液、5 mL 98%浓硫酸,充分振荡,蒸馏水补至9 mL。100 ℃沸水浴15 min,冷却,490 nm处测吸光度。
1.2.4 标准曲线精密度测定 称取0.1 g葡萄糖,定容至50 mL,制成2 mg/mL葡萄糖样液,精确吸取250 μL样液于50 mL容量瓶中,加水定容至刻度,得10 μg/mL的葡萄糖供试液。取5支具塞试管,编号依次为0~4号,0号为空白组,1~4号为试验组,每組分别吸取1 mL葡萄糖供试液,按照标准曲线法测得每组葡萄糖的吸光度,求RSD值。
1.2.5 川牛膝冻干粉多糖百分含量测定 称取川牛膝多糖冻干粉0.1 g,配制成0.06 mg/mL 川牛膝多糖供试液。按照标准曲线法测量川牛膝多糖在490 nm处的吸光度,带入标准曲线方程得到川牛膝多糖相当于葡萄糖的浓度,根据公式(1)得出川牛膝多糖的百分含量:
式中:A为川牛膝多糖的百分含量,%;C为川牛膝多糖相对于葡萄糖的浓度(μg/mL);D为稀释倍数;m为称取干燥恒质量的川牛膝冻干粉的质量(mg)。
1.2.6 细胞的复苏与传代 取出冻存细胞,融化,采用DMEM洗去冻存液。转移至含有0.5 mL 10%胎牛血清、3.5 mL DMEM的培养皿中,放入CO2恒温培养箱,24 h后观察细胞生长状况并更换培养液。当细胞铺满皿底时,开始传代。弃去细胞培养皿中的培养液,加适量胰酶,37 ℃消化1 min,加适量血清,终止胰酶消化反应。离心、弃上清,加2 mL DMEM吹打均匀。各吸取1 mL细胞液分别置于含0.5 mL胎牛血清和3.5 mL DMEM的培养皿中,轻轻振荡,混匀,于倒置显微镜观察。放入CO2恒温培养箱中,24 h后观察细胞生长状况。
1.2.7 不同浓度牛膝多糖作用于HepG-2肿瘤细胞 取对数期细胞悬液,置96孔板中,每孔80 μL,于CO2恒温培养箱中孵育,过夜,使细胞铺满孔底。分别取0.025、0.250、0.500、1.000 g川牛膝多糖,溶于1 mL DMEM中配制成0.025、0.250、0.500、1.000 g/mL 的多糖培养液,每个质量浓度梯度设2个复孔,以不加多糖的细胞作空白对照。在每孔中加入20 μL不同质量浓度梯度的多糖培养液,孵育24 h,倒置显微镜观察。每孔加入20 μL MTT,注意遮光,放培养箱培养4 h,终止培养,弃去多糖培养液。 每孔加100 μL二甲基亚砜,振摇10 min,用酶标仪在 490 nm 下测量吸光度。
1.2.8 不同浓度维生素C作用于HepG-2肿瘤细胞 分别取0.02、0.04、0.05、0.07 g维生素C溶于1 mL培养基中,配制成0.1、0.2、0.3、0.4 mmol/L的维生素C液,每个浓度梯度设2个复孔,以不加药孔作为空白孔。其他步骤同“1.2.7”节。
1.2.9 不同质量浓度川牛膝多糖联合不同浓度维生素C作用于HepG-2肿瘤细胞 将维生素C(01、0.2、0.3、0.4 mmol/L)和多糖(0.025、0.250、0.500、1.00 g/mL)按不同浓度或质量浓度梯度从小到大联合用药,每组设2个复孔。以细胞原液作空白孔,其他步骤同“1.2.7”节。
2 结果与分析
2.1 葡萄糖标准曲线与川牛膝多糖含量的测定
葡萄糖在吸收光490 nm所得的曲线回归方程为y=0.009x+0.1 256,r2=0.932 2。葡萄糖质量浓度在20~90 μg/mL与吸光度呈良好的线性关系。精密度RSD=2.6%<5%,说明试验精密度良好。计算得川牛膝的百分含量为64.8%,其中C=38.93 μg/mL,D=1 666.7,m=100 mg。
由表1可知,将0.06 mg/mL川牛膝多糖供试液设2平行对照组于490 nm处,测得吸光度值,代入葡萄糖标准曲线得到川牛膝多糖相对于葡萄糖的含量为64.8%。试验采用的是超声波辅助提取法,收率高于浸渍法。
2.2 川牛膝多糖对HepG-2肿瘤细胞活性的抑制
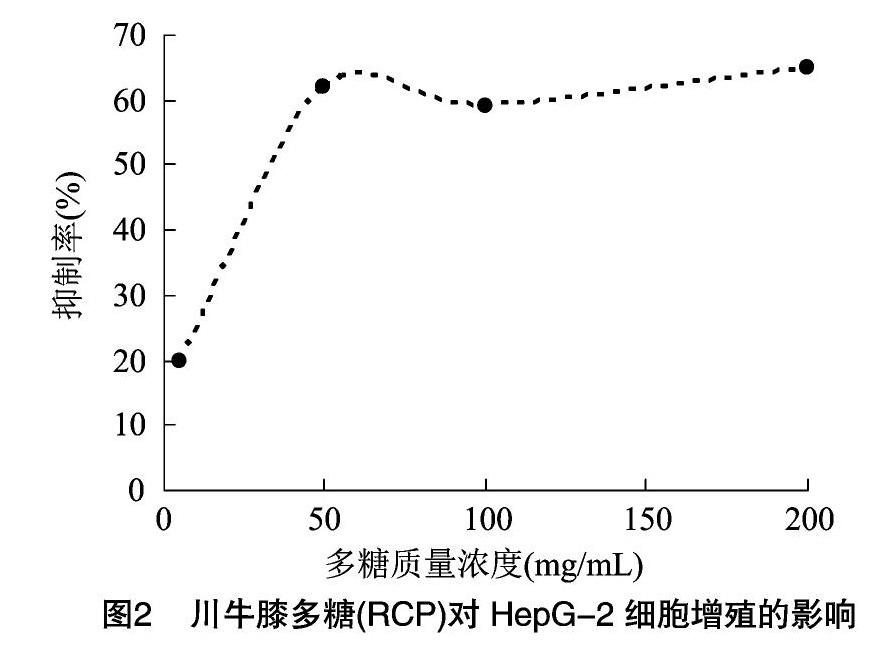
由图2可知,川牛膝多糖(RCP)体外有很好的抗肿瘤活性,在川牛膝多糖(RCP)体外作用于HepG-2细胞24 h内,抗肿瘤效果呈剂量依赖性,随着剂量增高抑制率也随之增高。川牛膝多糖(RCP)质量浓度这50 mg/mL时,抑制率达到621%,随后再增加川牛膝多糖(RCP)的质量浓度,抑制率增加幅度变小。当多糖质量浓度为100 mg/mL时,抑制率为591%,接近50%,可将100 mg/mL川牛膝多糖作为细胞的半数抑制浓度(IC50)。川牛膝多糖质量浓度为200 mg/mL时,抑制率达到651%,为最大抑制率。
2.3 维生素C对HepG-2肿瘤细胞活性的抑制
维生素C体外也有抗肿瘤活性,24 h内,随着维生素C浓度的增高,抑制率也呈上升趋势,抗肿瘤活性呈剂量依赖性。维生素C浓度为0.4 mmol/L时,抑制率为54%(图3),接近50%,可将0.4 mmol/L维生素C看作半数抑制浓度(IC50)。
2.4 川牛膝多糖联合维生素C对HepG-2肿瘤细胞活性的抑制
由图4可知,不同质量浓度或浓度组合的川牛膝多糖(5、50、100、200 mg/mL)与维生素C(0.1、02、0.3、0.4 mmol/L)联合作用于HepG-2细胞 24 h,MTT法检测并计算出对细胞的的抑制率,结果呈现剂量依赖性,当川牛膝多糖浓度固定时,随着维生素C浓度的上升,抑制率逐渐升高。200 mg/mL的川牛膝多糖与维生素C的联合抗肿瘤活性是所有组合中的最佳组合。当维生素C浓度为0.4 mmol/L,多糖质量浓度为200 mg/mL,抑制率达到最大值84.2%。0.2 mmol/L维生素C与不同质量浓度多糖联合对细胞的抑制率均很接近。
3 讨论
3.1 苯酚硫酸法测定条件因子选择
苯酚硫酸法测多糖含量的原理为多糖在硫酸作用下水解成单糖,再与苯酚结合在吸收光为 490 nm 处的最大吸收值。由于不同多糖的组成不同,苯酚硫酸法采用的苯酚用量、浓硫酸用量也不尽相同。通过对川牛膝多糖苯酚硫酸法测定条件因子水平研究,本研究选择为5%苯酚0.8 mL、98%浓硫酸5 mL。
3.2 多糖冻干喷瓶现象
在做多糖冻干粉时,出现喷瓶现象,可能是由于多糖的预冻不完全,冷冻干燥机升温过快导致试品部分液化,易在真空减压条件下出现喷瓶现象。也可能由于多糖浓缩液中有机试剂残留过多,导致喷瓶。处理的方法为增加多糖预冻时间,控制冷冻干燥机升温速度,提高多糖浓缩温度,减少浓缩液体积,必要时进行旋蒸去除多糖中残留的有机试剂。
3.3 多糖及维生素C体外抑制HepG-2肿瘤细胞活性
肝癌是严重危害人类健康的病症之一,死亡率极高,目前化学药物在市场上占据主导地位。但是化学药物对人体危害极大,耐药性产生概率极高,且單一用药难以控制病情发展[18-20]。研究天然活性成分的抗肿瘤作用是科学领域的一个热门话题。试验根据MTT法测得川牛膝多糖、维生素C单独作用及两者不同浓度联合的体外抗肿瘤活性,证明了川牛膝体外的抗肿瘤活性。早有研究表明维生素C有助于预防胃癌、宫颈癌,对肝癌的研究鲜有研究。本试验证明维生素C在体外对Hep-2肝癌细胞的抗肿瘤活性,维生素C抗肿瘤活性比较低,可能与配制浓度太小有关,也可能是因为配制维生素C溶液时,未及时采取遮光措施导致维生素C分解,药效减弱。两者联用时,总体效果比单独抗肿瘤活性高,说明两者体外抗肿瘤具有协同作用。可能是由于维生素C影响Hep-2肝癌细胞HIF的表达和川牛膝多糖的抗肿瘤作用共同诱导细胞发生凋亡。
4 结论
研究发现,川牛膝多糖、维生素C、川牛膝多糖联合维生素C均能抑制肝癌HepG-2细胞增殖活性,联合用药抑制率比两者单用要大。药物作用细胞的24 h内,当多糖质量浓度为5、50、100、200 mg/mL 时,对细胞的抑制率分别为19.7%、621%、591%、65.1%。当维生素C的浓度为01、0.2、03、0.4 mmol/L时,对肝癌HepG-2细胞的抑制率为10%、11%、12%、54%,说明两者对肿瘤的抑制均呈剂量依赖性,且川牛膝多糖在低质量浓度时抗肿瘤活性就较大。维生素C在低浓度时抗肿瘤活性小,高浓度时明显增加。两者联合用药对肝癌HepG-2的抑制率最高可达84.2%。
参考文献:
[1]国家药典委员会. 中华人民共和国药典[M]. 北京:中国医药科技出版社,2015.
[2]韩大鹏,石关桐. 蔺道人《仙授理伤续断秘方》浅析[J]. 上海中医药杂志,2007,41(2):55-56.
[3]Zhou R,Bo-Gang L I,Zhang G L . Glycosides from roots of cyathula officinalis kuan[J]. 2005,47(3):368-374.
[4]丁杰龙. 川牛膝多糖的抗肿瘤作用初探[J]. 中国民族民间医药,2009,18(13):46-47,115.
[5]陈 红,刘友平. 川牛膝多糖抗肿瘤作用初探[J]. 成都中医药大学学报,2001,24(1):49-50.
[6]宋 军,杨金蓉,李祖伦,等. 川牛膝多糖对小鼠肝癌细胞H22抑制作用研究[J]. 中药药理与临床,2001(3):19.
[7]吕晓英,马东瑞,李 由,等. 红毛五加多糖对体外人胃癌细胞基因及细胞因子表达的影响[J]. 实用肿瘤杂志,2001(1):45-46.
[8]邹 翔,孙 宇,王宏亮. 芦荟多糖对荷瘤小鼠肿瘤细胞膜功能的影响[J]. 哈尔滨商业大学学报(自然科学版),2005,21(1):11-13,5.
[9]季宇彬,高世勇,张秀娟. 羊栖菜多糖诱导肿瘤细胞凋亡的研究[J]. 中国中药杂志,2004,29(3):245-247.
[10]陶 喆,程建明. 中药多糖抗肿瘤机制探讨[J]. 江苏中医药,2003,24(6):47-49.
[11]郑 敏. 中药多糖抗肿瘤的药理学研究进展[J]. 国外医学(中医中药分册),2000,22(5):259-263.
[12]郑应馨,徐恒卫. 具有抗肿瘤活性的多糖及其作用机理研究概况[J]. 中国药师,2003(6):368-369,372.
[13]黄 芳,蒙义文. 活性多糖的研究进展[J]. 天然产物研究与开发,1999(5):90-98.
[14]张忠玲,朱 波,张 翠,等. 海胆肠多糖致Bel7402人肝癌细胞凋亡的扫描电镜观察[J]. 电子显微学报,2003,22(6):467.
[15]Wang B J,Won S J,Yu Z R,et al. Free radical scavenging and apoptotic effects of cordyceps sinensis fractionated by supercritical carbon dioxide[J]. Food and Chemical Toxicology,2005,43(4):543-552.
[16]王新保,秦 双,张迎黎. 维生素C对体外胃癌细胞的影响[J]. 新乡医学院学报,1998,15(4):33- 35.
[17]李 能,周 波,陈忠东. 维生素C对Hela细胞系增殖及细胞周期的影响[J]. 南华大学学报(医学版),2004,32(2):161-163.
[18]Germano S,ODriscoll L. Breast cancer:understanding sensitivity and resistance to chemotherapy and targeted therapies to aid in personalised medicine[J]. Current Cancer Drug Targets,2009,9(3):398-418.
[19]Zhao Q Z,Dou K F. Methylation of ras association domain family protein 1,isoform a correlated with proliferation and drug resistance in hepatocellular carcinoma cell line SMMC-7721[J]. Journal of Gastroenterology and Hepatology,2007,22(5):683-689.
[20]Porta L,Caterina. Mechanism of drug sensitivity and resistance in melanoma[J]. Current Cancer Drug Targets,2009,9(3):391-397.贾文婷,杨 慧,吴洪斌,等. 红枣变温压差膨化产品品质评价体系的研究[J]. 江苏农业科学,2020,48(11):196-201.

