文心兰HSP70基因的克隆及表达分析
冯保云 李蓉 赖钟雄 林玉玲

摘 要:为研究文心兰热激蛋白70基因(命名为OnHSP70)的分子特性及表达特点,以文心兰‘柠檬绿(Oncidium hybridum ‘Honey Angel)为材料,采用RT-PCR技术克隆OnHSP70,利用生物信息学方法分析其分子特性,通过qRT-PCR技术分析其在不同组织及不同非生物胁迫处理下的表达特点。生物信息学分析表明:该基因开放阅读框为1944 bp,编码647个氨基酸,翻译的蛋白为稳定蛋白,属于HSP70超家族,其蛋白二级结构由41.11%的α-螺旋、17.77%的延伸链、7.73%的β-转角和33.38%的无规卷曲组成,具有2个高度保守的功能域。聚类分析表明:该蛋白与铁皮石斛和深圳拟兰的HSP70亲缘关系较近。qRT-PCR分析表明:文心兰HSP70在4种不同组织器官中具有表达差异性,在花中的表达量最高;高温处理后基因的表达量明显上升;40 ℃高温胁迫4 h时表达量达峰值;茉莉酸甲酯及水杨酸处理时表达量呈现下调响应。本研究为后期该基因功能研究及提高文心兰对高温的适应性提供理论基础。
关键词:文心兰;HSP70;克隆;非生物胁迫;表达分析
中图分类号:Q786;Q949.718.43 文献标识码:A
Abstract: In order to study the molecular characteristics of the heat shock protein gene (named OnHSP70) and its expression patterns in O. hybridum ‘Honey Angel, OnHSP70 was cloned by RT-PCR, its molecular characteristics was analyzed by bioinformatics, and its expression patterns in different tissues and under different abiotic stress treatment were carried out by qRT-PCR. Bioinformatics analysis showed that the open reading frame of the gene was 1944 bp, encoding 647 amino acids, and the translated protein was a stable protein belonging to the HSP70 superfamily. The secondary structure of the protein consisted of 41.11% α-helix, 17.77% extended chain, 7.73% β-turn and 33.38% random coil, and had two highly conserved functional domains. Clustering analysis showed the protein had closely relative to HSP70 from Dendrobium catenatum and Apostasia shenzhenica. qRT-PCR analysis showed OnHSP70 differentially expressed in four tissues and the highest expression level was found in flowers; the expression of OnHSP70 gene increased significantly after high temperature treatment, and reached the peak under 40 ℃ for 4 h treatment; OnHSP70 showed down-regulated under methyl jasmonate and salicylic acid treatment. The study would provide a theoretical basis for studying the gene function and improving the adaptability to high temperature of Oncidium hybridum.
Keywords: Oncidium hybridum; HSP70; cloning; abiotic stress; expression analysis
DOI: 10.3969/j.issn.1000-2561.2020.04.016
文心蘭(Oncidium hybridum)是兰科(Orchi-daceae)文心兰属(Oncidium),又名吉祥兰、舞女兰、金蝶兰等。起源于美洲热带地区,喜湿润和半阴环境,属于热带气生兰。植株轻盈、花茎自然下垂、花朵奇特、静时形似优雅舞者,动又如翩翩金蝶,是世界重要的切花和盆花种类之一,具有较高的经济价值。商业用文心兰多为花色优美、常年开花的优良杂交种。文心兰生长发育进程受温度影响较大,福建省地处东南沿海,属于温暖湿润的亚热带气候,是文心兰的适宜栽植区,但不同区域气候差异性较大。福州等地夏季持续35 ℃以上高温,极易导致植株生长发育不良,不仅会影响当季切花的质量,而且高温易造成假鳞茎皱缩[1],从而影响秋、冬季开花的产量和品质,造成巨大的经济损失,并且随着温室效应的加剧,极端高温天气频发,提高文心兰植株的抗高温能力是育种与栽培的研究目标之一[2]。
热激蛋白(heat shock protein, HSP),又称为热休克蛋白。当生物有机体受到多种生物(病害等)或非生物胁迫时(如高温、冷害等)会使其基因表达增强[3-4],是生物有机体最保守的保护机制之一。1962年在果蝇研究中,热激蛋白被首次发现,之后大量实验研究结果表明热激蛋白功能广泛。一般地,HSPs作为分子伴侣参与蛋白质的折叠与去折叠,协助蛋白质正确装配,参与蛋白质运输和降解[5]。按分子量的大小可将HSPs分为:HSP100、HSP90、HSP70、HSP60、HSP40和小分子HSP等6个超基因家族。其中HSP70是在生物体内分布最广、研究最多且在热激蛋白家族中进化上最保守的一类热激蛋白,根据功能不同可将HSP70分为:参与哺乳动物细胞功能的结构型热激蛋白HSP73、参与多种胁迫响应的诱导型热激蛋白HSP72、定位于内质网的葡萄糖结合蛋白GRP75以及定位于线粒体的GRP75等[6]。关于植物HSP70的研究起步较晚。近年来发现,HSP70主要分布于细胞质、内质网、线粒体和叶绿体中[7],不仅与植物的生长发育有关[8-12],还参与植物的非生物胁迫及病害胁迫响应[13-15]。通过对HSP70功能的相关研究,有望利用基因工程育种提高作物的抗逆性,但HSP70在植物中的分子伴侣作用机制和胁迫相关响应的机理还有待进一步的探究发现。
HSP70属于诱导型热激蛋白,在正常细胞内表达量较低,应激胁迫下能被高度诱导,修复错误折叠蛋白或降解已损伤的蛋白质以维持细胞内稳态,提高植物对逆境的耐受性[16-18]。迄今为止,对兰科植物HSP70的研究均侧重于其对冷胁迫的作用。4 ℃低温胁迫能够显著诱导铁皮石斛[19]和蝴蝶兰[20]HSP70的表达,且能维持一段时间的高表达量;孔倩倩[21]研究发现,水杨酸处理对高温胁迫下文心兰生理生化作用的影响,但文心兰HSP70对高温胁迫和激素处理(水杨酸、茉莉酸甲酯)的响应情况尚未见有关报道。因此,本研究以文心兰‘柠檬绿(Oncidium hybridum‘Honey Angel)为材料,克隆获得文心兰HSP70,利用qRT-PCR技术对不同组织部位及不同非生物胁迫处理下文心兰HSP70进行表达分析,以期为研究文心兰热激蛋白功能及其在遭受逆境胁迫过程中的作用奠定基础。
1 材料与方法
1.1 材料
本研究以文心兰‘柠檬绿为材料(由福建农林大学园艺植物生物工程研究所提供),进行文心兰开花期不同组织部位和苗期不同胁迫的处理。其中,不同组织部位包括根、假鳞茎、叶片和花;温度处理为将文心兰置于25(正常生长温度)、30、35、40 ℃处理24 h后进行整株取样;高温处理为将文心兰置于40 ℃培养条件下,于处理后0、4、8、24 h后进行整株取样;水杨酸处理为0.5 mmol/L的SA喷洒文心兰叶片,于0、1、3、6、12、24、48 h进行叶片取样;茉莉酸甲酯处理为0.2 mmol/L的MeJA喷洒文心兰叶片,于0、1、3、6、12、24、48 h进行叶片取样。上述处理均重复3次,取材后用液氮速冻,并放置?80 ℃冰箱中备用。上述材料处理方法参照李蓉等[22]文献。
1.2 方法
1.2.1 文心兰总RNA提取及其cDNA第一链合成 参照Invitrogen公司的TRIzol试剂盒说明书分别提取文心兰的各个组织部位及不同处理的总RNA。采用Thermo超微量核酸检测仪测定RNA浓度,再用1%琼脂糖凝胶电泳检测RNA的纯度和浓度。采用SMARTTM RACE cDNA Amplification Kit试剂盒(TaKaRa)和PrimeScriptTM RT Reagent Kit 试剂盒(TaKaRa)逆转录合成cDNA,分别用于基因克隆和qRT-PCR分析。
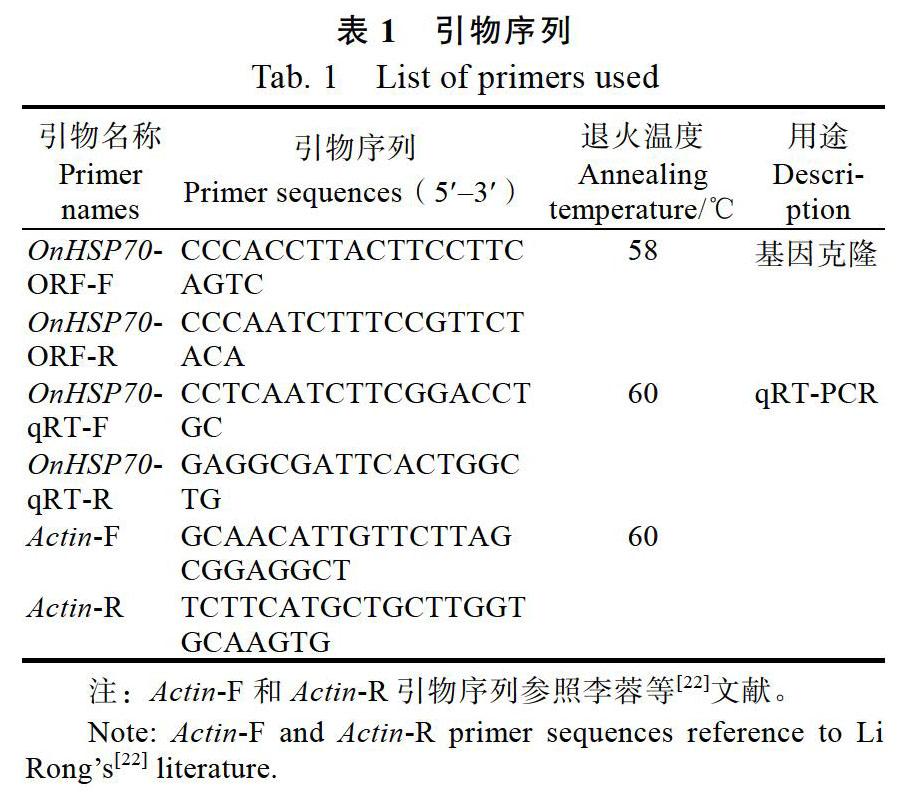
1.2.2 OnHSP70基因的篩选与克隆 从NCBI数据库网站获得1条石斛HSP70的cDNA序列,登录号为XP_020694708.1。根据此cDNA序列设计引物OnHSP70-ORF-F和OnHSP70-ORF-R(表1)。以文心兰‘柠檬绿的cDNA为模板进行PCR反应,扩增该基因的ORF序列。以上引物均由福州尚亚生物技术有限公司合成。
PCR扩增体系共25 μL:DreamTaq? Green PCR Master Mix (2) 12.5 μL、ddH2O 9.5 μL、cDNA 1 μL、OnHSP70-ORF-F 1 μL、OnHSP70- ORF-R 1 μL。PCR扩增程序:94 ℃ 5 min,94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸1 min 20 s,循环数为35,最后72 ℃延伸5 min。参照Gel/PCR Extraction Kit试剂盒说明书将获得的目的片段进行回收,用pMD18-T载体连接10 h后转入T1中,进行TA克隆并挑选阳性克隆菌落摇菌,然后进行菌液PCR扩增,凝胶电泳比对后将有目的条带的菌液送至上海铂尚生物技术有限公司测序。
1.2.3 OnHSP70生物信息学分析 通过NCBI中CDD在线工具进行OnHSP70保守结构域预测;同源性分析使用DNAMAN 6.0软件进行氨基酸序列的多重比对,聚类分析时采用 MEGA6.0中的NJ法(Neighbor-joining)进行HSP70基因进化树的构建。利用ExPASy-ProtParam tool分析蛋白的基本理化性质,用TMHMM Server 分析跨膜结构域,通过 SignalP 4.1 Server预测信号肽,NetPhos预测磷酸化位点,LocTree 3预测蛋白亚细胞定位;利用 SOP-MA预测蛋白质二级结构,用SWISS-MODEL 预测蛋白三级结构[23]。
1.2.4 qRT-PCR分析 利用罗氏LightCycler 480仪器,通过qRT-PCR检测OnHSP70基因在文心兰不同组织部位和不同胁迫处理下的表达情况。根据已获得序列,按照qRT-PCR引物设计原则,设计特异性引物OnHSP70-qRT-F和OnHSP70- qRT-R(表1)。采用SYBR? Premix Ex Taq? II Kit(TaKaRa)进行qRT-PCR反应,反应体系共20 μL:SYBR II酶10 μL、sdH2O 7.4 μL、cDNA 1 μL、上下游引物各0.8 μL。qRT-PCR反应条件为:95 ℃预变性30 s,95 ℃变性10 s,60 ℃退火30 s,72 ℃延伸15 s,循环数为45次。
1.3 数据处理
通过2-?ΔCT法计算获得OnHSP70的相对表达量[22]。用SPSS 19.0对OnHSP70的表达量进行差异显著性分析,再用Excel画图。
2 结果与分析
2.1 OnHSP70基因的克隆
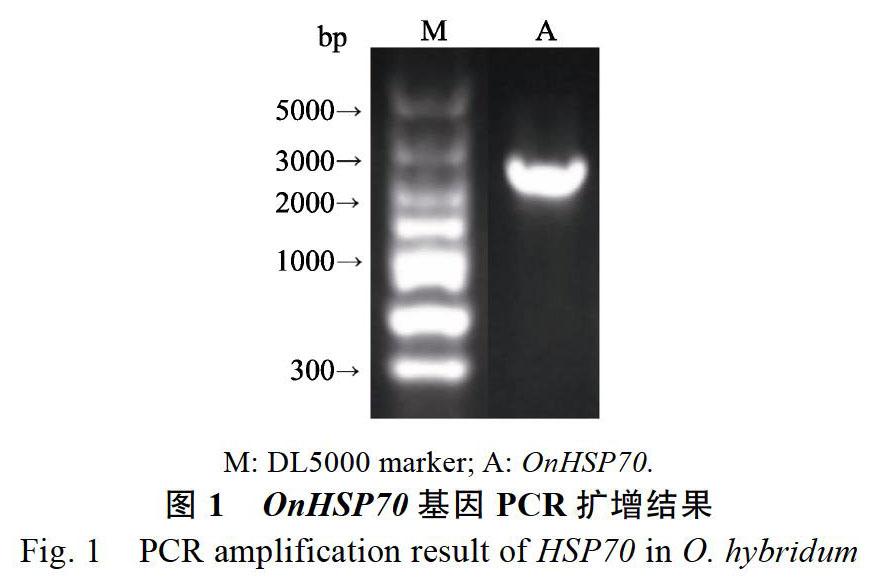
以文心兰‘柠檬绿cDNA为模板,扩增OnHSP70基因的开放阅读框,测序结果得到1条1994 bp片段(登录号:MT133659;图1),包含以ATG为起始密码子,以TAG为终止密码子的ORF共1944 bp,编码647个氨基酸(图2)。该基因编码的氨基酸序列具有3部分HSP70家族的特征序列:IDLGTTYS、IFDLGGGTFDVSLL和VLVGGSTRIPRVQQ;指纹序列VPAYFND以及C末端典型的特征基序EEVD[24]。由克隆得到的基因所推出的氨基酸序列在NCBI上进行BLASTp分析,发现与其它植物的HSP70具有90%以上的相似性;NCBI-CDS预测该蛋白在1~647肽链区间具有HSP70和Dnak等结构域,属于HSP70超家族(图3),这些结果表明克隆得到的基因为文心兰的HSP70基因,将其命名为OnHSP70。
2.2 OnHSP70聚类分析与氨基酸同源性分析
采用MEGA6.0邻位归并法,以文心兰、铁皮石斛、凤梨、烟草和柑橘等20种植物HSP70基因编码的氨基酸序列为基础进行聚类分析。结果表明,单子叶植物与双子叶植物的HSP70在进化方向上没有显著差别,OnHSP70在进化上与铁皮石斛和深圳拟兰的进化方向一致性较高,但与蝴蝶兰的进化方向有一定差距(图4)。将进化树中兰科植物(文心兰、铁皮石斛、深圳拟兰和蝴蝶兰)及模式植物(拟南芥、水稻和烟草)的氨基酸序列进行多重比对后,结果显示其整体一致性为94.4%,且该蛋白氨基酸序列N端的保守性高于C端,C端最后100个氨基酸变化很大,但C末端均存在高度保守的基序结构EEVD(图5)。
2.3 OnHSP70理化性质的生物信息学分析
OnHSP70理化性质的生物信息学分析表明:HSP70分子式为C3104H5006N856O992S25,原子数为9983个,分子量为70.99 kDa,正电氨基酸(Arg+ Lys)残基数为82个,负电氨基酸(Asp+Glu)残基数为102个,理论等电点PI为5.06。平均亲水性系数为?0.402,脂溶性系數为83.37,不稳定系数为32.55,属于亲水性的稳定蛋白。SignalP 4.1 Server 预测OnHSP70不含信号肽,表明其不属于分泌蛋白。LocTree 3预测该蛋白定位于细胞质中(可信度为95%);跨膜螺旋结构预测发现OnHSP70有由内向外4个和由外向内3个跨膜螺旋结构。磷酸化位点分析结果显示:OnHSP70共有51个磷酸化位点,包括21个Ser位点,23个Thr位点和7个Tyr位点。二级结构分析显示(图6):OnHSP70有41.11%的α-螺旋(α-helices),17.77%的延伸链(extended strand),7.73%的β-转角(β-turn)以及33.38%的无规则卷曲(random coil)。蛋白质三级结构如图7所示。
2.4 不同组织器官中OnHSP70的表达分析
以Actin为内参基因,分析了OnHSP70在文心兰不同组织器官的表达模式。qRT-PCR结果表明,OnHSP70在文心兰的根、茎、叶和花中均有表达,其在花中的表达量最高,约为其他器官表达量的9~12倍,与其他器官的表达量有显著差异(图8)。
2.5 温度处理下OnHSP70的表达分析
以正常培养温度(25 ℃)的文心兰为对照,分析高温条件下OnHSP70的表达情况。结果如图9所示,以常温下OnHSP70的表达量为对照,该基因在30 ℃处理时轻微下调响应,但与对照组差异不显著,而30 ℃到40 ℃时呈显著上调响应,尤其是40 ℃时该基因表达量为对照的9.5倍(图9)。40 ℃处理不同时间的文心兰中,OnHSP70在4 h时表达量达最高值,随后表达量不断下降,但是一直处于上调表达状态(图10)。
2.6 茉莉酸甲酯和水杨酸处理下OnHSP70的表达分析
以未喷施激素的文心兰叶片作为对照,分析茉莉酸甲酯及水杨酸处理不同时长后的表达情况。用0.2 mmol/L的茉莉酸甲酯处理后,OnHSP70整体呈现下调响应,且6 h的表达量出现波动,整体来看处理时间越长表达量越低(图11)。0.5 mmol/L的水杨酸处理初期(1 h时)表达量升高,且在处理1 h时有明显的单峰响应,其相对表达量约为对照组的1.38倍,随后逐渐下降,随着处理时长增加相对表达量逐渐下降(图11)。
3 讨论
3.1 OnHSP70分子特性分析
植物热激蛋白是植株在应激状态下产生的一类与抗逆性有关的蛋白。HSP70热激蛋白是HSPs家族中的重要一员,在自然界所有生物体中广泛存在并且高度保守[2]。本研究克隆获得的OnHS?- P??70,与铁皮石斛和深圳拟兰的HSP70同源性较高。尽管不同物种在进化上具有显著差异性,但是HSP70基因在植物中的进化是保守的[25],该家族成员都含有1个N端核酸结合区(nucleotide约45 kDa的核酸结合区,能够水解ATP,C端存在约25 kDa的底物结合区可以与多肽底物暴露在外部未折叠的疏水域特异性结合,SBD和NBD通过一绞合链结构连接,发挥分子伴侣功能[26-28]。在HSP70亚家族中不同定位的蛋白质氨基酸C末端有特定的高度保守序列,如PECDVLDADFT?DSK、PEAEYEEAKK、EEVD和HDEL分别定位于质体、线粒体、细胞质及内质网中。本研究中文心兰OnHSP70基因编码蛋白的C末端具有典型的特征基序EEVD,蛋白质定位分析显示其存在于细胞质中,与细胞质型HSP70蛋白结构特点相一致[29]。推测OnHSP70能够在逆境胁迫时通过调节细胞的生理功能,作为分子伴侣参与蛋白质的正确装配,以维持蛋白质的特定构象[30]。
3.2 OnHSP70在不同组织器官中的表达具有差异性
热激蛋白作为看家蛋白参与植物的生长发育过程,因此在不同组织部位中均有表达,但是细胞质型HSP70在不同物种的不同组织器官中的表达量具有较大的差异性。在腊梅成熟叶中HSP70的表达量最高[24];在蝴蝶兰根中该基因表达水平最高,花中表达水平最低[20];在紫花苜蓿研究中发现,该基因在花中表达量明显高于其他器官[31]。本研究对OnHSP70表达分析发现,其在文心兰不同器官中均有表达,在花中响应最显著。此结果与紫花苜蓿的研究结果相一致,而与同为兰科的蝴蝶兰差异较大,原因可能是蝴蝶兰开花需要进行低温春化,而文心兰则在较高温度仍能正常开花。推测该基因在文心兰花发育阶段起重要作用,参与文心兰花形态建成。
3.3 高温能显著诱导OnHSP70的表达
已有大量的研究表明温度与HSP70的表达密切相关。高温胁迫能促进小麦[32]、海带[33]、水稻[34-35]、玉米[36]、花生[37]、豌豆[38]、烟草[39]和紫茎泽兰[30]等HSP70的表达,说明HSP70在逆境中发挥其分子伴侣作用,通过维持植物生长发育相关蛋白的稳定构象,提高植株应对不利环境的能力。本研究表明,高温对OnHSP70的表达存在非常明显的诱导作用,高温虽不利于有机体大部分蛋白质的合成,但OnHSP70为稳定蛋白,在胁迫初期该基因的应激响应显著,能通过短时间内的大量表达以修复因高温变性或合成受阻的蛋白质,从而保护其它蛋白质免受伤害,适应高温环境,降低植株的损伤[40]。随着处理时长的增加,OnHSP70后期响应呈现下降趋势,这与HSP70在其他植物中的研究结果一致。推测原因是热激基因长时间处于较高的表达状态不利于植株的生长[41-42]。因此,在缓解了植物高温胁迫造成的不良影响后,HSP70的表达量就会下降。
3.4 水杨酸和茉莉酸甲酯处理OnHSP70的响应情况
水杨酸和茉莉酸甲酯都能够作为信号分子对逆境作出应答反应,诱导合成、参与和调控植物的多种生理生化过程,从而提高植物的抗逆性。已有研究结果表明,水杨酸与香蕉[43]、水稻[34]、玉米[36]、蝴蝶蘭[44]等幼苗耐热性的形成有关;水杨酸可以通过调节植物体内脯氨酸含量缓解高温胁迫对龙须菜产生的不利影响[45-46]。邹清成等[47]通过对蝴蝶兰的研究表明,茉莉酸甲酯作为生物调节剂能够提高幼苗抗逆性;茉莉酸甲酯还可以通过调节水稻叶片胡萝卜素含量缓解孕穗期的高温伤害[48]。本研究OnHSP70对茉莉酸甲酯呈现明显下调响应,在水杨酸诱导1 h时上调响应,之后表达量下降,整体呈现先上调后下调的响应特征。可能是由于水杨酸和茉莉酸甲酯在作为信号分子调节植物抗性作用途径时相对独立,且HSP70的抗逆作用机制与水杨酸和茉莉酸甲酯存在协同作用[49]。
综上所述,OnHSP70由647个氨基酸构成,是稳定蛋白,属于HSP70超家族,具有1个高度保守的结构域,且C末端存在EEVD序列,蛋白亚细胞定位于细胞质。尽管不同植物的HSP70在进化方向差异较大,但通过同源性分析显示OnHSP70与其他植物的氨基酸序列具有极高的相似度。OnHSP70表达模式分析表明:该基因在文心兰的不同组织部位中均有表达,且具有显著差异性,在花中表达量最高;该基因能够显著响应高温胁迫,尤其在40 ℃处理4 h时表达量达峰值;该基因对水杨酸和茉莉酸甲酯呈现出不同的响应特征,但整体呈现出下调的趋势。上述结果说明,OnHSP70在文心兰生长发育过程中发挥作用,且参与文心兰对环境胁迫的适应性,为该基因功能的研究及提高文心兰对高温的适应性提供参考,本试验研究结果也对后期开展文心兰耐高温品种的选育具有积极意义。
参考文献
[1] 罗远华, 王振波, 黄敏玲, 等. 高温胁迫对文心兰顶叶若干生理指标的影响[J]. 福建农业学报, 2017, 32(6): 625-629.
[2] 杨 学, 叶 炜, 李永清, 等. 南茜文心兰软腐病病原分离鉴定及致病性分析[J]. 亚热带植物科学, 2017, 46(3): 201-208.
[3] S Lindquist A, Craig E A. The heat-shock proteins[J]. Annual Review of Genetics, 1988, 22(3): 631-677.
[4] 王明强, 张道远. 植物热激蛋白70基因家族及其生物学功能研究进展[J]. 基因组学与应用生物学, 2015, 34(2): 421-428.
[5] Ritossa F. A new puffing pattern induced by temperature shock and DNP in Drosophila[J]. Experientia, 1962, 18(12): 571-573.
[6] Welch W J. Mammalian stress response: cell physiology, structure/function of stress proteins, and implications for medicine and disease[J]. Physiological Reviews, 1992, 72(4): 1063-1081.
[7] 齐 妍, 徐兆师, 李盼松, 等. 植物热激蛋白70的分子作用机理及其利用研究进展[J]. 植物遗传资源学报, 2013, 14(3): 507-511.
[8] 张毓婷, 王敏华, 陈家栋, 等. 雷蒙德氏棉HSP70基因家族的进化分析及其同源基因在陆地棉中的表达分析[J]. 遗传, 2014, 36(09): 921-933.
[9] Guo M, Liu JH, Ma X, et al. Genome-wide analysis of the Hsp70 family genes in pepper (Capsicum annuum L.) and functional identification of CaHsp70-2 involvement in heat stress[J]. Plant Science, 2016, 252: 246-256.
[10] Huang XY, Tao P, Li BY, et al. Genome-wide identification, classification, and analysis of heat shock transcription factor family in Chinese cabbage (Brassica rapa pekinensis)[J]. Genetics & Molecular Research, 2015, 14(1): 2189-2204.
[11] Latijnhouwers M, Xu X M, Mller S G. Arabidopsis stromal 70-kDa heat shock proteins are essential for chloroplast development[J]. Planta, 2010, 232(3): 567-578.
[12] Wang Y, Lin S, Song Q, et al. Genome-wide identification of heat shock proteins (Hsps) and Hsp interactors in rice: Hsp70s as a case study[J]. BMC Genomics, 2014, 15(1): 344.
[13] Liu J X, Wang R M, Liu W Y, et al. Genome-wide characterization of heat-shock protein 70s from Chenopodium quinoa and expression analyses of Cqhsp70s in response to drought stress[J]. Genes, 2018, 9(2): 35.
[14] Yer E N, Baloglu M C, Ziplar U T, et al. Drought-responsive Hsp70 gene analysis in Populusat genome-wide level[J]. Plant Molecular Biology Reporter, 2016, 34(2): 483-500.
[15] Duan Y H, Guo J, Ding K, et al. Characterization of a wheat HSP70 gene and its expression in response to stripe rust infection and abiotic stresses[J]. Molecular Biology Reports, 2011, 38(1): 301-307.
[16] 黄小云, 陶 鹏, 李必元, 等. 植物热激转录因子基因家族的研究进展[J]. 浙江农业科学, 2014, 1(9): 1323-1332, 1336.
[17] Velazquez J M, Lindquist S. Hsp70: nuclear concentration during environmental stress and cytoplasmic storage during recovery[J]. Cell, 1984, 36(3): 655-662.
[18] Mayer M P, Bukau B. Hsp70 chaperones: cellular functions and molecular mechanism[J]. Cellular and Molecular Life Sciences, 2005, 62(6): 670-684.
[19] 李东宾, 高燕会, 斯金平, 等. 铁皮石斛HSP70基因的克隆及冷胁迫表达分析[J]. 中国中药杂志, 2013, 38(20): 3446-3452.
[20] 袁秀云, 许申平, 王默霏, 等. 蝴蝶兰热激蛋白基因PhHsp70序列分析及對冷胁迫的响应[J]. 安徽农业大学学报, 2018, 45(3): 519-525.
[21] 孔倩倩. 高温胁迫下文心兰对外源水杨酸的生理响应及WRKY基因的克隆[D]. 福州: 福建农林大学, 2017, 21-22.
[22] 李 蓉, 吴晓佩, 王雪晶, 等. 文心兰RFNR的克隆、亚细胞定位及其与LFNR不同的胁迫响应机制研究[J]. 园艺学报, 2018, 45(11): 2164-2176.
[23] 郭艳芳, 王丛巧, 李 蓉, 等. 文心兰PAD4基因克隆及表达分析[J]. 热带作物学报, 2018, 39(12): 2436-2445.
[24] 阮文进, 门维婷, 马 婧, 等. 蜡梅热激蛋白基因CpHSP70-1的克隆、亚细胞定位与表达分析[J]. 西南大学学报(自然科学版), 2016, 38(1): 43-52.
[25] 陈 旭, 石 垒, 朱 璐, 等. 植物HSP70蛋白家族分子进化特征及其表达模式分析[J]. 基因组学与应用生物学, 2017, 36(10): 4282-4294.
[26] Wilbanks S M, Delucaflaherty C, Mckay D B. Structural basis of the 70-kilodalton heat shock cognate protein ATP hydrolytic activity. I.Kinetic analyses of active site mutants [J]. Journal of Biological Chemistry, 1994, 269(17): 12893-12898.
[27] Nelson R J. The translation machinery and 70 kD heat shock protein cooperate in protein synthesis [J]. Cell, 1992, 71(1): 97-105.
[28] Kang P J, Ostermann J, Shilling J, et al. Requirement for hsp70 in the mitochondrial matrix for translocation and folding of precursor proteins [J]. Nature, 1990, 348(6297): 137-143.
[29] 王宇萍, 蒋建东. 热休克蛋白70的结构和功能[J]. 中国细胞生物学学报, 2010, 32(2): 305-313.
[30] 肖艳萍, 宫伟娜, 万方浩, 等. 紫茎泽兰热激蛋白70基因的克隆与序列分析[J]. 中国农业科技导报, 2010, 12 (1): 111-117.
[31] 栗振义. 紫花苜蓿热激蛋白基因MsHSP70的克隆及功能分析[D]. 北京: 中国农业科学院, 2015: 25-27.
[32] 安艳秋, 蔺瑞明, 冯 晶, 等. 小麦热激蛋白基因TaHSP70克隆及其在植物防卫和抗逆反应中的表达分析[J]. 分子植物育种, 2011, 9(4): 402-409.
[33] 袁艳敏, 刘福利, 梁洲瑞, 等. 海带hsp70基因的克隆、分析及转录水平定量研究[J]. 渔业科学进展, 2018, 39(4): 152-158.
[34] 黄上志, 黄祥富, 林晓东, 等. 热激对水稻幼苗耐冷性及热激蛋白合成的诱导[J]. 植物生理与分子生物学学报, 2004, 30(2): 189-194.
[35] 王 群, 方荣祥. 水稻热激蛋白70基因的序列及热诱导表达[J]. 中国科学(B辑 化学 生命科学 地学), 1995, 25(12): 1263-1272.
[36] 李慧聪, 郭秀林, 王冬梅, 等. 玉米热激蛋白70基因对温度胁迫的响应[J]. 河北农业大学学报, 2010, 33 (6): 12-15, 25.
[37] 李 翠, 侯 蕾, 任 丽, 等. 花生热激蛋白AhHSP70与热激因子AhHSF基因的克隆及表达分析[J]. 山东农业科学, 2015, 47(4): 1-7.
[38] Zhang L, Zhao H K, Dong Q L, et al. Genome-wide analysis and expression profiling under heat and drought treatments of HSP70 gene family in soybean (Glycine max L.) [J]. Frontiers in Plant Science, 2015, 6: 773-795.
[39] 陈二龙, 范志勇, 王松峰, 等. 烟草Hsp70基因家族的鉴定及NtHsp70Chl基因的表达分析[J]. 中国烟草科学, 2018, 39(2): 8-15, 16.
[40] 张 杨, 孙 明, 杨海燕, 等. 菊花脑热激蛋白70基因的克隆及表达分析[J]. 湖南农业大学学报 (自然科学版), 2014, 40(2): 153-156.
[41] 趙真真, 韩莹琰, 李雅博, 等. 叶用莴苣热激蛋白LsHsp70-1707基因的克隆及表达分析[J]. 中国农业大学学报, 2015, 20(5): 171-178.
[42] Krebs R A, Holbrook S H. Reduced enzyme activity following Hsp70 overexpression in Drosophila melanogaster[J]. Biochemical Genetics, 2001, 39(1-2): 73-82.
[43] 冯 斗, 禤维言, 黄政树, 等. 茉莉酸甲酯对低温胁迫下香蕉幼苗的生理效应[J]. 果树学报, 2009, 26(3): 390-393.
[44] 杨华庚, 颜速亮, 陈慧娟, 等. 高温胁迫下外源茉莉酸甲酯、钙和水杨酸对蝴蝶兰幼苗耐热性的影响[J].中国农学通报, 2011, 27(28): 150-157.
[45] 顾颖慧. 龙须菜热激蛋白70(HSP70)基因克隆及热激下的表达模式分析[D]. 青岛: 中国海洋大学, 2011.
[46] 朱招波, 孙 雪, 徐年军, 等. 水杨酸对龙须菜抗高温生理的影响[J]. 水产学报, 2012, 36(8): 1304-1312.
[47] 邹清成, 朱开元, 刘慧春, 等. 外源茉莉酸甲酯对非生物胁迫下蝴蝶兰幼苗叶绿素荧光和抗氧化指标的影响[J]. 植物生理学报, 2011, 47(9): 913-917.
[48] 刘 霞, 唐 设, 窦 志, 等. 茉莉酸甲酯对武运粳24和宁粳3号灌浆早期高温胁迫生理特性的影响[J]. 中国水稻科学, 2016, 30(3): 291-303.
[49] 陆 雯, 潘璐琪, 王雪艳. 水杨酸及茉莉酸介导植物抗病性的研究进展[J]. 贵州农业科学, 2013, 41(10): 40-43.

