刀豆蛋白A对小鼠肝线粒体结构和功能的影响
张 娴,杨 鹏,赵 军,胡 娜,党学良,张 琰
(1.空军第986医院药剂科,陕西 西安 710054;2.空军军医大学唐都医院药剂科,陕西 西安 710038)
刀豆蛋白A(concanavalin A,Con A)导致的肝损伤小鼠是一种自身免疫性肝损伤模型[1],其病理机制在于Con A对CD4+T淋巴细胞和库普弗细胞的过度激活[2-3],并通过干扰素γ和肿瘤坏死因子α的大量释放[4],导致肝细胞坏死。当前针对Con A肝损伤的研究主要集中在免疫细胞活化[5]及相应的抗炎治疗[6-8],而肝细胞坏死的详细病理机制仍不清楚[9-10]。线粒体是细胞的能量工厂,线粒体结构和功能的改变直接影响细胞的结局,是调节细胞存活或死亡的关键细胞器。已有文献报道,Con A体外能降低肝成纤维细胞的线粒体膜电位,诱导细胞凋亡[11];而Con A导致小鼠肝损伤时肝细胞的死亡方式属于坏死而不是凋亡,此时肝细胞线粒体是否存在损伤,其结构和功能又发生了何种改变尚不清楚。线粒体的主要功能是进行氧化磷酸化合成ATP,为细胞生命活动提供直接能源[12]。ATP与ADP和AMP的相互转化实现贮能和放能,从而保证细胞各项生命活动的能量供应。谷氨酸脱氢酶(glutamate dehydrogenase,GDH)是一种特异性的线粒体酶,位于线粒体基质中,在肝组织高表达,当线粒体损伤导致内膜通透性提高时,GDH释放到血清中[13]。因此,通过测定Con A肝损伤小鼠血清中GDH活性变化以及肝组织中各腺苷酸的含量变化,结合透射电镜观察线粒体形态,可反映该模型肝细胞线粒体结构及其功能的变化,对于揭示线粒体损伤是否参与该模型小鼠的肝细胞病理损伤机制具有重要意义。
1 材料与方法
1.1 动物、药物、试剂和仪器
C57BL/6J小鼠,SPF级,雄性,6~8周,体质量18~22 g,由空军军医大学实验动物中心提供,合格证号SCXK(军)2012-0007,许可证号:SYXK(军)2012-0023。实验动物在20~25℃,湿度40%~60%,12/12 h昼夜节律条件下标准饲料喂养,自由饮水适应1周。实验操作经空军军医大学动物伦理委员会审批。用灭菌生理盐水将Con A分别配制成2和4 g·L-1溶液,并用0.22 μm微孔滤膜滤过,现用现配。
Con A(货号:002631,Sigma,美国);ATP标准品(货号:A3854),ADP标准品(货号:A4752),AMP标准品(货号:HFBM150110521099)(合肥博美);谷丙转氨酶(glutamic pyruvic transaminase,GPT)活性测定试剂盒(货号170601)和GDH活性测定试剂盒(货号257389)(上海透景诊断科技有限公司)。安捷伦1200高效液相色谱仪(安捷伦美国);T10型ULTRA-TURRAX匀浆器(IKA,德国);CR21F超高速冷冻离心机和200FR全自动生化分析仪(东芝,日本);PB-10酸度计(赛多利斯,德国);JEM-1230透射电镜(JEOL,日本)。
1.2 动物分组和给药
实验前,将30只C57BL/6J小鼠禁食不禁水15 h,按体质量随机分为3组,每组10只,分别为正常对照组(尾静脉注射灭菌生理盐水)、Con A 10和20 mg·kg-1组(尾静脉注射Con A 0.05 mL·10 g-1),给药后8 h摘眼球取血并处死[1],全血静置30 min后3000×g离心10 min取血清。
1.3 全自动生化分析仪检测血清GPT和GDH活性
采用全自动生化分析仪,按照速率法测定血清GPT及GDH活性,当测定数据超出仪器检测线性范围时将血清样本用生理盐水稀释10倍后重新进样测定。
1.4 HE染色观察肝组织病理变化
取肝左叶组织于4%多聚甲醛中固定24 h,石蜡包埋,常规方案脱蜡,进行苏木素和伊红染色。
1.5 透射电镜观察肝细胞线粒体结构
取肝左叶组织于4%冷戊二醛溶液中固定8 h,0.1 mol·L-1磷酸盐缓冲液中漂洗3次;将组织样品在1%锇酸中固定2 h,再次漂洗3次;然后脱水包埋在聚合物树脂中,制备超薄切片,用2%乙酸铀酰和柠檬酸铅染色,通过透射电镜观察肝细胞线粒体结构。
1.6 高效液相色谱测定肝组织中ATP,ADP和AMP含量
小鼠处死后,迅速取肝组织约0.3 g,按5 mL·g-1加入预冷的0.4 mol·L-1高氯酸溶液,上述操作在30 s内完成。冰浴上高速匀浆,10 000×g下低温离心10 min,精密量取上清液并加同体积预冷的1 mol·L-1磷酸氢二钾溶液,调 pH 至 6.5;再次10 000×g低温离心10 min,取上清液用0.22 μm滤膜过滤,置-20℃保存,进行HPLC检测。
色谱条件经本室优化,采用Ultimate TM AQ-C18亲水色谱柱(150 mm×4.6 mm,5 μm);柱温25℃;流动相为50 mmol·L-1磷酸二氢钾缓冲液(pH 5.75);流速1.4 mL·min-1;检测波长259 nm;进样量20 μL。
1.7 统计学分析
实验结果数据采用±s表示,采用GraphPad Prism 8.02软件,进行统计学分析,多组之间比较采用单因素方差分析,各组与正常对照组比较采用Dunnettt检验,P<0.05认为差异具有统计学意义。
2 结果
2.1 Con A对小鼠血清GPT和GDH活性的影响
血清生化结果(图1)显示,给药8 h后,与正常对照组比,ConA10和20mg·kg-1组小鼠血清GPT活性显著升高(P<0.05,P<0.01),提示小鼠出现明显的肝损伤;血清GDH活性分别升高0.34和3.04倍(P<0.01),提示Con A可致小鼠线粒体膜通透性增高。
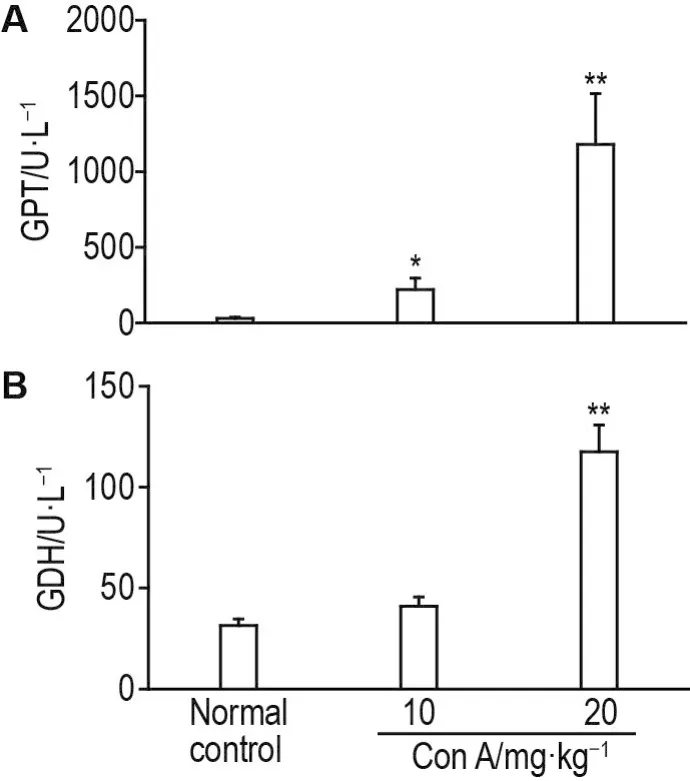
Fig.1 Effect of concanavalin A(Con A)on activity of serum glutamic pyruvic transaminase(GPT)and glu⁃tamate dehydrogenase(GDH)in mice.Mice in Con A 10 or 20 mg·kg-1group were iv injected with Con A 5 mL·kg-1.The mice in normal control group were iv given with sterile saline by tail vein.±s,n=9-10.*P<0.05,**P<0.01,compared with normal control group.
2.2 Con A对小鼠肝组织病理变化的影响
HE染色结果(图2)显示,给药8 h后,Con A组小鼠肝组织肝窦间隙及汇管区出现炎症细胞浸润,肝小叶有点灶样坏死;Con A 20 mg·kg-1组大量肝细胞肿胀,呈片状坏死。上述结果表明,Con A导致小鼠肝细胞坏死。
2.3 Con A对小鼠肝细胞线粒体结构的影响
透射电镜观察结果(图3)显示,正常对照组肝细胞线粒体成粒状,双层膜结构以及嵴结构清晰完整;Con A 10 mg·kg-1组线粒体部分出现双层膜结构的破坏;Con A 20 mg·kg-1组线粒体双层膜结构不完整,且线粒体肿胀,形状高度不规则。表明Con A可致肝细胞线粒体结构完整性明显破坏。
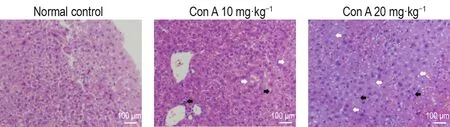
Fig.2 Effect of Con A on pathology changes in liver tissue of mice by HE stainning.See Fig.1 for the mouse treat⁃ment.Black arrows show inflammatory cells and white arrows show liver cell necrosis.
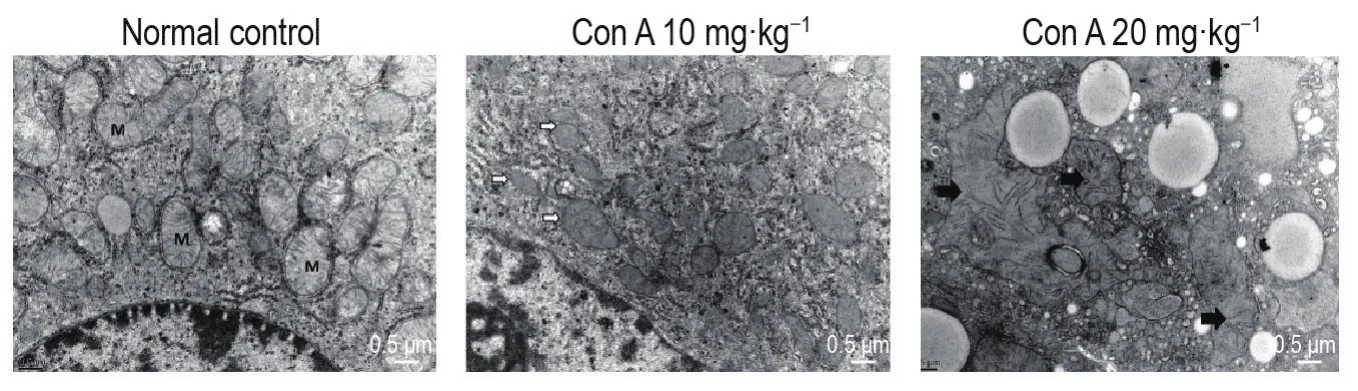
Fig.3 Effect of Con A on hepatocyte mitochondrial structure of mice by transmission electron microscopy.See Fig.1 for the mouse treatment.M:normal mitochondria;white arrow:mitochondria with loss of double limiting membrane;black arrow:large degenerative mitochondria.
2.4 Con A对小鼠肝组织中ATP,ADP和AMP含量的影响
将HPLC分析所得供试品各腺苷酸浓度(mg·L-1)按稀释比换算为nmol·g-1肝组织(图4A)。实验结果表明,与正常对照组比,Con A 10和20 mg·kg-1组小鼠肝组织中ATP含量分别下降了25.6%和38.3%(P<0.01),ADP含量分别下降了36.0%和47.1%(P<0.01)。AMP含量变化无统计学差异。
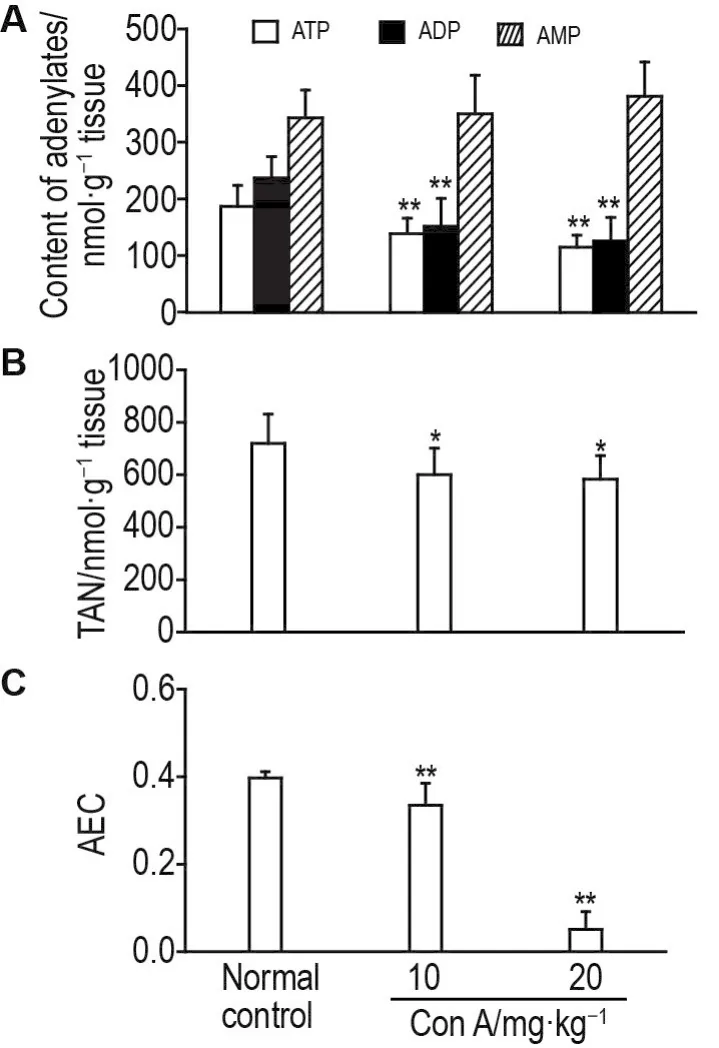
Fig.4 Effect of ConA on contents of ATP,ADP,AMP,total adenine nucleotide(TAN)and adenylate energy charges(AEC)in liver tissue of mice.See Fig.1 for the mouse treatment.TAN=ATP+ADP+AMP;AEC=〔(ATP)+1/2(ADP)〕/TAN.x±s,n=9-10.*P<0.05,**P<0.01,compared with normal control group.
将实验所得各组腺苷酸含量,按公式计算肝组织总体腺苷酸库水平TAN=ATP+ADP+AMP和能荷水平 AEC=〔(ATP)+1/2(ADP)〕/TAN[14](图 4B和4C)。结果表明,与正常对照组比,Con A 10和20 mg·kg-1组小鼠肝组织TAN水平分别降低了16.5%和18.9%(P<0.05),AEC下降了15.7%和28.1%(P<0.01)。
3 讨论
本研究结果表明,Con A可导致小鼠血清GPT升高,肝细胞坏死。血清GDH活性显著升高,表明肝组织线粒体膜通透性提高,提示肝细胞线粒体结构完整性可能受到损伤。透射电镜观察肝细胞结构,发现肝细胞线粒体肿胀、形状不规则,双层膜结构破坏严重,表明该模型中肝细胞线粒体存在明显的结构损伤。进一步线粒体功能学研究表明,模型小鼠肝组织中高能化合物ATP和ADP的含量显著下降,AMP略有升高,总体上表现为腺苷酸库和能荷的显著降低,表明肝线粒体呼吸链氧化磷酸化功能下降,生成高能磷酸化合物的能力下降,肝细胞能量储备减少[14]。
线粒体是细胞能量生成和细胞存亡信号调节的关键细胞器。有研究表明,对乙酰氨基酚诱导的肝坏死小鼠和细胞模型中,当补充ATP合成的前体果糖和甘氨酸后,肝细胞坏死程度显著降低,此时再给予线粒体膜通透性转换抑制剂环孢素A,将进一步增强肝细胞保护作用[15-16]。对乙酰氨基酚肝损伤模型提示,改善线粒体的功能,维护线粒体膜结构的完整性对于抑制肝细胞坏死可能具有重要的治疗意义。有研究表明,Con A体外能够诱导细胞凋亡[11];但对小鼠,Con A诱导的肝细胞的死亡方式属于坏死而不是凋亡[17-18],本研究HE染色的病理结果也支持这一结论。也有文献报道,清除线粒体呼吸链来源的氧自由基对Con A诱导的小鼠肝损伤具有显著的保护作用[19]。因此提示,线粒体损伤可能是Con A诱导小鼠肝细胞坏死的关键细胞器。
综上所述,在Con A致免疫性肝损伤小鼠中,线粒体的结构和功能均出现了一定程度的损伤,表明线粒体损伤参与了免疫性肝损伤的病理机制。因此提示,修复线粒体损伤很可能是免疫性肝损伤除抗炎之外的一个新的治疗策略。

