氯喹和羟氯喹药理特性及新型冠状病毒肺炎(COVID-19)治疗应用
张赛龙,缪朝玉
(海军军医大学药学系药理学教研室,上海 200433)
2019年底,由于新型冠状病毒——严重急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)感染,造成新发传染病,即新型冠状病毒肺炎(Corona Virus Disease 2019,COVID-19)。目前COVID-19在全球大规模流行,发病和死亡人数持续增加。世界卫生组织在2020年3月12日也宣布疫情为大范围流行[1]。有研究表明,81%患者是轻症,表现为无肺炎或轻度肺炎;14%是重症,有呼吸困难等表现;5%是危重症,需要呼吸机等急救;总死亡率约为2.3%,但70~79岁患者死亡率达8.0%,80岁以上患者死亡率达14.8%[2]。因此,迫切需要有效安全的治疗方法,同时减少病毒携带的时间,以限制病毒的传播。在治疗COVID-19的候选药物中,“老药新用”是主流策略,因为“老药”的基本药理特性包括安全性、药物相互作用等方面的信息已知,为临床治疗和临床试验可提供一定的安全保障。
最近一项体外研究报道了瑞德西韦(remdesivir)(一种新的抗病毒药物)和氯喹(chloroquine)(一种经典的抗疟疾药物)对SARS-CoV-2生长的抑制作用[3]。在COVID-19患者中进行的初步临床治疗结果表明,与对照组相比,氯喹在临床疗效和病毒清除方面均有效[4-5]。氯喹列入中国《新型冠状病毒肺炎诊疗方案(试行第六版)》,并在第七版细化更新[6-7]。已被证实,羟氯喹(氯喹同类药)体外具有抗SARS冠状病毒的活性[8]。最近,法国初步临床观察也发现羟氯喹对COVID-19有治疗效果[9]。随后,美国紧急授权,允许医生使用氯喹和羟氯喹治疗COVID-19。目前,虽然氯喹和羟氯喹在治疗COVID-19中显示出初步效果,但仍需大量临床试验进行验证,确定其有效性。为了让广大医务工作者更好地了解氯喹和羟氯喹,本文简要概括它们的临床应用发展史,重点介绍其药动学特征、不良反应以及最近COVID-19治疗应用和潜在的药理作用机制,希望有助于临床用药。
1 临床应用发展史
氯喹和羟氯喹作为抗疟疾药的起源可追溯到17世纪奎宁治疗疟疾(图1),当时民间采用金鸡纳树皮粉末或提取物治疗疟疾。奎宁是金鸡纳树皮中主要的生物碱,于1820年提取分离,1944年化学合成。早期药物发现多来自民间草药(天然药)经验用药,氯喹和羟氯喹虽然是化学合成,但其起源及临床应用发展史与经验用药密切相关。奎宁、氯喹和羟氯喹是同类药物,同属于喹啉类衍生物。氯喹于1934年合成,1949年美国食品药品监督管理局(Food and Drug Administration,FDA)批准上市,因其比奎宁更加安全有效,因此广泛用于治疗和预防疟疾。1950年,在氯喹的基础上合成出一种新型抗疟疾药——羟氯喹,该药于1955年美国FDA批准上市,治疗作用与氯喹相近[10]。氯喹和羟氯喹是通过偶然和经验用药成为抗风湿药物的,早在20世纪40年代已开始用于治疗风湿病。它们均未经过常规的药物研发过程,但均已成为当前治疗类风湿性关节炎、系统性红斑狼疮、抗磷脂综合征和原发性干燥综合征的临床指南用药。随后还发现,氯喹可作为自噬抑制剂,具有潜在的抗肿瘤活性;羟氯喹可发挥抗血栓相关的心血管保护作用等。由于药物用于慢性病长期治疗,近年来视网膜病变不良反应受到重视。合适剂量的探索是当前和未来用药获益和风险临床实践的挑战。
2 化学结构
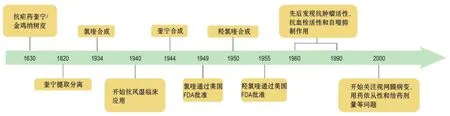
图1 氯喹和羟氯喹临床应用发展史.很久以前使用金鸡纳树皮粉末或提取物(主要生物碱成分为奎宁)治疗疟疾,1820年首次提取和分离奎宁.随后合成抗疟药奎宁、氯喹和羟氯喹等.自20世纪40年代,氯喹和羟氯喹也被用于治疗风湿病.其他潜在的临床用途在研究和扩充中,药物剂量、疗效、不良反应的关系继续探索中.

图2 氯喹和羟氯喹的结构及其代谢产物.氯喹和羟氯喹的基本母核是4-氨基喹啉,在细胞色素P450酶作用下,产生活性代谢产物,分别是去乙基氯喹、去乙基羟氯喹和双去乙基氯喹.奎宁和奎尼丁是非对映异构体,为抗疟疾药和抗心律失常药,与氯喹和羟氯喹同属喹啉类衍生物.
氯喹和羟氯喹属于4-氨基喹啉类药物,均具有芳香环核心结构和弱碱性基团,弱碱性侧链有助于在溶酶体中积累,这条侧链对药物的活性以及与核酸的潜在相互作用至关重要(图2)。氯喹和羟氯喹均以对映异构体(r和s)出现。(r)-羟氯喹在血液中的浓度高于(s)-羟氯喹,表明在药物的沉积或代谢中存在立体选择过程[11]。药物对映异构体的有效性和安全性也可能不同。但有研究表明,氯喹的2种异构体在体外的作用相似,对大鼠体内的胚胎毒性也相同[12]。氯喹对映异构体的药物正在研发中,以期减少不良反应,如降低视网膜病变的风险,但需进一步的临床验证[13]。
3 药动学
3.1 吸收
氯喹和羟氯喹具有很大的表观分布容积和很长的半衰期,使其药动学特征非常复杂,至今未被完全阐明[11]。氯喹是以磷酸盐的形式给药,而羟氯喹是以硫酸盐的形式给药。磷酸氯喹和硫酸羟氯喹通常在肠道上段吸收[14]。从口服硫酸羟氯喹(200 mg)到其在血液中能够被检测出的时间通常为0~0.85 h(平均0.43 h)[14],氯喹和羟氯喹的生物利用度均为70%~80%[15](图3)。有报道显示,氯喹和羟氯喹人体药动学特征有明显不同,但是这些差异可能是由于不同的分析方法、不同的样本来源(如血浆和全血)或者两药肾清除率的差异所造成的[15]。
3.2 分布
吸收后,由于氯喹和羟氯喹的表观分布容积非常大(氯喹为65 000 L,羟氯喹为47 257 L),导致它们的半衰期相当长(40~60 d)[16]。它们均可分布到细胞液和细胞间液中,在体内的停留时间非常长(氯喹为900 h,羟氯喹为1 300 h)[16](图3)。氯喹和羟氯喹在血浆、全血和血清中的浓度因人而异(特别是血清和全血)[15]。关于“深层”组织和器官(例如淋巴组织、免疫细胞、骨髓、滑膜组织和其他结缔组织)中药物浓度的信息很少,而且应用三室模型并不能预测这些“深层”组织和器官中的药物浓度。由于结构中具有弱碱基,羟氯喹可以在酸性小泡中积累,如溶酶体[17]。羟氯喹能够与黑色素紧密结合,可以在皮肤和眼睛等含有黑色素的组织中沉积,这可能解释了该药物某些组织特异性机制(如引起视网膜病变的不良反应或治疗皮肤疾病的疗效)。临床观察表明,与氯喹相比,羟氯喹的视网膜病变风险较低,这可能与羟氯喹的表观分布容积小于氯喹有关。
3.3 代谢
氯喹和羟氯喹在体内的代谢转化主要在肝进行,经过细胞色素P450(cytochrome P450,CYP)酶代谢后,其主要代谢产物分别是去乙氯喹和去乙羟氯喹,而后继续代谢成双去乙氯喹,这3种代谢产物均有活性[18]。
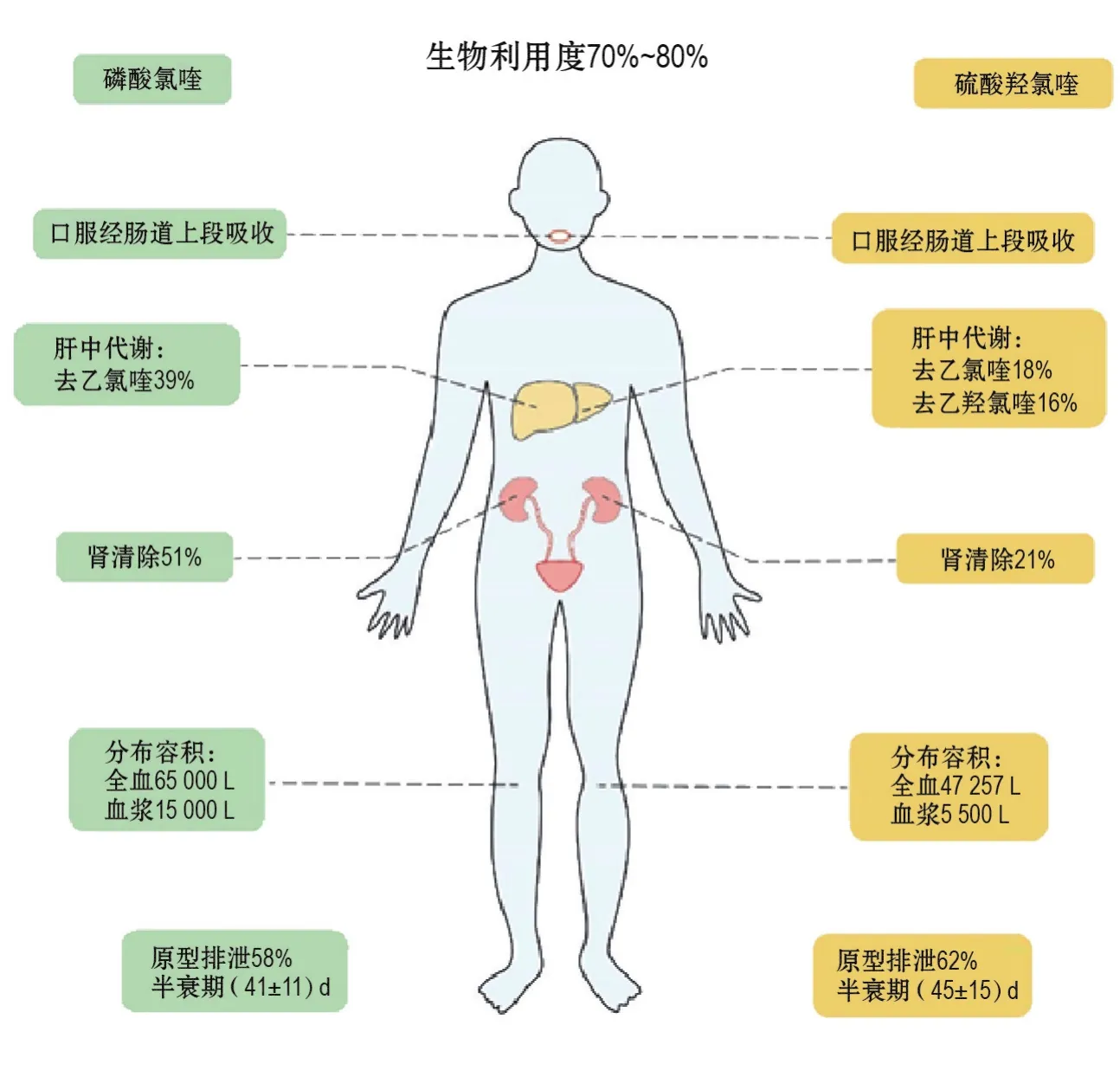
图3 氯喹和羟氯喹的药动学特性.
3.4 排泄
约有1/2的氯喹以原形经肾排泄,其排泄速度可因尿液酸化而加快,因尿液碱化而降低;氯喹也可由乳汁中排出[19]。氯喹和羟氯喹的肾清除率存在差别,分别为51%和21%,提示肾功能损伤影响药物排泄对氯喹更加明显。由于氯喹和羟氯喹具有长达约50 d的血浆消除半衰期,这些药物及其代谢产物在体内会产生明显蓄积(图3)。因此,肾清除能力是非常重要的因素,尤其是肾功能衰竭患者,因为清除减少会进一步造成这些药物在体内的蓄积[11]。
3.5 药物相互作用
氯喹和羟氯喹都是CYP酶的底物,因此可以干扰其他药物的代谢。CYP酶催化氯喹和羟氯喹脱烷基化生成药理活性代谢物[20]。研究显示,CYP2C8,CYP3A4,CYP2D6和CYP1A1能代谢氯喹[10]。
主要的药物相互作用包括:①氯喹会明显增加洋地黄毒苷的血药浓度[21]。因此,在氯喹治疗过程中,需要密切监测洋地黄毒苷的水平(表1)。②羟氯喹通过与CYP2D6竞争抑制美托洛尔的代谢,美托洛尔的血药浓度随着羟氯喹的增加而增加[22]。但被CYP2D6代谢的某些药物,如右美沙芬,在羟氯喹治疗期间未增加[22]。③由于奎宁和奎尼丁等这类抗疟疾、抗心律失常药(图2)会干扰心电图QT间期,所以服用氯喹或羟氯喹的患者也应该监测潜在的心律失常风险,特别是与抗心律失常药合用时要密切监护。④他莫昔芬与羟氯喹联合用药,由于可协同抑制视网膜上皮细胞中的溶酶体酶,增加了眼毒性的风险[23]。因此,眼科专家建议,联合使用他莫昔芬和羟氯喹或氯喹时应该限制在6个月以内。⑤羟氯喹可通过改变pH值进而减少甲氨蝶呤在胃肠道的吸收,从而降低甲氨蝶呤的生物利用度[24]。这种效应可以解释为什么在与羟氯喹合用期间,甲氨蝶呤相关的急性肝毒性风险反而降低[25]。⑥羟氯喹也可以增加环孢素的血药浓度,因此在联合治疗期间也应密切监测环孢素的水平[26]。所以,使用氯喹或羟氯喹,需要关注其与心血管、肿瘤和免疫等药物的相互作用。
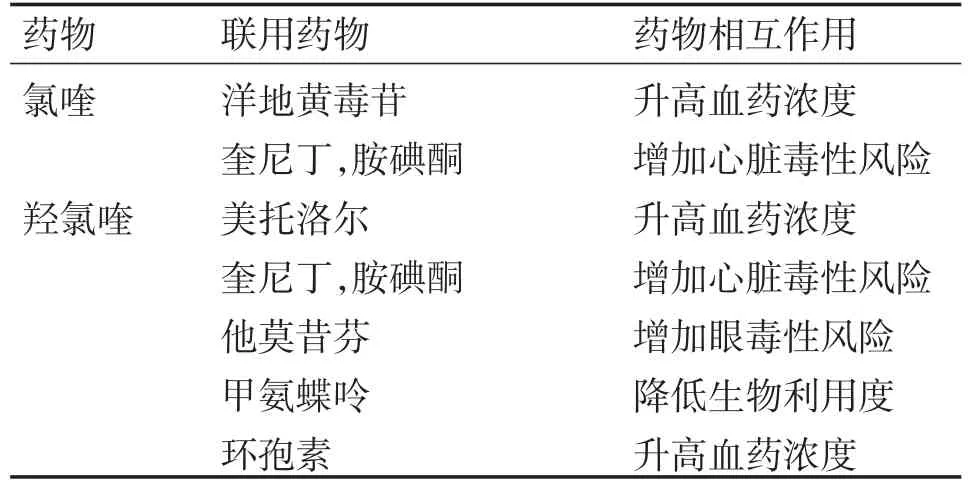
表1 氯喹或羟氯喹与药物联用的药物相互作用
3.6 对胎儿和母乳喂养婴儿的安全性
尽管氯喹和羟氯喹均能够通过胎盘,并且由于胎儿组织中存在与药物结合的色素,但是这些药物对胎儿还未见明显的毒性。目前的欧洲抗风湿病联盟(The European League Against Rheumatism,EULAR)最新指南中仍然建议患有自身免疫性疾病的孕妇继续使用羟氯喹[27]。也有数据表明,怀孕期间服用羟氯喹对先天性心脏病有保护作用,这可能是由于羟氯喹减少Ⅰ型干扰素表达[28]。目前也并无关于羟氯喹对胎儿心脏毒性的报道。氯喹和羟氯喹可以通过母乳喂养传给婴儿,但是并未见有不良反应的报道。总的来说,目前研究表明,氯喹和羟氯喹对于胎儿和母乳喂养婴儿是安全的。
4 不良反应
氯喹和羟氯喹具有良好的安全性,并且由于它们并未完全抑制免疫途径,如Toll样受体(Toll-like receptor,TLR)7和TLR9信号通路、T细胞受体通路和B细胞受体通路,因此被认为是免疫调节剂,而非免疫抑制剂。与免疫抑制剂甲氨蝶呤和来氟米特不同,氯喹和羟氯喹不会增加感染并发症或癌症的风险[29]。
氯喹和羟氯喹最常见的不良反应是胃肠道反应,包括恶心、呕吐、腹泻和腹部不适[30]。此外,有研究报道,可能发生羟氯喹相关心肌病和羟氯喹介导或氯喹介导的心脏毒性,包括心律紊乱(如延长QT间期)和风湿病患者的心肌病[31]。但是,药物相关心脏毒性有待进一步确认。肾功能受损影响药物清除,可以提高药物的体内浓度,增加不良反应的风险。
氯喹和羟氯喹最严重的不良反应是视网膜病变。这些药物会导致视网膜损伤,主要通过干扰光感受器视网膜色素上皮细胞的溶酶体降解功能。这种干扰导致了视网膜色素上皮细胞脂褐素的增加,引起光感受器退化。氯喹的视网膜病变不良反应比羟氯喹较常见。但值得注意的是,由于过去几年诊断技术的进步,已认识到羟氯喹相关视网膜病变的发生比以往所了解的多,从而对皇家眼科学会(the Royal College of Ophthalmology,RCO)指南进行了相应更新[32]。在用羟氯喹治疗期间,多种因素被认为会增加视网膜病变的风险:药物剂量>5 mg·kg-1,长期使用该药物(10~25年),高蓄积剂量(600~1000 g,为连续使用77~141个月的累计剂量),3期~5期慢性肾病,以及与他莫昔芬联合使用>6个月[33]。羟氯喹视网膜病变最重要的诱因是高剂量长期(5年)使用造成的,但目前的证据仅限于回顾性研究,其中大多数是基于医疗记录,并缺少详实的数据佐证[33]。所以,药物剂量、治疗持续时间与视网膜病变不良反应的确切关系有待阐明。
5 关于剂量的注意事项
根据RCO指南,可以通过调整药物剂量和使用先进的光学干预方法减少氯喹或羟氯喹治疗期间发生眼部不良反应[33]。然而,由于氯喹和羟氯喹具有非常复杂的药动学特征,其量效关系仍不明确。氯喹和羟氯喹均有一个缓慢的起效过程,可能需要几周的时间才能达到最大活性[34]。它们在停药后仍会持续作用,即后遗效应。因此,必须重点关注给药剂量和给药时间。
根据美国眼科学会(American Academy of Ophthalmology,AAO)、RCO 和 EULAR 的最新指南,建议使用较低剂量的羟氯喹(按实际体质量每天≤5 mg·kg-1)[35]。但需要注意的是,研究得出的这个剂量代表实际羟氯喹摄入量,而不是处方剂量。因此,实际的处方剂量大概是≥6 mg·kg-1[36]。
在癌症治疗中,羟氯喹的处方剂量可达到每天1200 mg。尽管剂量如此之高,但是并未产生相关的毒性作用。除此之外,即使羟氯喹与其他具有眼毒性的药物联合使用也是如此[37]。然而,肿瘤的治疗期一般比风湿病短得多,因此癌症患者的累积剂量通常低于风湿病患者。在慢性肾病患者中,尽管由于他们的药物清除较低,进而会引起羟氯喹的浓度增加(并且可能具有部分毒性),但目前的指南中并未包含减少慢性肾疾病患者的羟氯喹使用剂量[38],需要今后临床研究阐明。
现行眼科指南最近修订的最大剂量(每天5 mg·kg-1摄入量)对炎症性风湿病患者的疗效尚未评估。遵循这种剂量策略可能是经过多方面考虑的。过去许多有关羟氯喹疗效的研究中应用的剂量至少是每天6.5 mg·kg-1。因此,疾病发作期间的有效治疗剂量可能高于推荐的最大剂量。此外,不同疾病使用的剂量也是不同的。
6 在COVID-19治疗中的应用
6.1 临床研究
为了快速寻找有效安全的COVID-19治疗方法,“老药新用”是目前情况下较好的策略,其中之一就是测试具有抗病毒活性的药物是否能有效治疗COVID-19。新型冠状病毒(SARS-CoV-2)属于β冠状病毒属,SARS-CoV和中东呼吸综合征冠状病毒(Middle East respiratory syndrome coronavirus,MERS-CoV)[39]也属于β冠状病毒属。前期研究显示,氯喹为潜在的广谱抗病毒药物,对狂犬病毒[40]、脊髓灰质炎病毒[41]、艾滋病毒[42]、甲型肝炎病毒[43]、丙型肝炎病毒[44]、甲型和乙型流感病毒[45]、甲型H5N1 流感病毒[46]、基孔肯雅病毒[47]、登革热病毒[48]、寨卡病毒[49]、埃博拉病毒[50]以及各种DNA病毒如乙肝病毒[51]和单纯疱疹病毒[52]等均有效果。在病毒感染患者的治疗过程中,有时已经证实了体外描述的氯喹的抗病毒活性,但因治疗疾病所用氯喹的浓度和治疗的持续时间不同,在临床试验中并不总是能够再现氯喹的抗病毒活性。由此说明,需要测试不同治疗方案并得到临床验证有效后才能推广应用。
关于冠状病毒,氯喹对SARS-CoV-1复制具有潜在的抑制作用[53]。也有报道显示,氯喹在体外可以抑制肺上皮细胞中的HCoV-229E的复制[54]。体外实验还显示,氯喹对HCoV-O43冠状病毒也有很强的抗病毒作用[55]。据报道,氯喹在体外对MERSCoV亦具有活性,但该结果仍有争议[56]。由于氯喹抗病毒的作用范围广,包括大多数冠状病毒,特别是与SARS-CoV-2相似的SARS-CoV-1也有效[57],因此,氯喹作为“老药新用”的备选药物,进入抗SARS-CoV-2的研究中。最近我国某实验室报道,氯喹和抗病毒药物瑞德西韦在体外均能抑制SARS-CoV-2,并建议在COVID-19患者中评估这些药物[3]。取得初步疗效后,在2020年2月19日我国发布的《新型冠状病毒肺炎诊疗方案(试行第六版)》中列入了氯喹治疗方案,建议“磷酸氯喹(成人500 mg,每日2次)”。并随后在第七版方案中更新使用方法为“体重在50公斤以上的18~65岁成年人每天2次500 mg磷酸氯喹,服药7天;体重在50公斤以下的成年人,第1~2天每天2次500 mg磷酸氯喹,第3~7天每天1次500 mg磷酸氯喹”。羟氯喹是氯喹的同类药,羟氯喹在体外已被证实具有抗SARS冠状病毒的活性[8]。继中国磷酸氯喹治疗方案,法国医生治疗SARS-CoV-2感染患者选用了硫酸羟氯喹单药治疗,或硫酸羟氯喹与阿奇霉素联合治疗。结果显示,硫酸羟氯喹单用有效,合用更有效[9]。但该报道目前争议很大,质疑原因如下:首先,这是一个小样本临床治疗观察;其次,它是开放设计试验;第三,治疗组失联患者人数较多,使得试验组样本更小。发表该文章的期刊的上级机构——国际抗微生物生物化学协会(ISAC)最近也在官网上发表声明,指出该项开放标签、非随机临床试验结果没有达到业界共识标准[58]。目前,我国正在开展氯喹和羟氯喹大约22项注册临床试验(表2)[59],结果有待揭晓。荷兰和意大利等国家也都出台了相应的方案,虽然他们的治疗剂量或多或少会有所调整,但是目前为止也均主要以氯喹和羟氯喹为治疗手段[59]。最近,在美国COVID-19患者人数和死亡人数不断增加的严峻形势下,美国FDA于2020年3月29日发布紧急授权,允许羟氯喹用于治疗COVID-19。美国卫生与公众服务部(United States Department of Health and Human Services,HHS)同时发表声明表示:当临床试验不可用或不可行时,FDA向生物医学高级研究与发展管理局(Biomedical Advanced Research and Develop⁃ment Authority,BARDA)颁发了紧急使用授权,允许国家战略储备局(Strategic National Stockpile,SNS)所获捐的硫酸羟氯喹和磷酸氯喹产品,由医生酌情分发给因患COVID-19而住院的青少年和成人患者。尽管前面提到,短期给予氯喹或羟氯喹相对比较安全,但仍然应关注视网膜病变以及对心脏的潜在不良反应。
6.2 药理作用潜在机制
氯喹能够抑制唾液酸的生物合成[60]。唾液酸是存在于细胞跨膜蛋白上糖链末端的酸性单糖,并且是病毒识别的关键成分。氯喹对唾液酸生物合成的干扰可能解释了该药广泛的抗病毒作用,诸如HCoV-O43 和 SARS-CoV-1[61-62]。虽然还未见SARS-CoV-2与唾液酸结合的报道,但如SARSCoV-2与其他冠状病毒一样,均是以某些细胞亚型的唾液酸为靶标,那么SARS-CoV-2与唾液酸的结合也可能受到氯喹的影响。
氯喹还可通过升高pH值干扰内体(endo⁃some)依赖的病毒的早期复制,如登革热病毒或基孔肯雅病毒[47]。某些病毒颗粒在与酸性的溶酶体或内体结合后,由于它们内部均是酸性环境,并且内部均具有一些可以破坏病毒颗粒的酶,在低pH值和某些酶的共同作用下,导致病毒脱颗粒并将基因组释放到细胞质中,如SARS-CoV-1[63]。而氯喹恰好凭借其本身化合物的弱碱性,并且能够进入到溶酶体或内体酸性环境中,从而阻断了病毒这一过程。也有报道显示,SARS-CoV-2可以酸化溶酶体,而氯喹弱碱性可干扰这一过程,具体是通过抑制组织蛋白酶,而组织蛋白酶需要较低的pH值才能达到最佳活性[3]。能够进入溶酶体或内体这一性质,正好能够说明为何其他碱性药物无氯喹如此之功效。
氯喹也能干扰病毒相关蛋白的翻译后修饰过程。对于艾滋病毒来说,新合成的病毒颗粒并无感染性,只有在包膜糖蛋白糖基化后才具备感染性,而氯喹可以抑制这一过程[64]。氯喹还可以通过影响蛋白质水解过程来抑制登革热病毒的复制[65]。在单纯疱疹病毒模型中,氯喹抑制了疱疹病毒颗粒的出芽,从而降低了其传染性[66]。研究表明,在非人类SARS-CoV-2模型中,冠状病毒出芽的胞内位置是M蛋白决定的,而氯喹可以干扰M蛋白进而扰乱病毒出芽,从而对SARS-CoV-2的周期起到抑制作用[67]。由于 SARS-CoV-2与 SARS-CoV-1具有相同的细胞受体,即血管紧张素转换酶2(angiotensin converting enzyme 2,ACE2)受体[68-69],所以氯喹也很有可能干扰ACE2受体的糖基化,从而阻止SARS-CoV-2与靶细胞的结合。
除影响病毒成熟过程外,氯喹升高pH值的作用还会干扰树突状细胞对病毒的识别,该过程基于TLR依赖途径发生[70]。除此以外,氯喹对免疫系统的其他作用还包括增强CD8+T细胞的免疫反应[71]。氯喹和羟氯喹还可减少炎症因子的产生。如体外实验显示,它们可抑制单核细胞产生白细胞介素1、白细胞介素6、肿瘤坏死因子和干扰素γ。氯喹和羟氯喹的这些免疫调节作用以及抑制炎症因子作用可能对遏制病情加重起到治疗作用。
7 结语与展望
氯喹和羟氯喹作为传统抗疟疾药和抗风湿药,应用已约70年,其抗肿瘤活性和抗血栓活性等潜在临床用途也在认识和研究中。近年还发现这类药物具有广谱抗病毒活性,特别是对SARS-CoV感染有潜在防治作用,引起对通过“老药新用”策略寻找COVID-19治疗药物的关注。在离体实验证明其对SARS-CoV-2有效的条件下,开展临床试用取得初步疗效。在疫情严峻形势下,中国、美国和欧洲多国已在治疗COVID-19中试用氯喹和羟氯喹,同时多项临床试验正在积极推进中,结果有待揭晓。它们治疗COVID-19的药理作用机制,可能是干扰SARS-CoV-2与唾液酸结合、干扰内体依赖性的病毒早期复制、干扰病毒相关蛋白的翻译后修饰或免疫调节作用及其对炎症因子的干扰。事实上,虽然它们应用历史较久,但其分子机制研究还处于起步阶段。它们可抑制溶酶体活性、自噬通路和调节免疫受体信号通路是近年阐明的重要机制。药物直接作用的确切分子靶标正在探索中,有一项研究提出棕榈酰-蛋白硫酯酶1(palmitoyl-protein thioes⁃terase 1,PPT1)是氯喹及其衍生物在溶酶体内潜在的分子靶标[72]。PPT1是脂质修饰蛋白代谢过程中的一个酶,该分子靶标有待进一步功能确认。溶酶体内是否存在其他分子靶标也值得研究。
关于用药注意事项,氯喹和羟氯喹的药理特性无本质差别,药物吸收良好,安全性良好,轻度胃肠道反应常见,严重不良反应如视网膜病变与给药剂量大和疗程长有关。在COVID-19治疗方案中,给药疗程不长,但应用剂量较大,视网膜病变风险仍需观察。一旦发生,可调减药物剂量(或停药)和使用光学干预方法以减轻这一眼部不良反应[33]。它们表观分布容积大,半衰期长(约50 d),药物蓄积后遗效应值得关注,尤其肾功能衰竭患者用药,肾清除能力下降会加重药物蓄积,氯喹比羟氯喹更应值得注意。它们的潜在心脏毒性需要关注,尤其是COVID-19合并心血管疾病需要联合用药时,如合用洋地黄类、奎尼丁和胺碘酮、β受体阻断药美托洛尔等;此外,与抗肿瘤药他莫昔芬合用会增加眼毒性风险;与免疫抑制剂甲氨蝶呤和环孢素等合用时,也需注意药物相互作用。目前研究尚未发现孕妇用药的胎儿毒性,也未发现哺乳妇女用药对婴儿的不良反应,这为特殊人群安全性用药提供了参考。未来需要研究它们临床应用的量效关系,探索合适的治疗剂量,提升治疗获益,降低治疗风险。

