线粒体通路在大戟大枣汤对乳腺癌MCF-7细胞增殖抑制及凋亡诱导中的调控作用
马立威,陈 哲,陈晓婷,倪世宇,贾永明,樊 丽,刘吉成
(齐齐哈尔医学院1.医药科学研究院,2.公共卫生学院,4.药学院,黑龙江 齐齐哈尔 161006;3.齐齐哈尔医学院附属第五医院,黑龙江 大庆 163001)
乳腺癌是女性最常见的恶性肿瘤之一。流行病学调查显示,乳腺癌呈逐年增长趋势,占女性恶性肿瘤发病率之首,严重威胁到女性的健康与生命[1-3]。数据显示,全球癌症发病率中乳腺癌发病率以11.6%位居第二,同时以6.6%的死亡率位居癌症死亡率第五[4]。目前,对于乳腺癌的治疗主要包括放化疗和手术治疗,并不十分满意的疗效让研究者着眼于开发更好的方式手段治疗乳腺癌[5-6]。
中药多途径、多靶点的抗癌特点逐渐得到认可。我们前期研究发现,中药狼毒大戟(Euphorbia fischerianaSteud.)及从中提取的单体成分具有较好的抗肿瘤尤其是抗乳腺肿瘤活性,但也有一定的副作用[7-13]。水煎剂是中药最常用的服药形式,对于中医药的传承发展,经典名方是重要突破口,以中药经典方剂为对象的研究具有非常重要的意义[14]。因此,依据张仲景的经典名方“十枣汤”的成方原理,本研究将大戟类药材狼毒大戟配伍大枣来缓和其峻下逐水、胃肠不适等毒副作用。另外,中药抗肿瘤研究中,传统的中药药理学方法是将中药或者中药的复方粗制剂直接加入离体反应体系中进行,但由于缺乏复方的体内代谢物或机体反应物等实际有效成分,致使机体非吸收物质体外直接作用而造成假阳性;另外,粗提物本身对离体反应也可能会有干扰,从而影响实验结果的准确性。中药血清药理实验是指将中药或其复方ig给予动物一定时间后,采集动物血液、分离血清,用此含有药物成分的血清进行体外实验[15],可在一定程度上避免中药复方制剂及其粗提物用体外实验评价药物体内效应的不客观性和不确切性。本研究从狼毒大戟与大枣配伍的水煎剂大戟大枣汤(decoc⁃tion ofE.fischerianaSteud.andZiziphus jujubaMil.,DEFSJ)着手,将其制备成含药血清(DEFSJ-containing serum,DEFSJ-CS),通过体外细胞实验探讨其抗乳腺肿瘤的作用及其可能的作用机制,以期为乳腺癌的临床治疗提供新的线索。
1 材料与方法
1.1 药物、试剂和主要仪器
狼毒大戟全株采于黑龙江省泰康县,经齐齐哈尔医学院天然药物化学实验中心郭丽娜教授鉴定,确定为大戟科植物狼毒大戟,取其根部入药,备用;大枣(Z.jujubaMil.)为药材批发市场购买(狗头枣,陕西绿音产,批号:20160509-1)。
MEM培养基(美国Gibco公司);胎牛血清(美国Hyclone公司);小鼠抗人Bcl-2单抗(美国CST公司);兔抗人Bax单抗、兔抗人Bim单抗和羊抗小鼠IgG及羊抗兔IgG抗体(美国Abcam公司);紫杉醇(中国北京双鹭药业公司);DAPI(美国Thermo公司);ActinGreen488(美国GeneCopoeia公司);甲基纤维素(美国Sigma公司);线粒体膜电位检测试剂盒和活性氧(reactive oxygen species,ROS)试剂盒(中国碧云天生物公司,产品编号分别为:C2006和S0033);逆转录PCR试剂盒(日本TaKaRa公司,LOT#:AA5302-1)。
3111型细胞培养箱(美国Thermo公司),IX51型倒置显微镜(日本Olympus公司),R-300型旋转蒸发(瑞士Buchi公司),LSM710型激光共聚焦显微镜(德国Zeiss公司),FACSCalibu型流式细胞仪(美国BD公司),S1000型梯度PCR仪和Chemi⁃Doc MP型全自动荧光及化学发光系统(美国Bio-Rad公司),BioSpec-nano型微量紫外分光光度计(日本岛津公司)。
1.2 DEFSJ制备
狼毒大戟与大枣按质量比1∶1混合(狼毒大戟根1 kg,大枣1 kg),加水10 L,浸泡30 min,煎煮2次,每次2 h,过滤后旋转蒸发浓缩至2 L,备用。并采用高效液相色谱法(HPLC)对DEFSJ进行质量控制分析,结果显示主要成分稳定,重复性好(图1)。
1.3 动物和DEFSJ-CS的制备
20只SPF级SD雄性大鼠,体质量300~400 g,按照SPF级动物饲养规范饲养(哈尔滨医科大学实验动物医学部),许可证号:SCXK(黑)2013-001,饲养于齐齐哈尔医学院实验动物中心,许可证号:SYXK(黑)2016-001,适应性喂养3 d后,进行实验。实验和饲养及其他处理过程中产生的废弃物及处死的大鼠均统一装入指定袋中,按规定进行处理。实验动物处置符合医学伦理学标准。
SD大鼠随机分成4组,每组5只。溶剂对照组大鼠ig给予生理盐水4 mL;DEFSJ 2.5,5.0和10.0 g·kg-1组每日早、晚各ig给药1次,共给药3 d。末次给药1 h后,水合氯醛麻醉,无菌条件下腹主动脉采血,离心分离(800×g,10 min)血清,获得DEFSJ-CS,-80℃冰箱中冻存。使用前56℃水浴灭活30 min;0.22 μm滤器除菌。
1.4 细胞和分组处理
乳腺癌MCF-7细胞(中国科学院上海生命科学研究院细胞资源中心),本研究室液氮中保存。
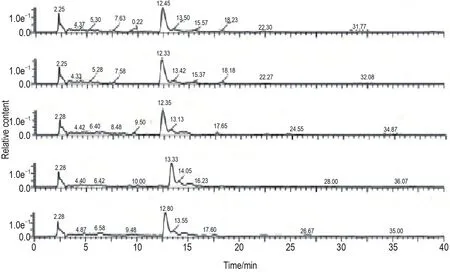
Fig.1 HPLC analysis of decoction of E.fischeriana Steud.and Z.jujuba Mil.(DEFSJ).HPLC method was used to analyze the chemical profile of DEFSJ.The comparison of 5 different times DEFSJ.
MCF-7细胞复苏后,用MEM完全培养基(含10%胎牛血清,1%青、链霉素混合液)常规培养,2~3 d传代1次。细胞分为细胞对照组(10%胎牛血清)、溶剂对照组(90% MEM培养基)、DEFSJ-CS 2.5,5.0 和10.0 g·kg-1和紫杉醇 8 mg·L-1(阳性对照)组。
1.5 甲基纤维素克隆形成实验检测克隆形成
参照文献[16]方法,取对数生长期MCF-7细胞1×106L-1接种到12孔细胞培养板中,每孔1.0 mL,待贴壁稳定后按1.4分组处理细胞,12 h后将预先配置好的甲纤维素培养体系(含甲纤维素浓度为1.2%和血清浓度为20%的MEM培养基)加入到各孔中,每孔1 mL,每组3个平行孔,置细胞培养箱中孵育7 d,计算各组细胞集落数;其中,以细胞数≥40的细胞团作为1个集落,计算克隆形成率。克隆形成率(%)=各组的集落数(均值)/细胞接种数×100%。
1.6 JC-1染色法检测细胞线粒体膜电位
取对数生长期细胞计数后,调整细胞密度约5.0×108L-1,接种到激光共聚焦显微镜专用的6孔细胞培养板(黑壁底透)中,待细胞贴壁稳定后,按1.4分组处理细胞;每孔对应加2.0 mL含药血清的培养基,置细胞培养箱中继续孵育48 h;同时按试剂盒说明书,设阳性参比孔,孔内加正常培养的MCF-7细胞。孵育结束后取出培养板,终止作用。每孔中加JC-1工作液1 mL,混匀后培养箱内孵育20 min;后用预先配制好的JC-1染色缓冲液洗涤2次,共聚焦显微镜下观察并记录接受不同处理的MCF-7细胞的形态及荧光强度(fluorescence intensity,FI)变化,拍照时将激光强度调成一致,最后以绿/红FI比值表示膜电位去极化水平。
1.7 流式细胞仪检测细胞内ROS含量
MCF-7细胞以5.0×108L-1密度接种到6孔细胞培养板中,每孔2.0 mL,待细胞贴壁稳定后,按1.4分组处理细胞;每孔对应加2.0 mL含药血清的培养基,置细胞培养箱中继续孵育48 h后弃上清终止作用;按试剂盒说明书,每孔加入0.5 mL无血清培养基稀释的探针(DCFH-DA),放入细胞培养箱中继续孵育30 min后收集细胞于流式管中。流式细胞仪上检测并分析各组细胞中ROS含量变化,以样品细胞的平均荧光强度(mean fluorescence intensity,MFI)值表示细胞中ROS含量。
1.8 RT-PCR法检测Bcl-2,Bax和Bim mRNA表达
MCF-7细胞以5.0×108L-1密度接种到培养皿(35 mm)中,每孔2.0 mL,待细胞贴壁稳定后按照1.4分组处理细胞;每皿对应加1.0 mL含药血清培养基后培养箱中孵育48 h弃上清终止作用。Trizol法提取各组细胞的总RNA,紫外分光光度计检测RNA浓度及纯度。按试剂盒说明,逆转录合成cDNA后进行PCR反应。β肌动蛋白(正向:5′-CTCCT⁃GAGCGCAAGTACTCC-3′,反向:5′-GTCACCTTCACCG TTCCAGT-3′,299 bp)作为内参基因;待测基因引物Bcl-2(正向:5′-ACAGGTGTAAGCCACCGAAC-3′,反 向 :5′-GTTGCAGTGAGC⁃CAAGATCA-3′,299 bp)、Bax(正向:5′-TGGT⁃GAAACCTTGTCTGCAC-3’,反向:5‘-CTTTGCCTTCTGGGTTCAAG-3′,297 bp)和Bim(正向:5′-TGCTGTCTCGATCCTCCAGTGG-3′,反向:5′-TCTCCAATACGCCGCAACTCTTG-3′,208 bp);将所得PCR产物于1.5%浓度的琼脂糖凝胶上电泳,成像系统下拍照并采集分析图像,对目的条带和内参条带的灰度(gray value,GV)值进行分析,以目的条带GV与内参条带GV比值表示目的基因相对表达水平。
1.9 免疫荧光法检测Bcl-2,Bax和Bim蛋白表达
MCF-7细胞以1.0×108L-1密度接种到共聚焦显微镜专用的48孔细胞培养板(黑壁底透),每孔2.0 mL,待细胞贴壁稳定后,按1.4分组处理细胞;每孔里对应加0.2 mL含药血清的培养基,置培养箱中继续孵育48 h后终止作用。进行免疫荧光检测:将培养板中的细胞经固定液固定,通透液通透后;用事先配置好的封闭液(含1% BSA的PBS)在37℃封闭30 min;加一抗(Bcl-2,1∶1000;Bim,1∶1500;Bax,1∶1500)4℃孵育过夜,次日将二抗(1∶2000)对应加入细胞板各孔中,室温、避光、孵育60 min;并按DAPI及ActinGreen488试剂说明书对细胞核及细胞骨架染色;激光共聚焦显微镜下观察并记录接受不同处理的MCF-7细胞的形态和FI变化,以FI值表示蛋白的相对表达水平。
1.10 统计学分析
实验结果数据用±s表示,应用SPSS17.0软件处理,根据方差齐性检验结果,多组间比较采用单因素方差分析,组间比较应用Dunnettt方法,以P<0.05表示差异有统计学意义。
2 结果
2.1 DEFSJ-CS对乳腺癌MCF-7细胞克隆形成率的影响
由表1显示,与细胞对照组相比,溶剂对照组MCF-7细胞克隆形成率无统计学差异;与溶剂对照组比较,DEFSJ-CS 2.5,5.0和10.0 g·kg-1组及紫杉醇8 mg·L-1组克隆形成率均明显降低(P<0.05,P<0.01)。
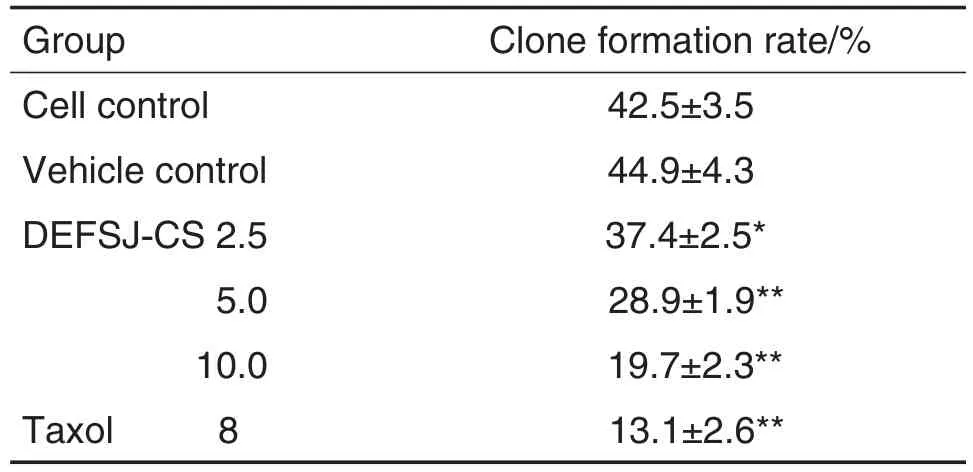
Tab.1 Effect of decoction of E.fischeriana Steud.and Z.jujuba Mil.containing serum(DEFSJ-CS)on clone formation in MCF-7 cells
2.2 DEFSJ-CS对乳腺癌MCF-7细胞线粒体膜电位的影响
如图2显示,溶剂对照组MCF-7细胞,由于存在较少的凋亡细胞,细胞的膜电位较高,细胞呈现较强的红色荧光,而绿色荧光较弱;DEFSJ-CS 2.5,5.0和10.0 g·kg-1及紫杉醇8 mg·L-1组MCF-7细胞,绿色荧光的细胞比例逐渐增多,说明线粒体膜电位去极化程度增加;镜下可见明显细胞凋亡形态变化:细胞贴壁程度下降,形状向椭圆形变化,细胞数量也有所减少。阳性参比孔细胞绿色荧光强度较强,但细胞形态变化不大。
2.3 DEFSJ-CS对乳腺癌MCF-7细胞ROS含量的影响
如表2所示,与溶剂对照组相比,DEFSJ-CS 2.5,5.0和10.0 g·kg-1组及紫杉醇8 mg·L-1组细胞内ROS含量随着DEFSJ-CS浓度增大逐渐增加(P<0.01)。
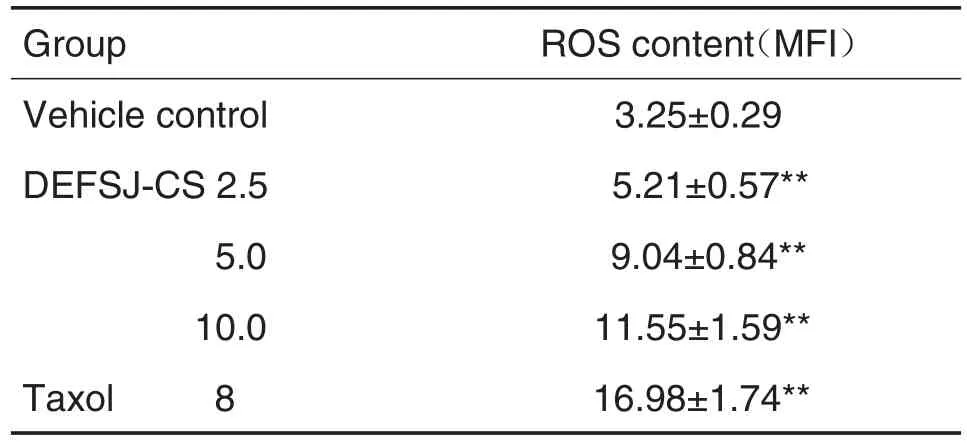
Tab.2 Effect of DEFSJ-CS on intracellular reactive oxygen species(ROS)content in MCF-7 cells
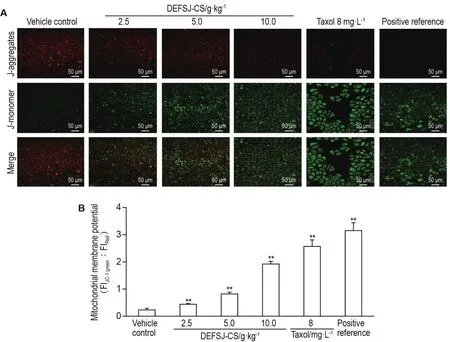
Fig.2 Effect of DEFSJ-CS on depolarization of mitochondrial membrane potential in MCF-7 cells.See Tab.1 for the cell treatment.B was the semi-quantitative result of A.±s,n=3.**P<0.01,compared with vehicle control group.
2.4 DEFSJ-CS对乳腺癌MCF-7细胞Bcl-2,Bax和Bim mRNA表达的影响
如图3所示,与溶剂对照组比较,DEFSJ-CS 2.5,5.0 和 10.0 g·kg-1组及紫杉醇 8 mg·L-1组MCF-7细胞Bax和BimmRNA相对表达水平逐渐增加,Bcl-2mRNA相对表达水平逐渐降低(P<0.05,P<0.01)。
2.5 DEFSJ-CS对乳腺癌MCF-7细胞Bcl-2,Bax和Bim蛋白表达的影响
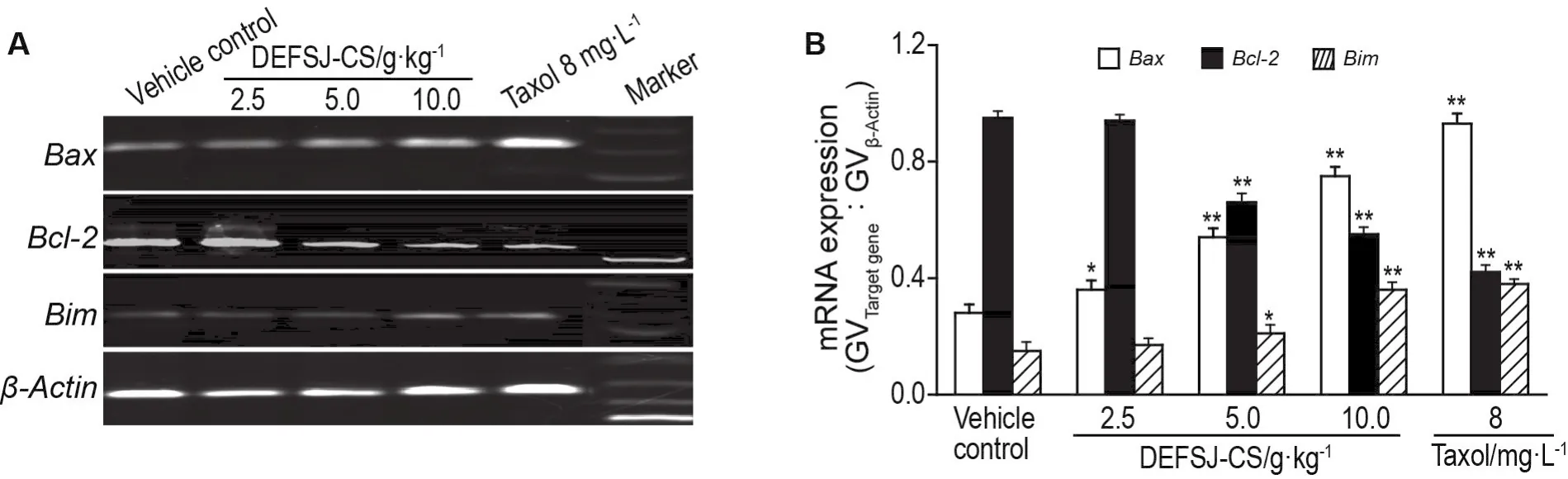
Fig.3 Effect of DEFSJ-CS on mRNA expressions of Bcl-2,Bax and Bim in MCF-7 cells.See Tab.1 for the cell treat⁃ment.B was the quantitive result of A.GV:gray value.±s,n=3.*P<0.05,**P<0.01,compared with vehicle control group.
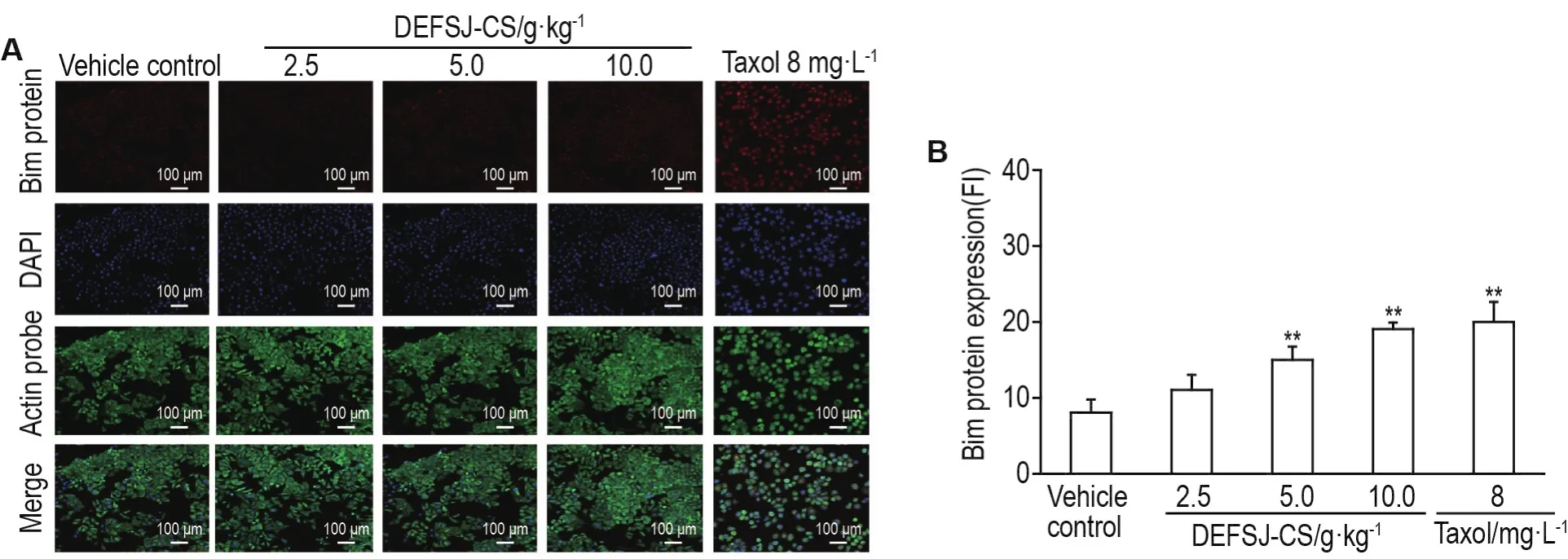
Fig.4 Effect of DEFSJ-CS on protein expressions of Bim in MCF-7 cells.See Tab.1 for the cell treatment.B was the semi-quan⁃titative result of A.±s,n=3.*P<0.05,**P<0.01,compared with vehicle control group.
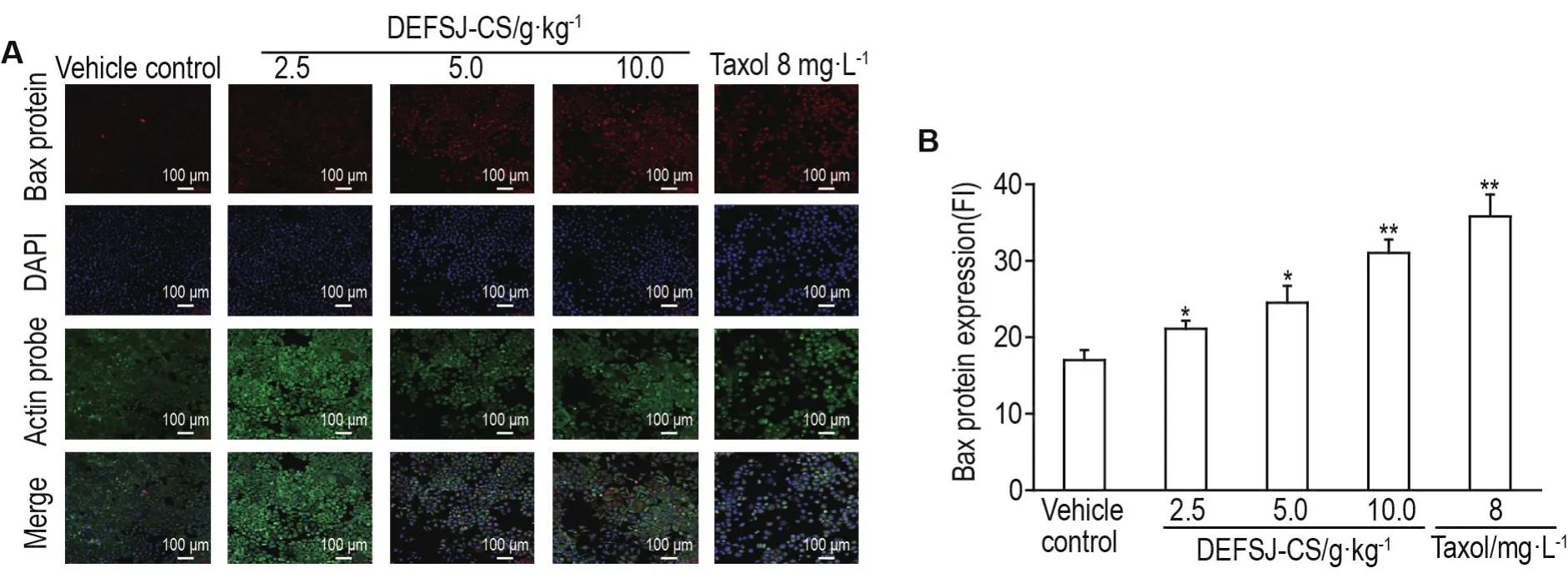
Fig.5 Effect of DEFSJ-CS on protein expressions of Bax in MCF-7 cells.See Tab.1 for the cell treatment.B was the semi-quan⁃titative result of A.±s,n=3.*P<0.05,**P<0.01,compared with vehicle control group.
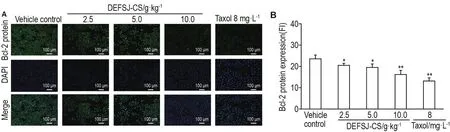
Fig.6 Effect of DEFSJ-CS on protein expression of Bcl-2 in MCF-7 cells.See Tab.1 for the cell treatment.B was the semiquantitative result of A.±s,n=3.*P<0.05,**P<0.01,compared with vehicle control group.
如图4~6所示,与溶剂对照组比较,DEFSJCS 2.5,5.0和10.0 g·kg-1组及紫杉醇8 mg·L-1组MCF-7细胞Bim和Bax蛋白的荧光强度逐渐增加,Bcl-2蛋白的荧光强度逐渐降低(P<0.05,P<0.01)。DEFSJ-CS 2.5,5.0和10.0 g·kg-1及紫杉醇8 mg·L-1组,随着DEFSJ-CS浓度的增加MCF-7细胞被DAPI染色均逐渐增强,细胞形态也出现了皱缩,细胞密度有所降低,并出现少量细胞碎片等典型的细胞凋亡的形态特征。
3 讨论
本研究发现,DEFSJ-CS 2.5 g·kg-1浓度既可影响人乳腺癌MCF-7细胞的克隆形成。文献报道,甲纤维素克隆形成实验,可模拟细胞在人体内的情况,反映细胞恶性程度的同时,也能反映细胞增殖速度的快慢[17]。这可初步证明,DEFSJ-CS可抑制MCF-7细胞增殖,其对细胞增殖的抑制作用,可能是通过诱导细胞凋亡来实现的。
本研究通过流式细胞仪检测发现,DEFSJ-CS可下调MCF-7细胞的线粒体膜电位,增加细胞内ROS含量,提示DEFSJ-CS能诱导MCF-7细胞凋亡。结合RT-PCR和免疫荧光法检测发现,DEFSJCS能有效降低MCF-7细胞Bcl-2基因和蛋白的表达,增加Bax和Bim基因和蛋白的表达。对于肿瘤细胞的凋亡,线粒体膜电位的降低是肿瘤细胞早期凋亡的特征之一。同时也有研究报道,线粒体是细胞凋亡的控制中心,也是细胞内ROS的主要来源[18-19]。ROS与细胞凋亡存在着十分密切的关系[20]。ROS的过量产生引起重要的细胞分子和结构(如脂质、蛋白质和DNA)氧化损伤,致使线粒体功能障碍,激活内源性凋亡通路,最终导致细胞凋亡[21]。而研究报道,对于受基因调控的细胞凋亡,目前研究比较透彻的2条细胞凋亡传导途径分别为细胞外途径即细胞表面死亡受体途径和细胞内途径即线粒体途径;其中由Bcl-2家族调节的线粒体凋亡途径发挥重要作用[22]。Bcl-2家族相关因子(促凋亡因子Bax,Bim和Bak等,抗凋亡因子Bcl-2和Bcl-xl等)在细胞凋亡线粒体途径中起着关键作用[23-24]。线粒体凋亡信号通路的激活又与线粒体膜电位的变化密不可分,而线粒体膜电位的变化受到Bcl-2家族蛋白的调控[25]。如Bax增加线粒体膜通透性,导致线粒体膜电位降低,使细胞内ROS增加,激活胱天蛋白酶级联反应,引发细胞凋亡;Bcl-2则产生相反的效应[26]。
上述结果表明,线粒体凋亡途径参与了DEFSJCS诱导MCF-7细胞凋亡的调控。但是否还有其他调控机制的参与,有待后续深入研究。

