9种真菌中分支点结合蛋白的生物信息学分析
邱凯华,李晓驹,方淑梅,梁喜龙
(黑龙江八一农垦大学,黑龙江 大庆 163319)
由于真核生物的结构基因是外显子与内含子相互间隔但又连续镶嵌排列而成的断裂基因,其转录生成的mRNA 前体(pre-mRNA)并不能作为转录的模板,必须经过剪接加工,去除内含子,同时将外显子连接起来形成成熟的mRNA 才能发挥作用[1]。pre-mRNA 剪接是剪接体在组装过程中通过发动两次转酯反应催化完成的。剪接体是由5种核小RNA(U1snRNA、U2snRNA、U4snRNA、U5snRNA、U6snRNA)和多种蛋白质形成的5种核小核糖核蛋白(U1snRNP、U2snRNP、U4snRNP、U5snRNP、U6snRNP)及其他辅助蛋白质形成的超大分子复合体[2],其组装过程主要经历以下几个阶段:(1)U1snRNP 识别内含子的5′剪接位点,U2AF(U2snRNP auxiliary factor)与3′端的多聚嘧啶区(polypyrimidine tract,Py tract)结合,形成复合体E;(2)U2snRNP 与分支点序列(branchpoint sequence,BPS)结合,形成复合体A;(3)U4/U6snRNP 与U5snRNP 以复合物形式与复合体A 相互作用,生成复合体B1;(4)U1snRNP 离开剪接体,U6snRNP 识别5′剪接位点,U5snRNP 松散结合到内含子上,形成复合体B2;(5)复合体构象重排变成具有催化活性的复合体C。转酯反应起始于分支点的2′-OH 攻击内含子5′端的磷酸二酯键,上游外显子产生游离的3′-OH,其攻击内含子3′端的磷酸二酯键,与下游外显子连接起来,同时内含子形成套索结构释放[2-3]。剪接又可分为组成性剪接与选择性剪接(也称可变剪接)。选择性剪接在高等真核生物中普遍存在,通过从一个基因中以不同方式去除内含子而产生多种转录子,可进一步表达为不同生理功能的蛋白质,从而增加蛋白质的复杂性和多样性[4-5],也可能通过无义介导mRNA 降解(nonsense-mediated mRNA decay,NMD)机制被降解,从而调控转录子的水平[6-8]。剪接与无义介导都在基因表达调控中起着十分重要的作用。
剪接体的形成始于内含子识别,该过程仅需U1snRNP 和少量辅助蛋白质即可完成,分支点结合蛋白(branchpoint-bridging protein,BBP)就是其中重要的分子,在U2AF 大亚基的辅助下正确识别结合于BPS 上,在帮助拉近5′剪接位点与3′剪接位点的空间距离上起到桥梁作用,是剪接体组装之初必不可少的核心成员之一[9-12]。研究显示,BBP 及其同源蛋白在动物、植物、真菌中高度保守,推测其在所有形成剪接体的真核生物中存在[13]。
真菌活动与人类生活密切相关。真菌不仅参与工业发酵、食品添加剂和饲料添加剂生产、异生物质降解、纤维素向生物燃料转化等重要过程,有些真菌还会引起人类或动植物的疾病,为此对真菌的研究一直是生命科学领域的重要内容[14]。同时,真菌的基因组相对于其他高等真核生物更小、结构更加简化,并且部分真菌已经作为模式生物成为人类探索生命科学奥秘的重要工具[13]。因此,选择低复杂度的真菌为研究对象对于探究选择性剪接机理具有重要意义。
本研究对9种常见真菌——稻瘟病菌(Pyricularia oryzae)、酿酒酵母(Saccharomyces cerevisiae)、小麦全蚀病菌(Gaeumannomyces tritici)、粗糙脉孢菌(Neurospora crassa)、西瓜炭疽病菌(Colletotrichum orbiculare)、白僵菌(Beauveria bassiana)、尖孢镰刀菌(Fusarium oxysporum)、水稻恶苗病菌(Fusarium fujikuroi)和立枯丝核菌(Rhizoctonia solani)的BBP进行了生物信息学分析,旨在了解BBP 在这9种真菌中的基本特性及可能的生物学功能,以期为进一步研究BBP 在pre-mRNA 剪接中的作用及其他的生物学功能提供依据。
1 研究对象及分析方法
1.1 BBP 的基本信息获取
利用真菌在线网站(http://fungi.ensembl.org/Magnaporthe_oryzae/Info/Index),输入“branchpointbridging protein”检索获取稻瘟病菌中BBP 的氨基酸序列,然后通过NCBI 数据库(https://blast.ncbi.nlm.nih.gov/Blast.cgi)利用同源比对获取酿酒酵母、小麦全蚀病菌、粗糙脉孢菌、西瓜炭疽病菌、白僵菌、尖孢镰刀菌、水稻恶苗病菌、立枯丝核菌的BBP 氨基酸序列,同源比对参数默认。
1.2 BBP 的理化性质分析
利用ExPASy(http://web.expasy.org/protparam/)在线软件分析蛋白质分子量、等电点、亲水性和稳定性。
1.3 BBP 的亚细胞定位、信号肽与跨膜螺旋预测
利用DeepLoc-1.0(http://www.cbs.dtu.dk/services/DeepLoc/)在线软件对BBP 进行亚细胞定位;利用SignalIP 4.1(http://www.cbs.dtu.dk/services/SignalP/)在线软件进行信号肽预测;利用TMHMM Server v.2.0(http://www.cbs.dtu.dk/services/TMHMM/)和TMpred Server (https://embnet.vital -it.ch/software/TMPRED_form.html)在线软件进行跨膜螺旋预测。
1.4 BBP 的二级结构与结构域分析
利用NPS@(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_sopma.html)在线软件预测BBP 二级结构,参数默认;利用InterPro Scan(http://www.ebi.ac.uk/interpro/search/sequencesearch)在线软件预测BBP 结构域,利用Dog 2.0 软件进行结构域绘图。
1.5 BBP 的系统进化分析
多序列比对后,利用MEGA 7.0.26 软件中的Neighbor-Joining 法绘制系统进化树,参数默认,生成系统进化树。
1.6 BBP 的三级结构分析
利用ExPASy 中的Swiss Model(https://swissmodel.expasy.org/)在线软件进行蛋白质三级结构预测并获取信息。
1.7 BBP 的磷酸化与SUMO 化位点预测
利用DISPHOS 1.3(http://www.dabi.temple.edu/disphos/)在线软件预测BBP 的磷酸化位点;利用GPS-SUMO 1.0 软件预测BBP 的SUMO 化位点,各参数均设置为默认值。
2 结果与分析
2.1 BBP 的基本信息获取
首先通过真菌数据库获取稻瘟病菌BBP 的蛋白ID 及氨基酸序列,然后通过NCBI 进行同源比对,获取酿酒酵母、小麦全蚀病菌、粗糙脉孢菌、西瓜炭疽病菌、白僵菌、尖孢镰刀菌、水稻恶苗病菌、立枯丝核菌中BBP 的蛋白ID、蛋白长度、基因座位、覆盖度及E值(表1)。其中,稻瘟病菌BBP 的蛋白长度最大,氨基酸数目为638;酿酒酵母BBP 的蛋白长度最小,氨基酸数目为458。除稻瘟病菌外,白僵菌BBP 的覆盖度最高,为96%,E值为0;酿酒酵母BBP的覆盖度最低,立枯丝核菌次之,分别占比41%和67%,E值分别为1.00E-96 和4.00E-135。
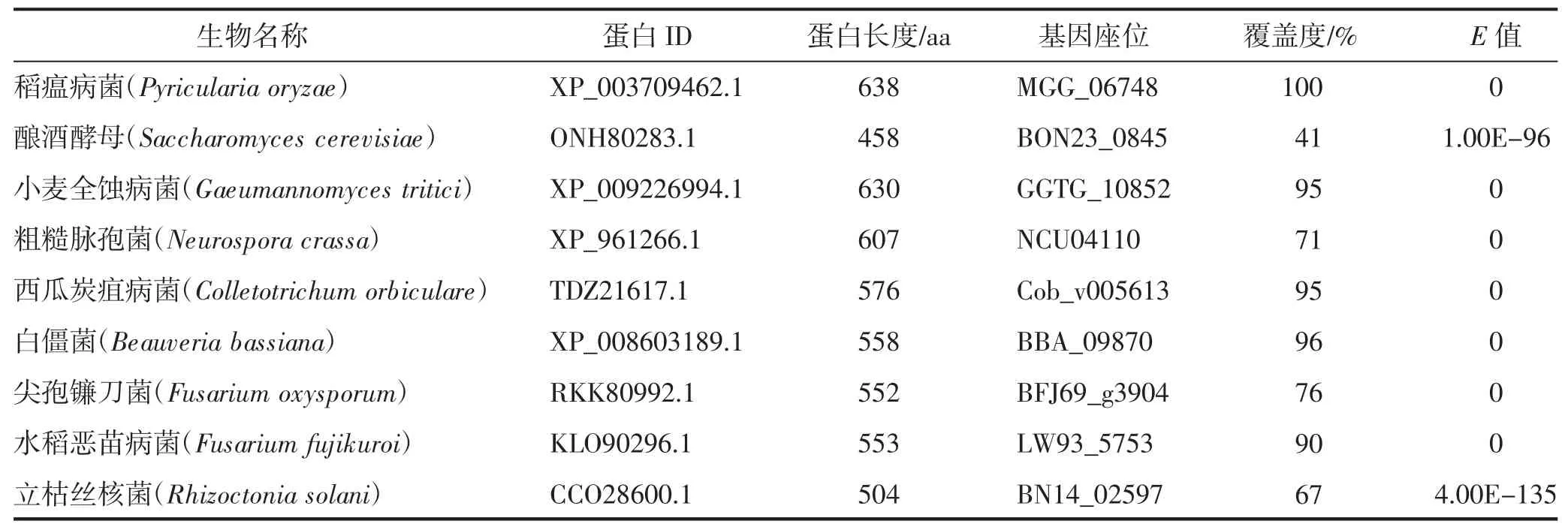
表1 9种真菌中BBP 的信息
2.2 BBP 的理化性质分析
利用ExPASy 在线软件分析蛋白质理化性质。由表2 可知,XP_003709462.1 分子量最大,XP_009226994.1 次之,ONH80283.1 分子量最小;所有蛋白呈碱性;ONH80283.1 等电点最高,为9.56;所有蛋白为不稳定的亲水蛋白。
2.3 BBP 的亚细胞定位、信号肽与跨膜螺旋结构预测
利用DeepLoc-1.0 在线软件进行亚细胞定位,结果显示,9种真菌的BBP 皆存在于细胞核中;利用SignalIP 4.1 在线软件进行信号肽预测,结果显示,9种真菌的BBP 均不存在信号肽;利用TMHMM Server v.2.0 和TMpred Server 两个在线软件对蛋白跨膜螺旋进行预测及分析,结果显示,9种真菌的BBP 跨膜区域为零,无跨膜蛋白,即所研究蛋白不属于膜蛋白或分泌蛋白。

表2 9种真菌中BBP 的理化性质
2.4 BBP 的二级结构与结构域分析
利用NPS@ 在线软件预测蛋白质的二级结构,结果见表3。由表3 可知,无规则卷曲占比最大,α 螺旋次之,β 折叠和β 转角占比较小。α 螺旋和β 折叠为蛋白质最主要的二级结构形式,其中,立枯丝核菌CCO28600.1 的α 螺旋占比最大,为23.41%;酿酒酵母ONH80283.1 占比最小,为15.33%,但是ONH80283.1 的β 折叠占比最高达9.05%,比β 折叠占比最小的小麦全蚀病菌XP_009226994.1 高5.08%。
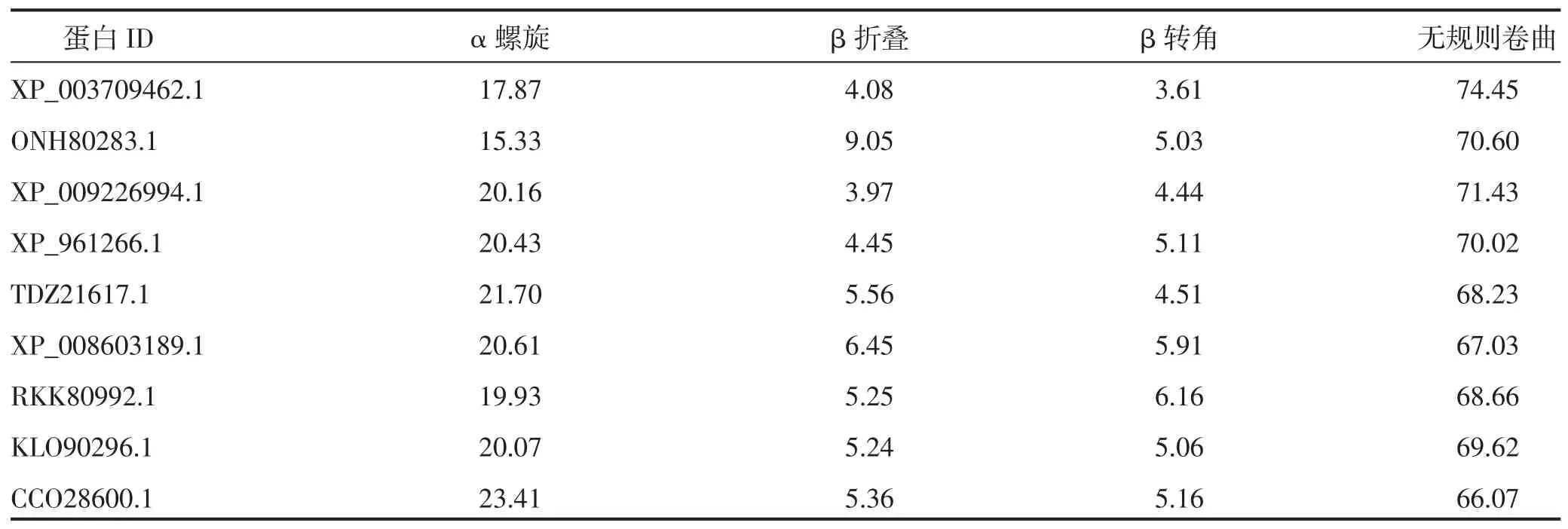
表3 9种真菌中BBP 的二级结构预测 单位:%
结构域是蛋白质构成三级结构的基本单元,具有一定的生物学功能。为了进一步明确BBP 的结构及功能,利用InterPro Scan 在线软件预测9种真菌中BBP 的结构域,然后利用Dog 2.0 软件进行结构域绘图。由图1 可知,本研究中的蛋白质均具有3 个相同的结构域(SF1-HH、KH_dom、Znf_CCHC),除酿酒酵母ONH80283.1 各结构域在肽链中的位置与其他蛋白差异较大外,其他各蛋白结构域分布相似。由此推测,ONH80283.1 在高级结构和生物学功能上可能会与其他8种真菌中的BBP 有所差异。
2.5 BBP 的系统进化分析
为了明确9种真菌中BBP 的进化关系,本研究利用MEGA 7.0.26 软件对这9种真菌的BBP 进行氨基酸序列多重比对分析并绘制系统进化树。由图2 可知,9种真菌BBP 的进化树分支置信度为55~100,数值较高,表明该进化树可信,其中,XP_003709462.1 和 XP_009226994.1、RKK80992.1和KLO90296.1 遗传距离相近,说明两两之间同源性较高,亲缘关系较近;ONH80283.1 与CCO28600.1分别独立构成一个分支,表明这二者与其他蛋白的同源性较低,亲缘关系较远,可能经历了不同的分子进化过程。
2.6 BBP 的三级结构分析
蛋白质功能与其高级结构密切相关,为了进一步明确9种真菌中BBP 的生物学功能,本研究利用ExPASy中的Swiss Model 在线软件对BBP 进行三级结构预测获取3D 结构图以及相关信息。由表4 可知,XP_008603189.1 和CCO28600.1 模板为4wan.1.A,其余7种真菌中BBP 模板均为4wal.1.A,其中,ONH80283.1与模板的一致性最高,达97.66%,建模质量评分最高为0.23,建模质量评分表示为0~1 之间的数字,数字越大可靠性越高,由此可知,该模型具有较高参考价值。由图3可知,XP_003709462.1、XP_009226994.1、XP_961266.1、TDZ21617.1、XP_008603189.1、RKK80992.1以及KLO90296.1 的3D 结构非常相似,推测BBP 在这7种真菌中高度结构保守,功能相似;ONH80283.1 分子量最小,结构相对较简单,而CCO28600.1 以四聚体形式存在,推测其可能以四聚体形式发挥功能,这与系统进化分析中ONH80283.1 与CCO28600.1 独立构成分支的结果具有一致性。
2.7 BBP 的磷酸化与SUMO 化位点预测
磷酸化和SUMO 化是蛋白质翻译后的重要修饰内容,在蛋白质发挥生物学功能上具有重要作用。本研究通过DISPHOS 1.3 在线软件与GPS-SUMO 1.0 软件分别预测了BBP 的磷酸化位点和SUMO 化位点。由表5 可知,RKK80992.1 与KLO90296.1 同为镰刀菌属,二者的Ser、Thr 和Tyr 3种氨基酸磷酸化位点占比极其相近;TDZ21617.1、XP_008603189.1、RKK80992.1 和KLO90296.1 具有1 个SUMO 化位点,XP_003709462.1、ONH80283.1、XP_009226994.1和XP_961266.1 均具有2 个SUMO 化位点或SUMO互作基序,而CCO28600.1 具有4 个SUMO 化位点或SUMO 互作基序。
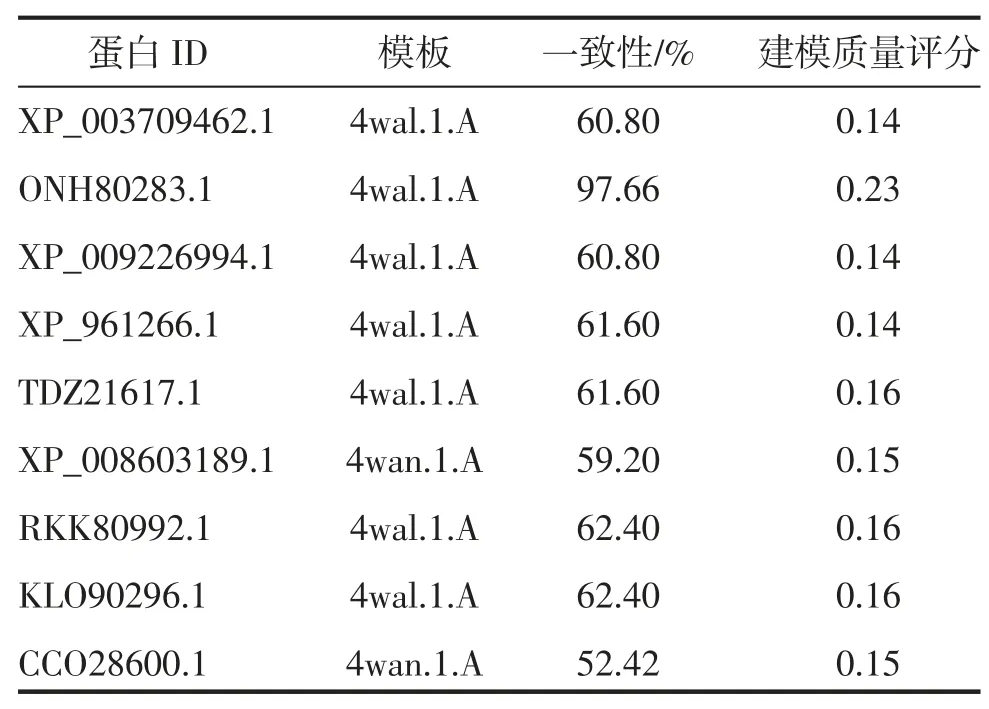
表4 9种真菌中BBP 蛋白质空间结构比对分析与质量评价
3 讨论与结论
基于剪接过程对于基因表达和蛋白质多样性的重要影响,剪接位点识别辅助因子的研究成为基因表达调控的重要内容之一。已有大量研究表明,BBP在人(Homo sapiens)[15]、小家鼠(Mus musculus)[16-17]、酿酒酵母(Saccharomyces cerevisiae)[18]、黑腹果蝇(Drosophila melanogaster) 和秀丽隐杆线虫(Caenorhabditis elegans)[19]细胞的可变剪接中起着至关重要的作用。近年来也有学者针对BBP 的分子功能在植物中展开研究,例如JANG 等[20]研究表明,在拟南芥中BBP 是部分pre-mRNA 选择性剪接过程必不可少的参与者,缺少BBP 会导致拟南芥发育异常;YIN 等[21]在桃的花色研究中表明,BBP 作为一种重要的蛋白质参与了pre-mRNA 的选择性剪接,这种选择性剪接导致红色桃花中花青素合酶(ANS)活性明显升高。在真菌中,对BBP 的功能研究主要围绕酿酒酵母展开,研究表明,BBP 除了在剪接过程中发挥必要功能,还参与pre-mRNA 的核滞留[22-23]。RODGERS 等[24]从酿酒酵母细胞裂解物中分离出BBP进行体外实验,发现只有一部分BBP 分子能与RNA 底物互相作用,从而推测BBP 可能具有新的调节功能,进一步验证了BBP 可能在选择性剪接之外发挥功能。然而在其他真菌中对BBP 的功能研究鲜有报道。
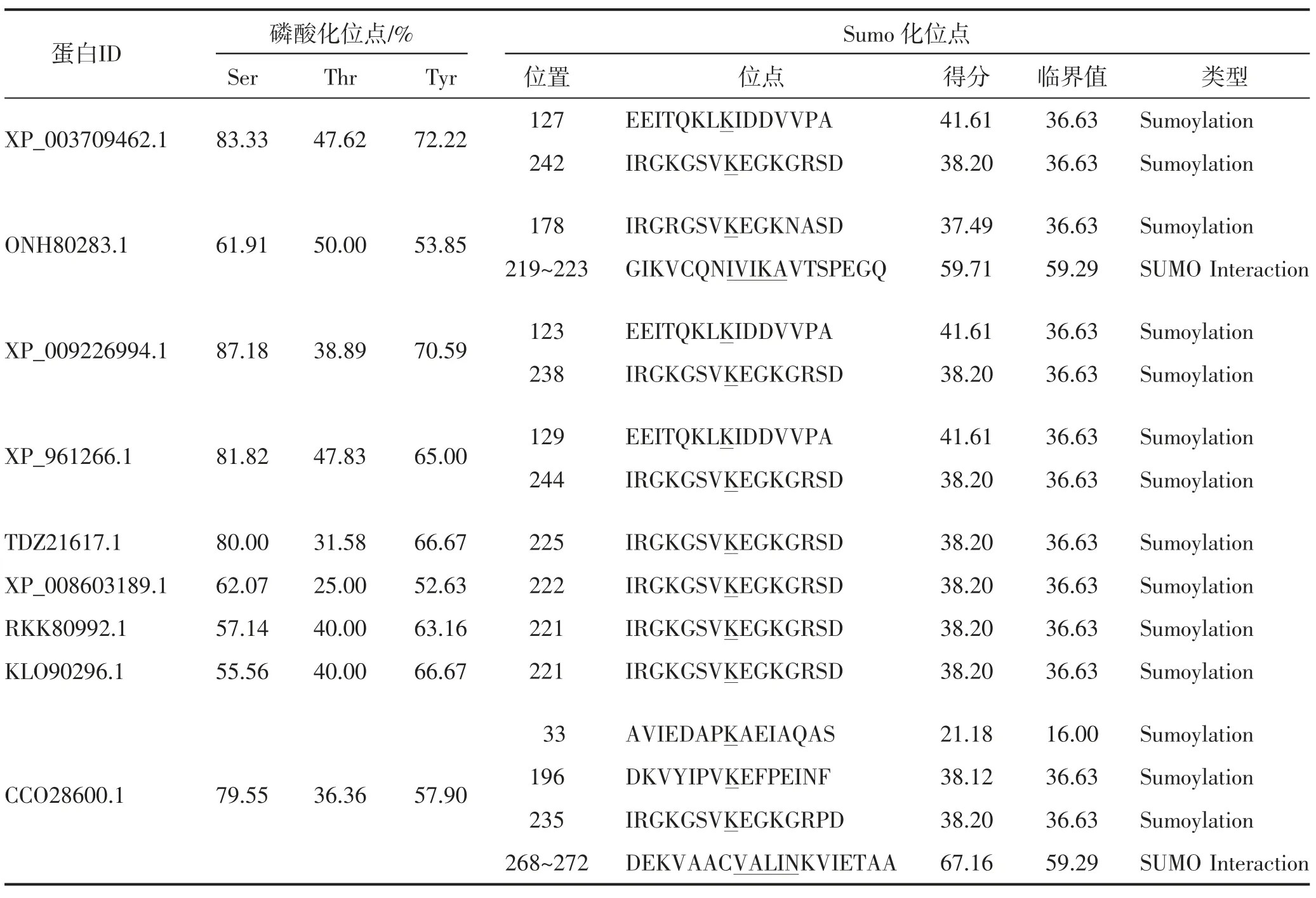
表5 9种真菌中BBP 的磷酸化位点与SUMO 化位点
本研究对包括酿酒酵母在内的9种常见真菌中的BBP 进行生物信息学分析,结果显示,与其他真菌BBP 二级结构相比,酿酒酵母ONH80283.1 的α螺旋占比最小,β 转角占比最高,且结构域整体靠近N 端,直接导致其三级结构与其他真菌形成明显差异。值得注意的是,立枯丝核菌CCO28600.1 的三级结构以四聚体的形式存在,且含有4 处SUMO 化位点。这些都与系统进化分析中,ONH80283.1 和CCO28600.1 各自独立构成分支相符。由此推测,酿酒酵母和立枯丝核菌中的BBP 发挥的功能并不完全相同或在发挥功能的方式上有所不同。此外,RKK80992.1 与KLO90296.1 同为镰刀菌属,这两种真菌中BBP 的理化性质极其相似,二级结构、结构域及三级结构差异极小,系统进化分析中其亲缘关系最近,且二者Ser、Thr、Tyr 3种氨基酸磷酸化位点占比相近,同有一处SUMO 化位点,由此可见,BBP在同属真菌中进化高度保守。

