盐酸西替利嗪片人体生物等效性试验
司鸽,郭建艳,张红贞,高娟,郑忠辉
(1.淄博职业学院,山东 淄博 255314;2.山东新华制药股份有限公司,山东 淄博 255035;3.山东药品食品职业学院基础教学部,山东 淄博 255011)
盐酸西替利嗪片为口服剂型的H1受体拮抗剂,为抗过敏类非处方药,适应证为季节性鼻炎、常年性过敏性鼻炎、过敏性结膜炎及过敏引起的瘙痒及荨麻疹的对症治疗。美国应变性鼻炎诊疗指南(2015)推荐西替利嗪为治疗变应性鼻炎及非变应性鼻炎的一线口服抗组胺药物[1-6]。鉴于盐酸西替利嗪片的临床作用,为增加临床医生和患者的用药选择,根据《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》(国办发〔2016〕8号)要求,本研究选用新华制药(高密)有限公司生产的盐酸西替利嗪片为受试者制剂,UCB Farchim SA(瑞士)原研盐酸西替利嗪片为参比制剂[7-8],开展人体生物等效性临床试验。
1 药品、试剂和仪器
盐酸西替利嗪片受试制剂[T,规格:10 mg /片,新华制药(高密)有限公司,批号:1703001];盐酸西替利嗪片参比制剂[R,规格:10 mg/片,UCB Farchim SA(瑞士),批号:170664]。对照品:盐酸西替利嗪[新华制药(高密)有限公司,批号:160611,纯度/含量:99.6%(按干燥品计)]。内标:盐酸氘代西替利嗪[(±)-Cetirizine-d4-Dihydrochloride),Toronto Research Chemicals,批号:24-GHZ-126-1,纯度/含量:98%]。甲醇、乙腈、甲酸,均为色谱纯,Merck公司生产;超纯水为自制品;其他试剂均为分析纯。
液相色谱串联质谱(LC-MS/MS)系统:UFLC20-AD超快速液相系统(岛津公司);AB Sciex Triple QuadTMAB SCIEX 5500串联四极杆质谱仪(美国应用生物系统公司);色谱柱:Luna 5 μm HPLC 200A 100×2 mm,批号:H16-099554、H16-327417;数据采集/管理软件为AnalystTM软件1.6.2版、Thermo Watson 7.5实验室信息管理系统。
2 试验方法
2.1 受试者 本试验经中国医科大学附属盛京医院医学伦理委员会批准,空腹和餐后共筛选128例受试者,年龄18~45岁,体重指数18.0~26.0 kg·(m2)-1,所有受试者均在充分了解本试验的目的、方法及风险后,自愿签署知情同意书,统一进行查体和实验室检测,经筛选合格并随机纳入空腹试验的受试者24例,餐后试验的受试者24例。
完成例数:空腹试验完成24例,无脱落/剔除;餐后试验完成22例,2名受试者因首个血药浓度值为Cmax,未纳入药代动力学参数集(PKPS)及生物等效性集(BES)。
2.2 试验设计[8-11]本试验采用随机、开放、单剂量、自身交叉设计,分空腹和餐后两个研究进行,各入组24例受试者,男女兼有。试验每周期给药1次,给药剂量为10 mg,健康受试者随机分为两组,每组人数相等,清洗期为5 d。
受试者于给药前一天入住研究中心,分配随机号,晚上统一进清淡饮食,然后禁食至少10 h。受试者于给药前1 h内于前臂放置静脉留置针。
空腹试验:受试者于试验当天上午空腹随机接受单剂量口服给药,240 mL水送服,给药后4 h内禁食,给药前后1 h内禁水。受试者分别于给药前1 h内(作为0 h)及用药后0.17、0.33、0.5、0.75、1、1.33、1.67、2、3、5、8、12、24、48 h采集血样4 mL,共计15个采血点。
餐后试验:受试者于试验当天上午给药前30 min时进食试验餐,30 min内用餐完毕,在开始进餐后30 min时准时接受单剂量口服给药,给药后4 h进食标准午餐。受试者分别于给药前1 h内(作为0 h)及用药后0.5、1、1.5、2、2.5、3、3.5、4、5、8、12、24、48 h采集血样4 mL,共计14个采血点。
样品采集与处理[11]:每次个采血点所有受试者血样于采集完毕后60 min内置低温离心机内,在2~8 ℃、1 500~2 000 ×g(2 500~3 000 r·min-1)下离心10 min,分离获得血浆分装为2管,其中1管为测试管,1份为备份管,2 h内放置低温冰箱(-20 ℃)中。所有样品采集并处理后放置临床研究单位低温冰箱(约-70 ℃)中暂存,直至样品转运。
所有测试样本分析完成后转移至低温冰箱(约-20 ℃)长期保存。
2.3 血浆样品的处理与测定 取样品,待其完全融化后,混匀约30 s,移取50 μL样品(空白样品和内标空白样品加50 μL的空白人血浆)至96孔板中,随后分别加10 μL的IS-W溶液[空白样品加入10 μL甲醇∶水(1∶1)],涡旋均匀,之后再加入0.5 mL乙腈,涡旋3 min,3 200×g、4 ℃条件下离心5 min,最后,取200 μL上清液至新的96孔板中,40 ℃氮气流吹干,吹干后加入200 μL复溶液,涡旋3 min,提交LC-MS/MS分析。
2.4 LC-MS/MS条件 色谱条件:Luna 5 μm HPLC 200A 100×2 mm色谱柱;流动相为乙腈:0.4%甲酸水溶液(氨水调节pH至3.2),95∶5等度洗脱;流速0.4 mL·min-1;柱温40 ℃;进样量2 μL;自动进样器温度4 ℃;运行时间3.0 min。
质谱条件:美国应用生物系统公司的API 5500三重四级杆质谱仪;离子化方式为(+)ESI;扫描模式为多反应监测模式;质谱参数:离子源喷雾电压(IS)5 000 V,气帘气(SUR)20 psi,离子源温度(TEM)500 ℃,入口电压(EP)10 V,碰撞气(CAD)6 unit,出口电压(CXP)15 V,停留时间(Dwell)100 ms,离子源气体1为50 psi,离子源气体2为50 psi,用于定量的离子反应分别为m/z 389.2→201.1(西替利嗪)和m/z 393.2→201.1(西替利嗪-d4)。
3 分析方法验证[12]
3.1 标准曲线和定量范围 配置质量浓度为50.0、100、250、1 250、2 500、12 500、22 500和25 000 ng·mL-1的标准曲线工作液,按“2.3”项下操作:以待测物浓度为横坐标,待测物与内标物的峰面积比为纵坐标,用加权最小二乘法(1/X2)进行回归运算,得直线回归方程为Y=0.024 5X+0.001 4,R2=0.998 8(见图1)。结果显示盐酸西替利嗪的线性范围为1.00~500 ng·mL-1,定量下限为1.00 ng·mL-1。

图1 人血浆中待测物的典型校正曲线
3.2 准确度和精密度 考察3个分析批次的质控(QC)样品,每批次各考察低(QCL)、中(QCM)、高(QCH)3个浓度水平的质控样品各6份,结果如表1显示批内及批间RE均在±15%之内且满足CV≤15%。

表1 准确度和精密度
3.3 选择性 分别考察6批基质的不含内标/含内标空白血浆样品,结果如表2显示批基质对分析物测定的干扰为0.00,均小于20%分析物定量下限,同时对内标测定的干扰为0.00,均小于5%内标峰面积均值。考察1份只含内标的混合血浆样品,对分析物测定的干扰为0.00,小于20%分析物定量下限。考察含定量上限的混合血浆样品,对内标测定的干扰为0.00,小于5%内标峰面积均值。

表2 选择性
3.4 提取回收率和基质效应 提取回收率考察低、中、高3个浓度质控样品,每个浓度6份样品,对比混合基质提取后添加的质控样品与相应质控纯溶液样品,结果如表3显示待测物3个浓度水平的质控样品平均回收率分别为81.24%、101.82%、93.90%,总体回收率为92.32%,总体变异%CV为11.27;内标3个浓度水平的质控样品平均回收率分别为87.95%、108.28%、97.70%,总体回收率为97.98%,总体变异%CV为10.41。

表3 基质效应
基质效应考察6批基质高、低2个浓度点的基质效应,对比提取后添加的质控样品与相应质控纯溶液样品,计算基质因子和内标归一化的基质因子,结果显示待测物基质效应因子、内标基质效应因子、内标归一化基质效应因子的%CV均小于15%。
3.5 稳定性 分别考察待测物及内标的储备液和工作溶液在室温条件下的短期稳定性及冷冻条件下长期稳定性,结果显示待测物室温放置22 h稳定,内标工作液室温放置19 h稳定,内标储备液室温放置17 h稳定;待测物储备液和内标工作液在低温冰箱(约-20 ℃或-70 ℃)储存55 d稳定。
4 数据处理与生物等效性分析[8,10]
4.1 药动学参数 用于评价的主要药动学参数包括:Cmax、AUC0~t、AUC0~∞、Tmax、t1/2、λZ。
药代动力学参数计算由WinNonlin8.0版本完成,方差分析、等效性结果分析、人口学与安全性数据分析使用SAS 9.4版本软件分析。受试者单次空腹或餐后口服盐酸西替利嗪片受试制剂和参比制剂的药动学参数如表4和表5所示。

表4 受试者单次空腹口服盐酸西替利嗪片T、R的药动学参数
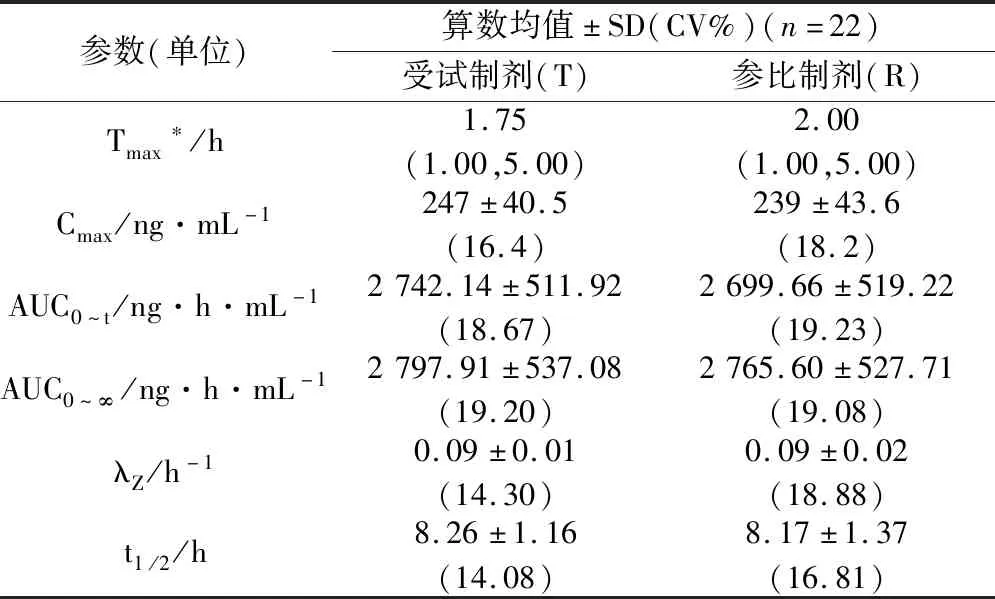
表5 受试者单次餐后口服盐酸西替利嗪片T、R的药动学参数
4.2 等效性判断 采用西替利嗪的药代动力学数据进行生物等效性评价。
药物经时浓度数据采用实测值进行描述。将受试制剂与参比制剂的药代动力学参数Cmax、AUC0~t、AUC0~∞经对数转换后进行多因素方差分析在α=0.05水平上进行双向单侧t检验,对Tmax进行非参数检验。采用Cmax、AUC0~t、AUC0~∞几何均值比的90%的置信区间,按照不低于80.00%,不高于125.00%,对两种制剂空腹和餐后的生物等效性进行评价。
5 结果
空腹BE试验:24名健康受试者分别单次空腹服用受试制剂和参比制剂10 mg后,Cmax、AUC0~t、AUC0~∞几何均数的比值分别为100.18%、96.37%、96.00%,其90%置信区间分别为95.72%~14.84%、92.37%~100.55%、91.77%~100.42%,均落在等效区间80.00%~125.00%之间,药动学参数的统计分析结果见表6,平均药时曲线见图2。

图2 24名受试者分别空腹口服T、R后西替利嗪的平均药时曲线

表6 药动学参数的统计分析结果(空腹)
餐后BE试验:22名健康受试者分别单次餐后服用受试制剂和参比制剂10 mg后,Cmax、AUC0~t、AUC0~∞几何均数的比值分别为103.98%、102.19%、101.58%,其90%置信区间分别为98.31%~109.97%、98.33%~106.20%、98.07%~105.20%,均落在等效区间80.00%~125.00%之间,药动学参数的统计分析结果见表7,平均药时曲线见图3。

表7 药动学参数的统计分析结果(餐后)
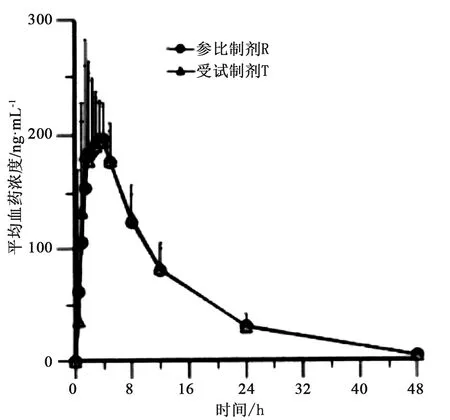
图3 22名受试者分别餐后口服T、R后西替利嗪的平均药时曲线
6 结论
研究表明,健康受试者空腹和餐后条件下单剂量服用盐酸西替利嗪片受试制剂与参比制剂在人体内的药代动力学参数AUC、Tmax、t1/2、Tmax均无显著性差异,两制剂具有生物等效性。
健康受试者单次空腹和餐后服用盐酸西替利嗪片受试制剂与参比制剂的安全性一致且较好

