把握知识脉络 突破不平凡的“钒”
安徽 尉言勋 李 静
钒是一种重要的过渡金属元素,在元素周期表中位于第四周期ⅤB族。可用作合金的添加剂,有“金属维生素”之称。中学教材没有专题介绍钒的相关性质,却在2016年全国卷Ⅲ中第一次出现,2020年全国卷Ⅰ、卷Ⅲ再次以钒及其化合物为载体,结合新情境、新信息考查电化学及工艺流程等相关知识,侧重考查考生获取并加工处理新信息的能力,知识迁移和综合应用的能力,有效落实了化学学科核心素养。本文对钒及其化合物的性质和用途作了简单介绍,并对典型题目进行了详细解析。
一、知识脉络

图1
二、知识归纳
1.单质
(1)物理性质
纯钒为银白色金属,其晶体呈体心立方堆积,具有较高的熔点和沸点,常与铌、钼、钨、钽并称为难熔金属。当其中含有少量氢、氧、氮、碳等杂质时,性质变脆,硬度增大,延展性降低。
(2)化学性质
钒在空气中于250℃以下比较稳定,有良好的可塑性和可锻性。超过300℃会有明显的氧化。
①在常温下,块状钒不与空气、海水、苛性碱等反应,除氢氟酸外,不与非氧化性酸反应。
②高温下可与氧气、氯气等非金属单质反应。
③可溶于浓硫酸、硝酸或王水中。

④钒能耐浓度为10%的NaOH溶液腐蚀,但不能耐热KOH溶液的腐蚀。
2.钒氧化物的性质
常见的钒氧化物:VO、V2O3、VO2、V2O5,钒元素化合价由+2价到+5价,从低价到高价,由强还原剂过渡到强氧化剂,其水溶液由强碱性逐渐变成弱酸性。
低价钒氧化物不溶于水,但遇强酸会形成强酸盐,如VCl2、VSO4。在空气中易被氧化成高价,反之,五价氧化钒则可被还原性气体还原成四、三、二价的钒氧化合物。
(1)五氧化二钒
①物理性质
橙黄色或砖红色固体。无味、有毒、微溶于水,形成淡黄色酸性溶液。V2O5是最常用的钒化工制品,可用于制硫酸钒催化剂。
②化学性质


③V2O5的制备方法:


(2)二氧化钒(或四氧化二钒)

(3)三氧化二钒


(4)四种氧化物对比

表1
3.钒的氢氧化物和钒酸
(1)钒的氢氧化物
①V(OH)2为褐色沉淀,无纯品,极易被氧化,可溶于盐酸,不溶于氢氧化钠、氢氧化钾,可由正二价钒离子与碱作用制得。
②V(OH)3为绿色胶状沉淀,不稳定,吸收空气中的氧气而被氧化。可由三氯化钒与碱性溶液反应得到氧化物的水合物VO2·xH2O。
③V2O5·xH2O为氢氧化钒(Ⅴ)的存在形式,含水量难以确定。具有两性,酸性比钒酸(Ⅴ)弱。溶于酸生成钒盐(Ⅴ),溶于碱生成正四价钒的含氧酸盐。
(2)钒酸

4.含氧酸盐及多钒酸盐
(1)正钒酸盐

(2)偏钒酸盐

(3)钒酸盐



三、典例解析
1.在电化学中的考查

( )

图2
A.负载通过0.04 mol电子时,有0.224 L(标准状况)O2参与反应
B.正极区溶液的pH降低、负极区溶液的pH升高
D.电流由复合碳电极经负载、VB2电极、KOH溶液回到复合碳电极
【答案】B

【点评】本题考查新型电池,根据题给的VB2电极反应式可得通入氧气的极为正极,VB2电极为负极。明确原电池基本原理以及阴、阳离子定向移动方向,同时结合图中的信息有助于解题。注意电池中电流方向与电子转移方向相反。题目侧重考查学生的分析能力和应用能力,有效渗透了证据推理与模型认知化学学科核心素养。
2.在工艺流程题中的考查
【例2】(2020·全国卷Ⅰ·26)钒具有广泛用途。黏土钒矿中,钒以+3、+4、+5价的化合物存在,还包括钾、镁的铝硅酸盐,以及SiO2、Fe3O4。采用如图3工艺流程可由黏土钒矿制备NH4VO3。

图3
该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如表2所示:

表2
回答下列问题:
(1)“酸浸氧化”需要加热,其原因是________________________。

(3)“中和沉淀”中,钒水解并沉淀为V2O5·xH2O,随滤液②可除去金属离子K+、Mg2+、Na+、________,以及部分的________。
(4)“沉淀转溶”中,V2O5·xH2O转化为钒酸盐溶解。滤渣③的主要成分是________。
(5)“调pH”中有沉淀生成,生成沉淀反应的化学方程式是______________________________。
(6)“沉钒”中析出NH4VO3晶体时,需要加入过量NH4Cl,其原因是________________________。
【答案】(1)加快酸浸和氧化反应速率(促进氧化完全)
(3)Mn2+Al3+和Fe3+
(4)Fe(OH)3

(6)利用同离子效应,促进NH4VO3尽可能析出完全

【点评】本题以黏土钒矿制备NH4VO3为情境,考查陌生方程式的书写,流程的分析,氧化还原反应等相关知识。明确每步的除杂、分离目的,根据工艺流程分析出相应反应是解题关键。侧重考查学生从题目中获取新信息的能力,分析问题、解决问题的能力。题目综合性较强,体现了证据推理与模型认知化学学科核心素养。
3.在物质结构与性质选考题中的考查
【例3】钒(23V)被称为“现代工业味精”,可添加在钢铁中,并以钛-铝-钒合金的形式用于航天领域;钒的化合物被广泛用作催化剂、燃料及电池等。我国钒钛磁铁矿储量较大,是世界上产钒大国。请完成下列问题:
(1)钒的基态原子的外围电子排布式为________。
(2)钒的某种氧化物的晶胞结构如下图4所示,则该氧化物的化学式为________,其熔沸点比下图6(为邻苯二甲酸酐的结构)物质的熔沸点要________(填“高”“低”或“差不多”)。
(3)V2O5是一种常见的催化剂,在合成硫酸、硝酸、邻苯二甲酸酐、乙烯、丙烯中,均使用五氧化二钒作催化剂。

图4

图5

图6

图7
①五氧化二钒的结构简式如上图5所示,则该结构中含有________个π键。
②在丙烯(CH3CH=CH2)分子中碳原子的杂化方式分别为________。
③H、C、N、O四种元素,其电负性从大到小的顺序依次为________。

(4)已知单质钒的晶胞如上图7所示,假设晶胞的边长为d×10-7cm,钒的相对原子质量为M,则密度为_______g·cm-3。(设阿伏加德罗常数为NA)
【答案】(1)3d34s2
(2)VO2高
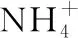

【点评】本题以钒(23V)为载体,贯穿题目的始终。重点考查核外电子排布、化学键、杂化方式、晶体类型与性质、晶胞结构与计算等相关知识,难点在于晶胞的密度计算。题目渗透了宏观辨识与微观探析、证据推理与模型认知等化学学科核心素养。


