《物质结构与性质》命题研究与科学备考
黑龙江 王 惠 刘 波
《物质结构与性质》选修题是历年高考全国卷必考题型,其中多数为常规考点,学生得分相对比较容易,同时也会渗透新的考查角度,具有较好的区分度。为了使这部分知识的复习更有针对性,笔者结合近三年全国卷的考点分布浅谈备考相关策略。
一、物质结构考点分布
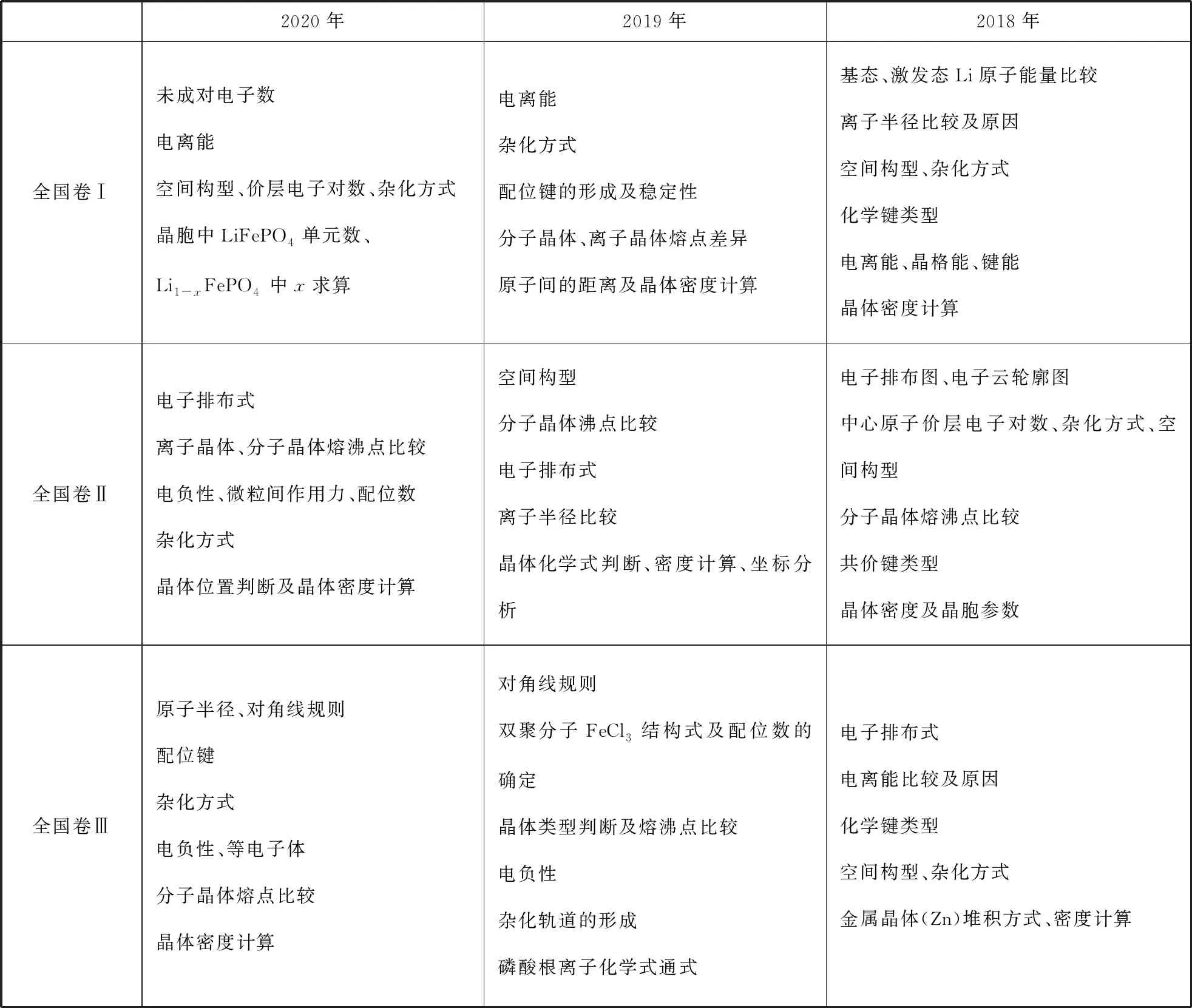
表1 2018—2020年全国卷物质结构与性质考点分布
从近三年的全国卷考点分布情况看,物质结构部分的试题难度较小,但考查形式和命题角度都在逐年发生变化。笔者发现此类试题有如下命题特点:
1.最基本的考点每年均有体现。从近三年考点分布情况可以看出,考查内容主要涉及最基本、最典型、最主干的知识,如电子排布式,价层电子对数,杂化轨道,空间构型,晶体熔沸点比较,晶体类型判断与晶胞相关计算,只要学生用心记忆,规范书写,就一定能得分。
例如,关于杂化轨道、价层电子对数、空间构型的考查在2018—2020年高考中分别以如下形式出现:
【例1】(1)(2020·全国卷Ⅰ·35节选)磷酸根离子的空间构型为________,其中P的价层电子对数为________、杂化轨道类型为________。
【答案】正四面体 4 sp3
(2)(2019·全国卷Ⅲ·35节选)NH4H2PO4中,电负性最高的元素是________;P的________杂化轨道与O的2p轨道形成________键。
【答案】O sp3σ
(3)(2018·全国卷Ⅰ·35节选)LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间构型是________、中心原子的杂化形式为________。
【答案】正四面体 sp3
所以,在备考时,我们可以把近五年高考中相同考查角度的真题整理出来,让学生通过感知高考题了解这类题的考点及考查形式,然后再进行归纳总结,让学生熟练应用价层电子对互斥理论及杂化轨道理论。
2.考查容易被忽视的基本概念。如能层、能级、空间运动状态、原子轨道、电子云、手性异构、晶体自范性、X-射线衍射实验等。
3.试题考查角度新颖,源于教材又高于教材。如2017年全国卷Ⅱ由学生熟悉的第一电离能过渡到第一电子亲和能,同时也考查了离域π键的知识;2018年全国卷Ⅲ考查了六方最密堆积晶胞密度的计算;2019年全国卷Ⅲ考查了磷酸根离子化学式通式。
【例2】(2019·全国卷Ⅲ·35节选)NH4H2PO4和LiFePO4属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如下图所示:
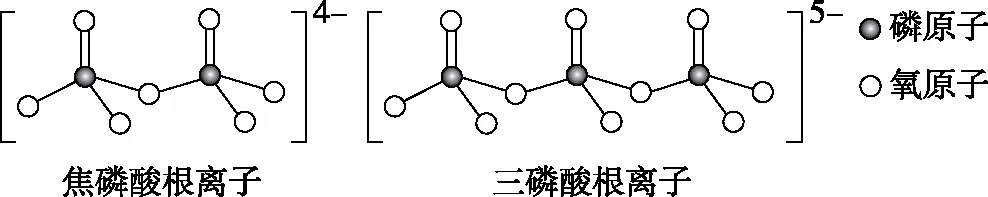
这类磷酸根离子的化学式可用通式表示为________(用n代表P原子数)。
【答案】(PnO3n+1)(n+2)-
【例3】(2019·全国卷Ⅲ·35改编)直链多磷酸根阴离子是由两个或两个以上磷氧四面体通过共用顶角氧原子连接起来的,如图所示为一种无限长单链结构的多磷酸根,该多磷酸根的化学式为______________________________(用n代表P原子数)。
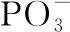
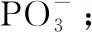
二、物质结构与性质复习备考策略
1.研读课程标准及历年高考、模考题
在备考时老师和学生一定要认真研读课程标准,明确高考考点及对知识和能力的要求。复习时还要研究历年的高考题和模考题,了解常见的命题角度和命题形式,分模块强化练习。
2.将知识模块化、系统化
笔者将《物质结构与性质》中的考点与高考真题和模考题进行整合,共归纳出13个模块,包括原子结构、焰色反应、电离能、分子空间构型、无机含氧酸酸性、溶解性、晶体常识、分子间作用力、键参数、分子晶体熔沸点、离子晶体熔沸点、原子晶体熔沸点、金属晶体熔沸点,再对其进行系统性复习,能够对学生的基础训练、能力打造起到至关重要的作用。
例如在复习晶体熔沸点时,可先让学生掌握晶体类型的判断方法,掌握每种晶体类型包含的代表物质,再来讲解每种晶体熔沸点的比较方法,并进行逐一练习。
以下为晶体熔沸点比较方法归纳:
【例4】(2020·全国卷Ⅱ·35节选)Ti的四卤化物熔点如下表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是________________________。
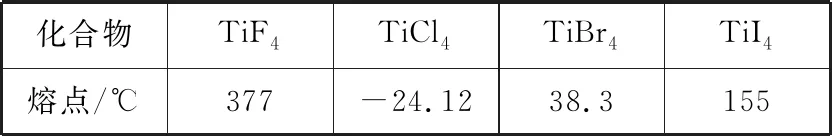
化合物TiF4TiCl4TiBr4TiI4熔点/℃377-24.1238.3155
【答案】TiF4为离子化合物,熔点高,其他三种均为共价化合物,随相对分子质量的增大分子间作用力增大,熔点逐渐升高
【例5】(2020·全国卷Ⅲ·35节选)与NH3BH3原子总数相等的等电子体是________(写分子式),其熔点比NH3BH3________(填“高”或“低”)。
【答案】CH3CH3低
【例6】(2019·全国卷Ⅰ·35节选)一些氧化物的熔点如下表所示:

氧化物Li2OMgOP4O6SO2熔点/℃1 5702 80023.8-75.5
解释表中氧化物之间熔点差异的原因________________________。
【答案】Li2O、MgO为离子晶体,P4O6、SO2为分子晶体。晶格能MgO>Li2O。分子间作用力P4O6>SO2
【例7】(2019·全国卷Ⅱ·35节选)元素As与N同族。预测As的氢化物分子的立体结构为________,其沸点比NH3的________(“高”或“低”),其判断理由是________________________。
【答案】三角锥形 低 NH3分子间存在氢键
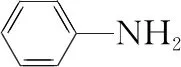
【答案】分子晶体 苯胺分子之间存在氢键
【例9】(2018·全国卷Ⅱ·35节选)如图所示为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为______________________________。
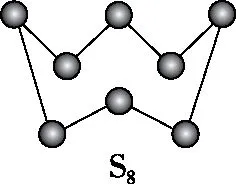
【答案】S8相对分子质量大,分子间范德华力强
3.细研教材
在备考时,我们不能忽略教材,应反复咀嚼教材中的每一个字,包括教材页脚处的小字、科学视野、资料卡片以及课后习题。在2015年全国卷Ⅰ中便出现了教材原文“电子云是处于一定空间运动状态的电子在原子核外出现的概率密度的形象化描述”。
4.规范作答
在复习时,我们应该强化积累各类题型解答时化学用语的规范使用,并注重对学生书写的训练。例如在解答焰色反应的形成原因时,规范的答题语言应为,电子由能量较高的激发态跃迁到能量较低的激发态乃至基态时,能量会以光的形式释放。再例如比较电离能时,I1(Li)>I1(Na)的原因是,Na与Li同族,而Na电子层数多,原子半径大,故易失电子。


