五味子乙素对脂多糖诱导的脓毒症急性肺损伤大鼠肺组织病理损伤、炎症反应和核因子-κB表达的影响
钟春蕾,黄国涛,张志强
(1.新乡医学院第一附属医院呼吸科,河南 新乡 453000;2.新乡医学院第一附属医院心内科,河南 新乡 453000)
脓毒症是以感染为诱因的全身炎症反应,其病死率可达30%~50%[1]。在脓毒症并发的器官损伤中,急性肺损伤发病率最高且出现最早,也是造成脓毒症患者死亡的主要原因[2]。因此,如何有效防治脓毒症肺损伤是临床亟待解决的棘手问题。脂多糖(lipopolysaccharides,LPS)是革兰氏阴性细菌细胞壁的主要成分,也是革兰氏阴性细菌感染的主要致病因素,而革兰氏阴性细菌感染是脓毒症主要诱因,所以LPS常用作诱导构建脓毒症急性肺损伤模型[3]。五味子乙素是中药北五味子中含量最高的联苯环辛烯类木脂素,其具有抗哮喘[4]、抗肿瘤[5]、抗感染[6]、保肝[7]和保护心脏[8]等多种生理作用,Cai等[9]报道,五味子乙素能够减轻LPS诱导的急性肺损伤的炎症反应。核因子-κB(nuclear factor-kappa B,NF-κB)是机体一种关键性调控因子,通过调控多种基因的表达,参与免疫反应、炎症反应和细胞凋亡等多种生命活动[10]。已有文献报道,NF-κB在LPS诱导的肺损伤发病过程中发挥重要作用[11]。本研究主要观察五味子乙素对脂多糖诱导的脓毒症急性肺损伤大鼠肺组织病理损伤、炎症反应和NF-κB表达的调节作用。
1 材料
1.1 实验动物 SPF级雄性SD大鼠,6周龄,体质量为180~200 g,健康状况良好,购自四川成都达硕实验动物有限公司,生产许可证号:SCXK(川)2019-0028。大鼠在25 ℃,12 h光照/12 h黑暗循环的饲养室,自由获取水和食物。在实验前1周开始适应性喂养。
1.2 主要试剂 五味子乙素(纯度≥98%,批号 20181156-2)购自成都瑞芬思生物科技有限公司;地塞米松(纯度≥98%,批号 D1756-181013)购自北京赛因百奥生物技术有限公司;LPS购自美国Sigma公司;BCA试剂盒购自上海酶联;牛鲍氏计数板购自上海爱宝医疗器械公司;ELISA试剂盒购自美国 Invitrogen公司;NF-κB p65、磷酸核因子 κB 抑制蛋白(phosphorylation inhibitor of nuclear factor kappa-B,pIκBα)和Toll样受体4(toll-like receptors 4,TLR4)兔单抗及山羊抗兔多克隆二抗购自美国Abcam公司。
1.3 仪器 ME103E-02电子天平:梅特勒-托利多国际贸易(上海)有限公司;MR-96A酶标分析仪:深圳迈瑞生物医疗电子股份公司;GL-21M高速冷冻离心机:湖南湘仪实验室仪器开发有限公司;XSP-8CA显微镜:上海光学仪器厂。
2 方法
2.1 模型复制和分组给药 将SD大鼠随机分为对照组、模型组、五味子乙素组、地塞米松组,每组10只。模型组、五味子乙素组和地塞米松组大鼠采用气管滴注8 mg/kg LPS制备急性肺损伤大鼠模型[12],对照组气管滴注等量生理盐水。五味子乙素组大鼠在模型复制前1 h腹腔注射80 mg/kg五味子乙素[9,13];地塞米松组大鼠在模型复制前1 h腹腔注射20 mg/kg地塞米松;对照组和模型组分别注射等量生理盐水。模型复制12 h后,戊巴比妥钠麻醉大鼠,用PBS冲洗气道,收集支气管肺泡灌洗液(bronchoalceolar lavage fluid,BALF)和肺组织。
2.2 观察指标及方法
2.2.1 肺湿/干质量比测定 用电子天平称新鲜肺组织的质量为肺的湿质量,然后将其置于80 ℃烤箱中烘烤2 d后称干质量,计算肺组织的湿/干质量比。
2.2.2 BALF中总蛋白测定 于冰上用RIPA蛋白裂解液提取BALF中总蛋白,按照BCA试剂盒操作说明测定BALF中总蛋白。
2.2.3 BALF中白细胞计数 利用牛鲍氏计数板,并采用双人双盲法计算BALF中白细胞数。
2.2.4 苏木精-伊红(hematoxylin-eosin,HE)染色观察肺组织损伤情况 取右肺组织,用4%甲醛固定,并经乙醇梯度脱水后,石蜡包埋并切片,脱蜡复水后,HE染色,显微镜下观察肺组织损伤情况。
2.2.5 ELISA法检测肺组织中肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)、白细胞介素-6(interleukin-6,IL-6)含量 按照ELISA试剂盒说明书测定TNF-α、IL-1β、IL-6水平。于已包被好的反应孔中加入0.1 mL的样品,37 ℃孵育1 h;洗涤后,加入0.1 mL稀释的酶标抗体,37 ℃ 孵育1 h;加底物液显色,孵育30 min,加入终止液,测定吸光度值。
2.2.6 试剂盒检测肺组织中丙二醛(malondialdyhyde,MDA)和超氧化物歧化酶(superoxide dismutase,SOD)含量 按照MDA和SOD试剂盒说明书检测MDA、SOD含量。
2.2.7 蛋白质印迹检测肺组织中NF-κB p65、pIκBα和TLR4的表达水平 于冰上用RIPA蛋白裂解液提取总蛋白,用BCA试剂盒检测蛋白浓度。每组取30 μL蛋白质用SDS-PAGE分离后,转移蛋白质到PVDF膜;室温下用5%脱脂牛奶封闭2 h,以1∶1 000的浓度加入相对应的一抗,4 ℃孵育过夜;弃去一抗,清洗PVDF膜后,加入二抗,室温下封闭1 h;滴加ECL于暗室曝光显影。

3 结果
3.1 各组大鼠肺湿/干质量比比较 与对照组相比,模型组大鼠肺湿/干质量比显著升高(P<0.05);与模型组相比,五味子乙素组和地塞米松组大鼠肺湿/干质量比显著降低(P<0.05)。见图1。

注:A.对照组;B.模型组;C.五味子乙素组;D.地塞米松组;与对照组比较,*P<0.05;与模型组比较,#P<0.05
3.2 各组大鼠BALF中总蛋白含量及白细胞数比较 与对照组相比,模型组大鼠BALF中总蛋白含量及白细胞数均显著增多(P<0.05);与模型组相比,五味子乙素组和地塞米松组大鼠BALF中总蛋白含量及白细胞数均显著减少(P<0.05)。见图2。


注:A.对照组;B.模型组;C.五味子乙素组;D.地塞米松组;与对照组比较,*P<0.05;与模型组比较,#P<0.05
3.3 各组大鼠肺组织病理损伤情况比较 对照组大鼠肺组织结构清晰完整,肺泡腔内无渗出物,肺间质无水肿,肺泡间隔未出现增厚;模型组大鼠肺泡结构破坏严重,肺泡腔广泛出血并可见炎症细胞浸润,肺间质出现水肿,肺泡间隔明显增厚;五味子乙素组和地塞米松组大鼠肺泡结构破坏程度明显减轻,炎症细胞浸润明显减少,肺间质水肿程度明显降低,肺泡间隔未见明显增厚。见图3。

注:A.对照组;B.模型组;C.五味子乙素组;D.地塞米松组
3.4 各组大鼠肺组织中TNF-α、IL-1β、IL-6含量比较 与对照组相比,模型组大鼠TNF-α、IL-1β、IL-6含量显著增多(P<0.05);与模型组相比,五味子乙素组和地塞米松组大鼠TNF-α、IL-1β、IL-6含量显著减少(P<0.05)。见图4。

注:A.对照组;B.模型组;C.五味子乙素组;D.地塞米松组;与对照组比较,*P<0.05;与模型组比较,#P<0.05
3.5 各组大鼠肺组织中MDA、SOD含量比较 与对照组相比,模型组大鼠MDA含量显著上升,SOD活性显著下降(P<0.05);与模型组相比,五味子乙素组和地塞米松组大鼠MDA含量显著下降、SOD含量显著上升(P<0.05)。见图5。
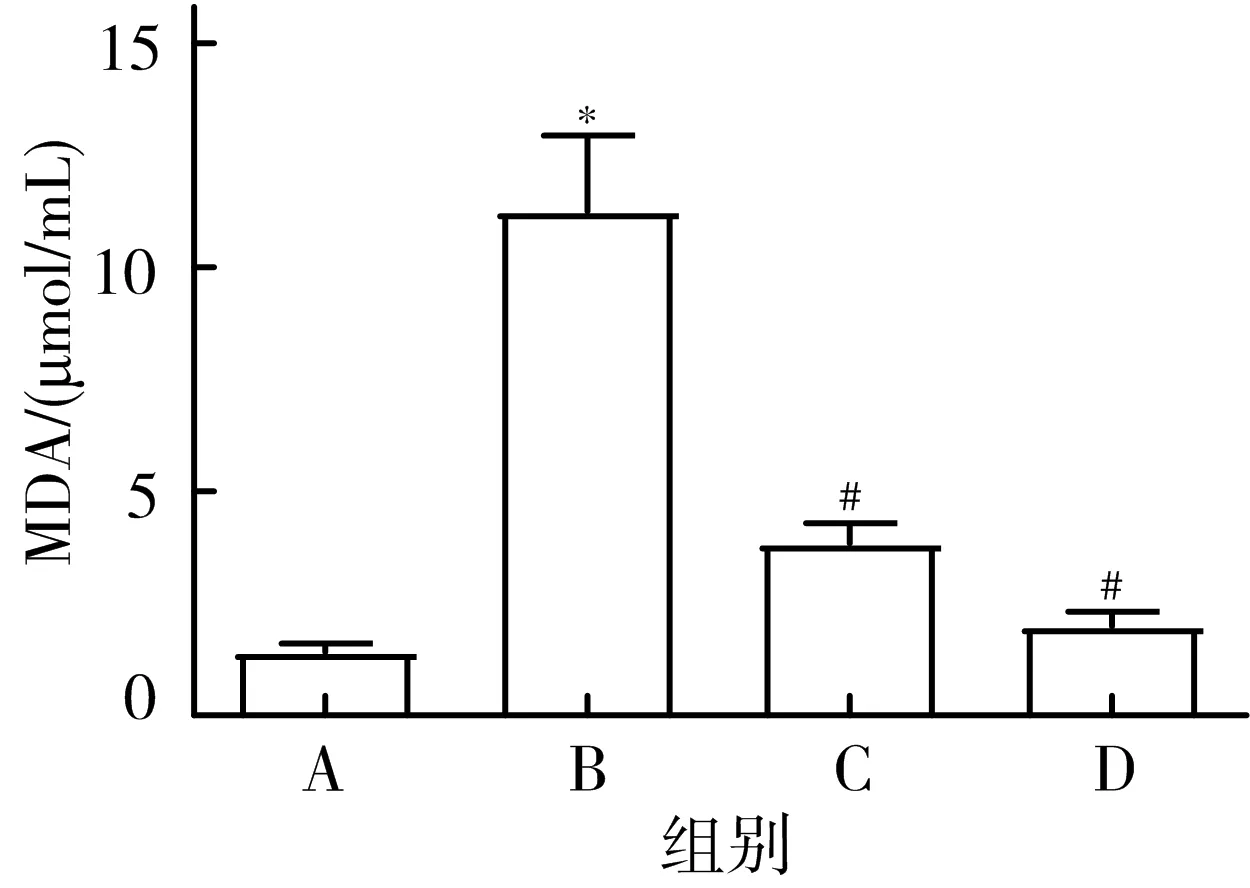

注:A.对照组;B.模型组;C.五味子乙素组;D.地塞米松组;与对照组比较,*P<0.05;与模型组比较,#P<0.05

3.6 各组大鼠肺组织中NF-κB p65、pIκBα和TLR4蛋白表达水平比较 与对照组相比,模型组大鼠NF-κB p65、pIκBα和TLR4表达水平均显著上调(P<0.05);与模型组相比,五味子乙素组和地塞米松组大鼠NF-κB p65、pIκBα和TLR4表达水平均显著下调(P<0.05)。见图6。

注:A.对照组;B.模型组;C.五味子乙素组;D.地塞米松组;与对照组比较,*P<0.05;与模型组比较,#P<0.05
4 讨论
急性肺损伤是各种直接或间接致伤因素导致的肺泡上皮细胞及毛细血管内皮细胞损伤,造成弥漫性肺间质及肺泡水肿,进而导致的急性低氧性呼吸功能不全的疾病。有研究[14]报道,LPS诱导急性肺损伤大鼠肺湿/干质量比明显升高,肺部出现水肿、充血和炎症细胞浸润,采用盐酸戊乙奎醚治疗后,大鼠肺湿/干质量比明显降低,肺部出现的水肿、充血和炎症细胞浸润程度显著减轻,说明盐酸戊乙奎醚具有治疗LPS诱导急性肺损伤的作用。而本次笔者通过研究发现,五味子乙素也能够显著减少LPS诱导的脓毒症急性肺损伤模型大鼠的肺湿/干质量比、BALF中总蛋白含量和白细胞数,并显著减轻LPS诱导的肺泡结构破坏、肺泡腔出血、炎症细胞浸润和肺泡间隔增厚等脓毒症急性肺损伤程度。结果表明,五味子乙素也能够治疗LPS诱导的脓毒症急性肺损伤。
TNF-α、IL-1β、IL-6等炎症因子表达水平和炎症反应水平是呈正相关的,炎症因子增加是脓毒性急性肺损伤的重要标志。Chi等[15]的研究表明,异鼠李碱通过抑制炎症反应,保护小鼠免受LPS诱导的急性肺损伤。Wang等[16]研究发现,葛根素通过抑制炎症反应预防LPS诱导的急性肺损伤。所以,抑制炎症反应是有效治疗LPS诱导的肺损伤的重要途径。本研究结果表明,五味子乙素能显著减少LPS诱导的脓毒症急性肺损伤大鼠的TNF-α、IL-1β、IL-6含量,这说明五味子乙素能够减缓LPS诱导的脓毒症急性肺损伤引起的炎症反应。这与已有报道五味子乙素能够防止香烟烟雾诱导的肺部炎症[17],五味子乙素抑制LPS诱导的人脐静脉内皮细胞炎症反应[18]相一致。
LPS可诱导机体产生过多的氧自由基,从而引起氧化应激反应。Du等[19]研究表明,沙棘膏通过降低氧化应激对LPS诱导的急性肺损伤小鼠起保护作用。Fu等[20]研究发现,右美托咪定通过抑制大鼠氧化应激、线粒体功能障碍和细胞凋亡,减轻LPS诱导的急性肺损伤。因此,抑制机体氧化应激反应可有效治疗LPS诱导的急性肺损伤。本研究结果表明,五味子乙素能显著降低LPS诱导的脓毒症急性肺损伤大鼠MDA含量,升高SOD含量,这说明五味子乙素能够减缓LPS诱导的脓毒症急性肺损伤引起的氧化应激,与Ying等[21]发现五味子乙素通过调节抗氧化通路缓解急性氧化应激,Xin等[22]报道五味子乙素减轻创伤性脊髓损伤诱导的氧化应激反应相一致。
LPS诱导肺损伤的发病机制与NF-κB通路密切相关。Niu等[23]报道,卡维丁通过NF-κB信号通路改善LPS诱导的急性肺损伤。Peng等[24]发现,穿心莲内酯磺酸盐通过MAPK和NF-κB通路改善LPS诱导的急性肺损伤。因此,五味子乙素减缓LPS诱导的脓毒症急性肺损伤可能与NF-κB通路有关。本研究结果表明,五味子乙素能够显著下调LPS诱导的脓毒症急性肺损伤大鼠的NF-κB p65、pIκBα和TLR4表达量,这说明五味子乙素能够抑制LPS诱导的脓毒症急性肺损伤引起的NF-κB通路激活。
地塞米松是一种糖皮质激素,具有良好的抗炎作用,可以在短期之内减轻红、肿、热、痛等症状。因此,本研究选用地塞米松作为阳性对照药物。长期使用地塞米松会造成过敏性休克、呼吸困难、低钾血症、肌无力、精神恍惚、消化不良等症状,而五味子乙素治疗脓毒症急性肺损伤的效果和作用与地塞米松相似,但其毒性和不良反应小。
本研究发现,五味子乙素能够减轻LPS诱导脓毒症急性肺损伤大鼠的肺组织病理损伤,抑制炎症反应和氧化应激反应,抑制NF-κB通路激活,从而来减缓LPS诱导的大鼠脓毒症急性肺损伤。这为五味子乙素的开发利用提供参考依据,为脓毒症急性肺损伤的治疗奠定基础。

