胃癌早期筛查中血清PG和Hp抗体联合检测的效果研究
李伟强 王健 钟妙容 陈旭明 李晶

【摘要】 目的 探讨胃癌早期筛查中血清胃蛋白酶原(PG)和幽门螺杆菌(Hp)抗体联合检测的应用效果。方法 选取120例经病理确诊的胃癌及癌前病变患者, 根据疾病不同分为胃溃疡组、浅表性胃炎组、萎缩性胃炎组、胃癌组, 每组30例;另选取同期健康检查者30例作为对照组。所有受试者均接受[化学发光]化学发光法检查。比较各组PGⅠ、PGⅡ、PGⅠ/PGⅡ比值(PGR)水平及Hp抗体阳性率, 根据Hp抗体检测结果将患者分为Hp抗体阳性组与Hp抗体阴性组, 比较Hp抗体阳性组与Hp抗体阴性组PGⅠ、PGⅡ、PGR水平。结果 胃溃疡组的PGⅠ、PGⅡ水平均明显高于浅表性胃炎组、萎缩性胃炎组、胃癌组、对照组, 差异具有统计学意义(P<0.05);萎缩性胃炎组、胃癌组的PGⅠ、PGR水平均低于对照组, PGⅡ水平明显高于对照组, 差异具有统计学意义(P<0.05);浅表性胃炎组的PGⅠ、PGR水平均高于萎缩性胃炎组和胃癌组, PGⅡ水平低于胃癌组, 差异具有统计学意义(P<0.05);萎缩性胃炎组的PGR高于胃癌组, 胃溃疡组PGR水平高于萎缩性胃炎组和胃癌组, 差异具有统计学意义(P<0.05)。胃溃疡组的血清Hp抗体阳性率最高, 其次依次为萎缩性胃炎组、胃癌组、浅表性胃炎组;胃溃疡组的血清Hp抗体阳性率76.67%高于对照组的40.00%, 差异具有统计学意义(P<0.05);萎缩性胃炎组、胃癌组、浅表性胃炎组与对照组Hp抗体阳性率比较差异均无统计学意义(P>0.05)。Hp抗体阳性组PGⅠ、PGⅡ水平均低于Hp抗体阴性组, 但比较差异无统计学意义(P>0.05);Hp抗体阳性组PGR(5.17±1.02)明显低于Hp抗体阴性组(7.42±1.98), 差异具有统计学意义(P<0.05)。结论 PG和Hp抗体水平变化是评估胃癌及癌前病变的关键指标, PGⅠ、PGR水平明显降低可提示胃癌患病风险增大, 可作为胃癌早期筛查的血清学指标, 同时PGR水平变化受Hp感染的影响较大。
【关键词】 胃癌;早期筛查;血清胃蛋白酶原;幽门螺杆菌抗体;联合检测
DOI:10.14163/j.cnki.11-5547/r.2020.31.022
消化道恶性肿瘤是临床上较为高发的恶性病变, 其中又以胃癌的发病率最高, 且近年来呈现出了逐年攀升的趋势, 对患者生命安全及生活质量产生严重影响[1]。钡剂-X线筛查胃癌具有一定应用价值, 但该筛查方式具有操作较复杂、放射线易暴露、费用高等不足, 难以大规模推广应用, 因此, 探索一种更加经济、有效、简便易行、对人体无害的胃癌早期筛查方案具有重要意义[2]。相关研究指出[3], PG、Hp抗体联合检测在胃癌早期筛查中表现出了理想的应用效果, 能够显著提高胃癌检出率, 获得了广大医患一致好评。本次研究收集120例胃癌及癌前病变患者和30例健康体检者, 验证PG、Hp抗体联合检测方案的可行性, 报告如下。
1 资料与方法
1. 1 一般资料 选取2018年12月~2020年1月本院收治的120例经病理确诊的胃癌及癌前病变患者进行研究, 将患者根据疾病不同分为胃溃疡组、浅表性胃炎组、萎缩性胃炎组、胃癌组, 每组30例;另选取同期健康检查者30例作为对照组。对照组男女比例为19/11;年龄33~78岁, 平均年龄(52.48±8.51)岁。胃溃疡组男女比例为18/12;年龄34~76岁, 平均年龄(53.05±7.92)岁。浅表性胃炎组男女比例为17/13;年龄35~75岁, 平均年龄(52.73±8.16)岁。萎缩性胃炎组男女比例为20/10;年龄32~79岁, 平均年龄(52.19±8.94)岁。胃癌组男女比例为19/11, 年龄36~81岁, 平均年龄(54.08±8.98)岁。各组一般资料对比差异无统计学意义(P>0.05), 具有可比性。所有患者均经病理及胃镜检查确诊, 所有受试者明晰此次研究并签署知情同意书, 此次研究经本院伦理委员会批许。
1. 2 方法 所有受试者均需接受血样采集、病毒指标检测及其他常规检查, 按筛查要求进行染色、黏膜活检及病理检查。抽取受试者3 ml空腹静脉血, 离心后分离血清, 通过化学发光法对PGⅠ、PGⅡ、PGR水平进行检查;通过胶体金法对血清Hp抗体进行检测, 确定感染情况。
1. 3 观察指标 详细记录并比较各组PGⅠ、PGⅡ、PGR水平及Hp抗体阳性率, 根据Hp抗体检测结果将患者分为Hp抗体阳性组与Hp抗体阴性组, 比较Hp抗体阳性组与Hp抗体阴性组PGⅠ、PGⅡ、PGR水平。
1. 4 统计学方法 采用SPSS20.0统计学软件对数据进行处理。计量资料以均数±标准差( x-±s)表示, 采用t檢验;计数资料以率(%)表示, 采用χ2检验。P<0.05表示差异有统计学意义。
2 结果
2. 1 各组PGⅠ、PGⅡ、PGR水平比较 胃溃疡组的PGⅠ、PGⅡ水平均明显高于浅表性胃炎组、萎缩性胃炎组、胃癌组、对照组, 差异具有统计学意义(P<0.05);萎缩性胃炎组、胃癌组的PGⅠ、PGR水平均低于对照组, PGⅡ水平明显高于对照组, 差异具有统计学意义(P<0.05);浅表性胃炎组的PGⅠ、PGR水平均高于萎缩性胃炎组和胃癌组, PGⅡ水平低于胃癌组, 差异具有统计学意义(P<0.05);萎缩性胃炎组的PGR高于胃癌组, 胃溃疡组PGR水平高于萎缩性胃炎组和胃癌组, 差异具有统计学意义(P<0.05)。见表1。
2. 2 各组Hp抗体阳性率比较 胃溃疡组的血清Hp抗体阳性率最高, 其次依次为萎缩性胃炎组、胃癌组、浅表性胃炎组;胃溃疡组的血清Hp抗体阳性率76.67%高于对照组的40.00%, 差异具有统计学意义(P<0.05);萎缩性胃炎组、胃癌组、浅表性胃炎组与对照组Hp抗体阳性率比较差异均无统计学意义(P>0.05)。见表2。
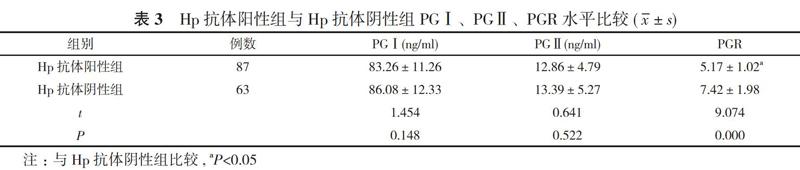
2. 3 Hp抗体阳性组与Hp抗体阴性组PGⅠ、PGⅡ、PGR水平比较 Hp抗体阳性组PGⅠ、PGⅡ水平均低于Hp抗体阴性组, 但比较差异无统计学意义(P>0.05);Hp抗体阳性组PGR(5.17±1.02)明显低于Hp抗体阴性组(7.42±1.98), 差异具有统计学意义(P<0.05)。见表3。
3 讨论
PG有PGⅠ、PGⅡ之分, 属于胃蛋白酶前体, 是胃黏膜细胞分化过程中的终末产物, PG标志着消化功能是否成熟[4]。PG绝大部分来源于胃部, 在胃部合成后会释放入胃腔, 其中占比1%左右的PG会从胃黏膜毛细血管渗入到血液中进行循环, 因而, 血清PG水平能够对胃黏膜功能作出准确反映, 可发挥出“血清学活检”的效用[5, 6]。在胃癌发生发展进程中因PG分泌细胞受到影响, 会导致血清中PG水平发生较大变化。
相关研究指出[7], 2/3左右的胃癌患者会伴有严重程度不一的胃黏膜萎缩症状, 因此, 肠上皮异常增生致使出现大量胃底腺丧失情况, 同时血清PGⅠ水平会随之出现明显下降, 而PGⅡ分泌细胞的分布较广泛, 故PGR亦会出现明显下降的情况。本次研究结果显示, 胃溃疡组的PGⅠ、PGⅡ水平均明显高于浅表性胃炎组、萎缩性胃炎组、胃癌组、对照组, 差异具有统计学意义(P<0.05);萎缩性胃炎组、胃癌组的PGⅠ、PGR水平均低于对照组, PGⅡ水平明显高于对照组, 差异具有统计学意义(P<0.05);浅表性胃炎组的PGⅠ、PGR水平均高于萎缩性胃炎组和胃癌组, PGⅡ水平低于胃癌组, 差异具有统计学意义(P<0.05);萎缩性胃炎组的PGR高于胃癌组, 胃溃疡组PGR水平高于萎缩性胃炎组和胃癌组, 差异具有统计学意义(P<0.05)。胃溃疡组的血清Hp抗体阳性率最高, 其次依次为萎缩性胃炎组、胃癌组、浅表性胃炎组;胃溃疡组的血清Hp抗体阳性率76.67%高于对照组的40.00%, 差异具有统计学意义(P<0.05);萎缩性胃炎组、胃癌组、浅表性胃炎组与对照组Hp抗体阳性率比较差异均无统计学意义(P>0.05)。Hp抗体阳性组PGⅠ、PGⅡ水平均低于Hp抗体阴性组, 但比较差异无统计学意义(P>0.05);Hp抗体阳性组PGR(5.17±1.02)明显低于Hp抗体阴性组(7.42±1.98), 差异具有统计学意义(P<0.05)。分析原因可能是胃黏膜出现癌变后癌细胞中PG因受致癌因子影响而出现基因突变、受损, 从而丧失PGⅠ分泌能力[8]。与此同时, 基因突变的细胞对原来的黏膜腺细胞进行替换更新, 导致PGⅡ分泌水平出现持续降低的情况, 但PGⅡ可来源于多种腺体, 因此, 胃癌组患者的PGⅠ、PGR水平存在明显降低现象。此外, Hp感染不仅会诱发消化道炎症及溃疡, 也会对PG合成产生一定影响, Hp感染往往会累及泌酸腺, 进而致使胃内pH值有所上升, 并对PG转化为胃蛋白酶产生干扰, PG水平随之上升, PGR水平则随之降低, 是诱发胃癌的高危风险因素。
综上所述, PG和Hp抗体水平变化是评估胃癌及癌前病变的关键指标, PGⅠ、PGR水平明显降低可提示胃癌患病风险增大, 可作为胃癌早期筛查的血清学指标, 同时PGR水平变化受Hp感染的影响较大。
参考文献
[1] 颜卫荣, 林艳, 马玲敏, 等. 血清胃蛋白酶原联合幽门螺旋杆菌IgG抗体检测在胃癌早期诊断中的应用价值. 中国卫生检验杂志, 2019, 29(11):1321-1323.
[2] 许园园, 赵健晢. 血清胃蛋白酶原、幽门螺杆菌IgG抗体在胃癌及癌前病变筛查中的临床研究. 中国初级卫生保健, 2018, 32(7):93-95.
[3] 李俊. 血清幽门螺杆菌抗体、胃蛋白酶原、胃泌素-17检测. 中国肿瘤, 2019, 28(8):629-635.
[4] 唐森森, 王志勇. 血清胃蛋白酶原、胃泌素17和抗幽门螺桿菌免疫球蛋白G对胃癌高危人群的筛查价值. 中华消化杂志, 2019, 39(11):768-771.
[5] 颜海帆, 夏晨梅, 陈玲玲, 等. 血清胃蛋白酶原、幽门螺杆菌抗体联合检测对胃癌及癌前病变的早期预测价值. 中国医师杂志, 2017, 19(5):767-769.
[6] 刘刚, 赵民学, 王德盛. 血清胃蛋白酶原、胃泌素17和幽门螺杆菌抗体检测在胃癌筛查中的应用. 吉林大学学报(医学版), 2017, 43(6):1182-1185.
[7] 万小勇, 张国新. 血清胃蛋白酶原、幽门螺旋杆菌IgG抗体联合醋酸-靛胭脂染色放大内镜在胃癌早期诊断中的应用. 中国临床研究, 2017(30):1498-1498.
[8] 黄钱珍. 血清胃蛋白酶原及幽门螺杆菌抗体在胃癌早期诊断中的意义临床分析. 系统医学, 2017, 2(1):92-95.
[收稿日期:2020-05-22]

