丙硫菌唑在不同类型土壤中的降解特性
董 旭,孙明娜,褚 玥,童 舟,王 梅,段劲生,高同春
(安徽省农业科学院植物保护与农产品质量安全研究所/农业农村部农产品质量安全风险评估实验室(合肥),合肥 230031)
丙硫菌唑(prothioconazole),其分子式为C14H15Cl2N3OS(图1(a)),化学名称为(RS)-2-[2-(1-氯环丙基)-3-(2-氯苯基)-2-羟基丙基]-2,4-二氢-1,2,4-三唑-3-硫酮,是一种新型三唑类广谱杀菌剂,由拜耳作物科学公司(德国)研发生产。自2004年始,先后在德国、英国、澳大利亚、法国、美国、加拿大等国取得登记,于2018年12月在我国获准登记。丙硫菌唑作为一种高效广谱杀菌剂,主要用于防治谷类、麦类、豆类等由担子真菌、子囊菌、半知菌等真菌引起病害的作物,其作用机理是通过抑制真菌甾醇前体,导致真菌细胞膜功能、形态等发生变化[1-4]。相对于传统杀菌剂,丙硫菌唑不仅有良好的内吸活性,而且持效期长,另外具有较高的防病效果。通过对丙硫菌唑的苯环和三唑环C14标记研究发现,在室外环境中施药后丙硫菌唑在作物和土壤中受光照、温度、湿度、pH、微生物等因子影响,快速脱硫代谢为脱硫丙硫菌唑[5](图1(b))。目前,与丙硫菌唑相关研究报道多为其在土壤、水果、蔬菜、小麦、动物源产品等中的残留情况,其相关的室内土壤降解研究未见报道[6-8]。
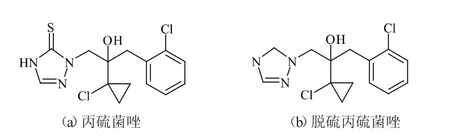
图1 丙硫菌唑和脱硫丙硫菌唑结构式
目前我国农药有效利用率约为30%,大部分农药通过各种形式最终进入土壤、地下水等环境介质。农药进入环境介质后在微生物、光照、温度等条件影响下发生降解、移动等行为,因此,判断某种农药对生态环境是否安全,可以通过其在土壤中的降解特性进行评价[9]。农药在土壤中的降解特性除了与化合物本身的理化性质有关外,还与土壤的pH值、土壤类型、土壤有机质含量、土壤微生物量等环境因子密切相关。笔者在实验室条件下研究了不同类型土壤中丙硫菌唑的降解特征,并研究了好氧、厌氧、模拟水稻田条件对其降解速率的影响,旨在为其环境安全性评价提供参考[10-12]。
1 材料与方法
1.1 主要试剂及仪器
97.0%丙硫菌唑标准品和99.5%脱硫丙硫菌唑标准品,德国Dr.EhrenstorferGmbh公司;无水硫酸钠(分析纯)、氯化钠(分析纯),甲醇、乙腈(色谱级)、Carb/NH2固相萃取小柱(Carb 300 mg/NH2,500 mg/6 mL),美国安捷伦科技有限公司。
LC-MS-8030超高效液相色谱串联质谱仪,日本岛津公司;Milli-Q Direct 8超纯水机,德国默克密理博公司;Y-4恒温振荡器,江苏金坛金城国胜试验仪器厂;R-100旋转浓缩蒸发器,瑞士步琦仪器设备有限公司;390HE电子天平,瑞士普利赛斯公司。
1.2 供试土壤
分别从安徽、江西和吉林采集有代表性的耕作层土壤(安徽选择水稻土、江西选择红土、吉林选择黑土),采集后阴干除去土壤中残留的根系、石块等杂质,再粉碎、阴干、过筛(2 mm),保存于2~4℃避光环境中备用,保存期为6个月。土壤理化性质见表1。

表1 土壤理化性质
1.3 检测方法
色谱柱:Shim-pack XR-ODS-Ⅲ,2.0 mm×50 mm,1.6 μm;流动相A:5 mmol/L乙酸铵+0.02%甲酸(体积比)的水溶液,流动相B:乙腈;柱温40℃;流速0.3 mL/min;进样量5 μL。梯度洗脱:初始B相15%;0~1.5 min,B相15%~95%;1.5~3.0 min,B相保持95%;3.1 min,B相降为15%;3.1~5.0 min,B相保持15%。
离子源:ESI(±);接口电压:+4.5 kV;雾化气:氮气3.0 L/min;干燥气:15 L/min;碰撞气:氩气,230 Ka;脱溶剂管温度:250℃;加热模块温度:450℃;丙硫菌唑及其脱硫丙硫菌唑质谱优化参数见表2。
1.4 土壤前处理方法
取样冻干,称取冻干土壤样品20 g于锥形瓶中,加入乙腈和水(V∶V=40∶10)混合溶液50 mL,放入恒温振荡器中,室温下(25℃)振荡提取40 min;取出加入4~5 g氯化钠后继续在室温下振摇5 min,将提取液全部过滤转移至50 mL离心管中,4 500 r/min下离心3 min,室温静置20 min;取上清液2 mL至装有100 mg无水MgSO4及100 mg PSA吸附剂的10 mL离心管中,3 000 r/min涡旋1~2 min,取出放入离心机中,于5 500 r/min下离心5 min;过0.22 m滤膜,待测。

表2 丙硫菌唑及其脱硫丙硫菌唑质谱优化参数
1.5 丙硫菌唑及脱硫丙硫菌唑标准溶液配制及标准曲线绘制
准确称取97%丙硫菌唑标准品、99.5%脱硫丙硫菌唑标准品,用色谱乙腈做溶剂,配制供试物标准品储备液,保存于-20℃避光环境。试验前用色谱乙腈稀释1组5.0~0.005 μg/mL的系列混合标准品溶液,按照1.3检测方法进行测定,绘制标准曲线。
1.6 丙硫菌唑及脱硫丙硫菌唑添加回收试验
选择空白安徽水稻土、江西红土和吉林黑土,分别添加丙硫菌唑和脱硫丙硫菌唑标液,试验设3个添加5次重复,按1.4的处理方法和1.3的检测方法分析,分别计算丙硫菌唑、脱硫丙硫菌唑回收率和相对标准偏差(RSD)。
1.7 试验方法
1.7.1 土壤预培养(好氧及厌氧实验)
室温下(25±2℃)称取适量3种试验用土壤样品,在好氧及厌氧条件试验中均不少于2 kg,均匀喷入超纯水,润湿后混匀,加水至土壤饱和持水量的40%,置恒温培养箱中鼓风,避光培养14 d(记录温度范围24.7~25.2℃)。为保持初始持水状态,预培养过程中需及时补水。
1.7.2 供试物水溶液配制
取10 000 μg/mL的丙硫菌唑标准储备液,用超纯水稀释成1 000 μg/mL水溶液,于2~4℃避光环境中保存。
1.7.3 好氧降解试验
分别称取安徽水稻土、江西红土和吉林黑土各20 g(精确到0.01 g)于250 mL棕色瓶中,取配置好的丙硫菌唑水溶液,均匀滴加200 μg至土壤表面,待水分挥发后,涡旋混匀,使丙硫菌唑均匀分布土壤中,此时其初始质量比为10 μg/g。调节土壤饱和持水量至60%,硅胶塞(带砂芯)盖上瓶口,置于恒温培养箱(25℃)中鼓风避光培养1个丙硫菌好氧半衰期(记录温度范围24.1~25.3℃)。实验设置2个重复,上述条件下分别培养0、2、4、6、8、16 h,1、2、3、4、5、7、10、14、21、30、45、60、90 d。选择另一恒温培养箱,设置空白对照样品。取样后及时测定,或将样品置于-20℃下避光保存。
1.7.4 厌氧降解试验
分别称取安徽水稻土、江西红土和吉林黑土各20 g(精确到0.01 g)于250 mL棕色瓶中,取配置好的丙硫菌唑水溶液,均匀滴加200 μg至土壤表面,待水分挥发后,涡旋混匀,使丙硫菌唑均匀分布土壤中,此时其初始质量比为10 μg/g。调节其土壤饱和持水量至60%,硅胶塞(带砂芯)盖上瓶口,置于恒温培养箱(25℃)中鼓风避光培养1个丙硫菌唑好氧半衰期(记录温度范围24.7~25.6℃);取出后加超纯水至液面约1~3 cm后通入氮气,恒温恒湿(温度25℃、相对湿度60%),避光培养(记录温度范围24.8~25.2℃、相对湿度范围59%~62%)。实验设置2个重复,上述条件下分别培养0、2、4、6、8、16 h,1、2、3、4、5、7、10、14、21、30、45、60、90 d。选择另一恒温培养箱,设置空白对照样品。取样后及时测定,或将样品置于-20℃下避光保存。
1.7.5 水稻田厌氧降解试验
室温下(25±2℃)分别称取安徽水稻土、江西红土和吉林黑土各50 g(精确到0.01 g)于250 mL棕色瓶中,加超纯水至土壤表面积存0.5~1.0 cm,放入通氮系统,设置恒温恒湿培养箱温度25℃,相对湿度60%,避光培养14 d(记录温度范围24.2~25.7℃、相对湿度范围58%~61%)。用移液器向土层中均匀加入500 μg丙硫菌唑,于恒温恒湿培养箱中继续培养(记录温度范围24.9~25.6℃、相对湿度范围59%~61%)。实验设置2个重复,上述条件下分别培养0、2、6 h,1、3、5、7、14、21、30、45、60、90、120 d。选择另一恒温培养箱,设置空白对照样品。取样后及时测定,或将样品置于-20℃下避光保存。
1.8 数据处理
1.8.1 丙硫菌唑残留
丙硫菌唑室内土壤降解实验在恒温避光条件下进行,为保证实验的准确性,其残留量总量按式(1)计算:

式中:C为丙硫菌唑残留总量;Ca、Cb分别为丙硫菌唑、脱硫丙硫菌唑的残留量;R为母体分子量与代谢物分子量比值,取R=1.102 7。
设丙硫菌唑和代谢产物脱硫丙硫菌唑的检测限分别为La、Lb,丙硫菌唑残留总量计算分以下4种情况:
(1)若Ca≥La,Cb≥Lb,则C=Ca+1.102 7 Cb;
(2)若Ca<La,Cb≥Lb,则C=La+1.102 7 Cb;
(3)若Ca≥La,Cb<Lb,则C=Ca+1.102 7 Cb·Lb;
(4)若Ca<La,Cb<Lb,则C=0。
1.8.2 半衰期计算土壤中丙硫菌唑的降解按一级动力学方程ct=c0e-kt进行拟合,降解半衰期按t1/2=ln2/k计算。
1.9 土壤降解等级划分
丙硫菌唑在土壤中的降解特性等级参照GB T 31270.1—2014《化学农药环境安全评价试验准则》[13]进行划分。
2 结果与分析
2.1 方法的线性范围、准确度及精密度
丙硫菌唑及脱硫丙硫菌唑在0.005~5 μg/mL范围内,峰面积与质量浓度间线性关系均良好。线性方程:①丙硫菌唑,y=330 826.249 3 x+42 861.959 3,r=0.997;②脱硫丙硫菌唑,y=1 181 676.611 3 x+192 452.531 3,r=0.996,添加水平在0.08~10 μg/g范围内。丙硫菌唑在3种土壤中的平均回收率为83.6%~104%,相对标准偏差为0.40%~5.86%;脱硫丙硫菌唑在3种土壤中的平均回收率为80.1%~98.4%,相对标准偏差为0.21%~9.56%。丙硫菌唑及脱硫丙硫菌唑在3种土壤中的最低检出量均为0.08 μg/g,丙硫菌唑、脱硫丙硫菌唑的最低检出限均为2.5×10-11g。仪器对丙硫菌唑的最低检出限为1×10-11g,脱硫丙硫菌唑为5×10-12g(以3倍信噪比计算),满足残留试验准则要求[14]。结果见表3、表4。
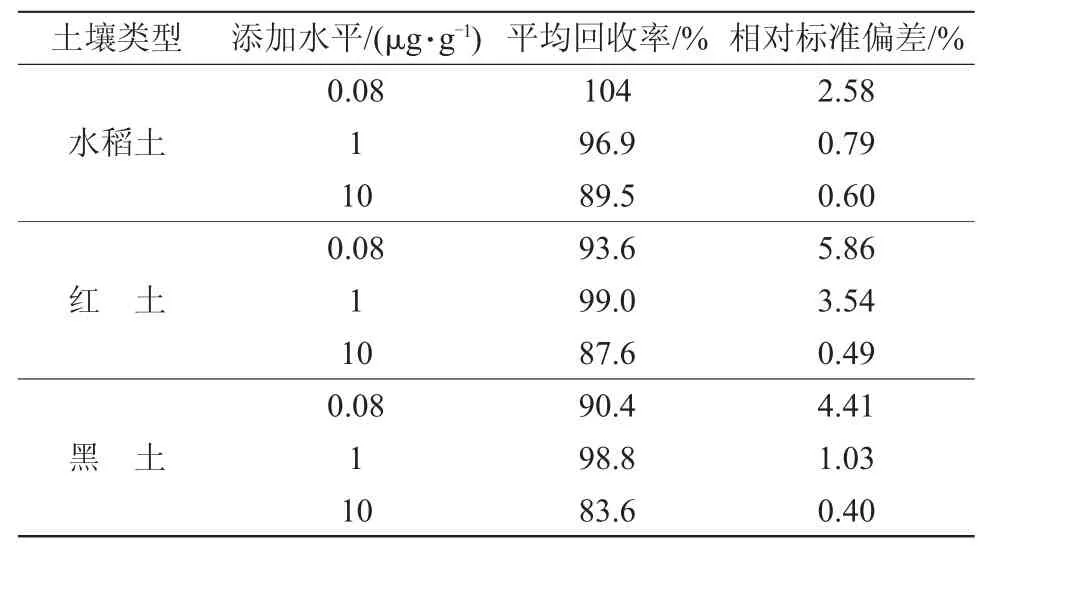
表3 丙硫菌唑的添加回收率及相对标准偏差(n=5)
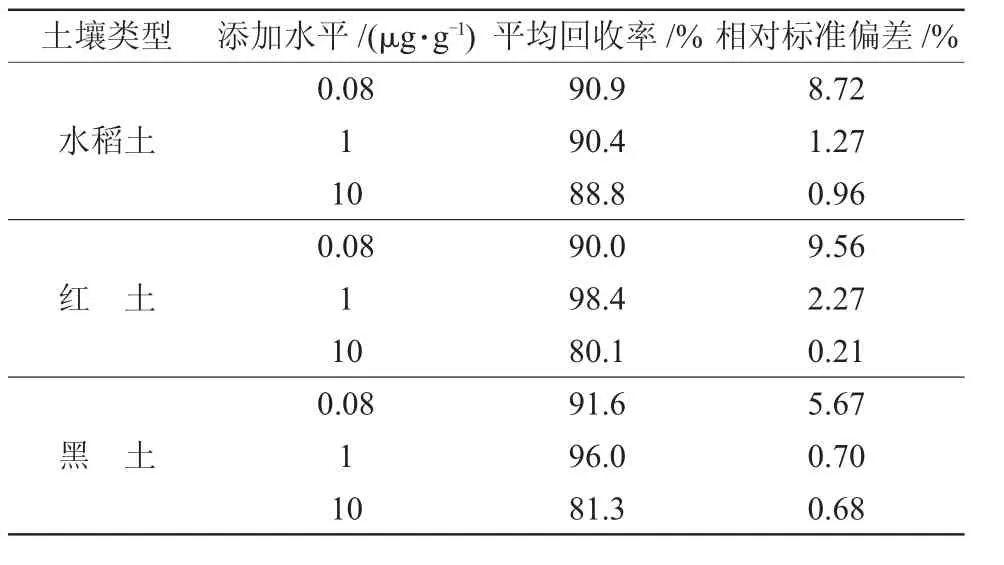
表4 脱硫丙硫菌唑的添加回收率及相对标准偏差(n=5)
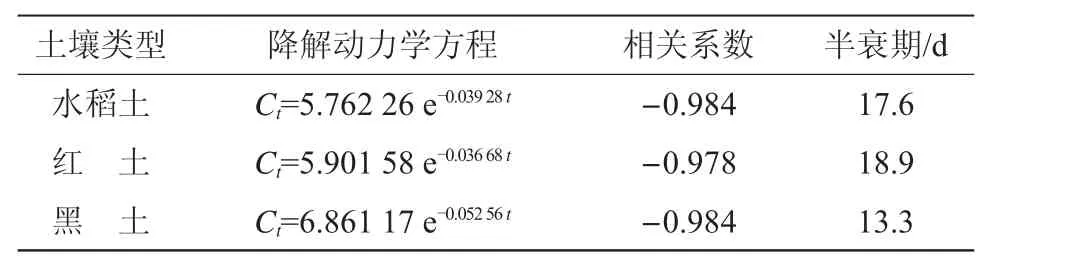
表5 丙硫菌唑好氧降解参数
2.2 好氧条件降解特性
丙硫菌唑在土壤中降解半衰期由小到大依次为黑土(13.3 d)、水稻土(17.6 d)、红土(18.9 d)(表5)。试验中3种供试土壤的pH值、有机质及黏粒含量均不相同。在本实验条件下,降解半衰期随土壤有机质及黏粒含量增加而缩短(图3),降解动态曲线符合一级动力学方程。
施用丙硫菌唑后很快形成脱硫代谢产物脱硫丙硫菌唑,通过母体苯环C14标记发现,其经化学或生物作用逐步分解,最后在土壤中矿化生成二氧化碳,并被植物吸收后进入自然循环状态[15]。与自然环境相比,室内土壤降解试验主要与土壤本身的有机质含量、pH值及粒径分布等因子有关[16]。高有机质含量的土壤利于微生物生长繁殖,丰富的微生物数量和种群加速农药在土壤中的降解(图2、图3)[17]。

图2 丙硫菌唑好氧降解曲线
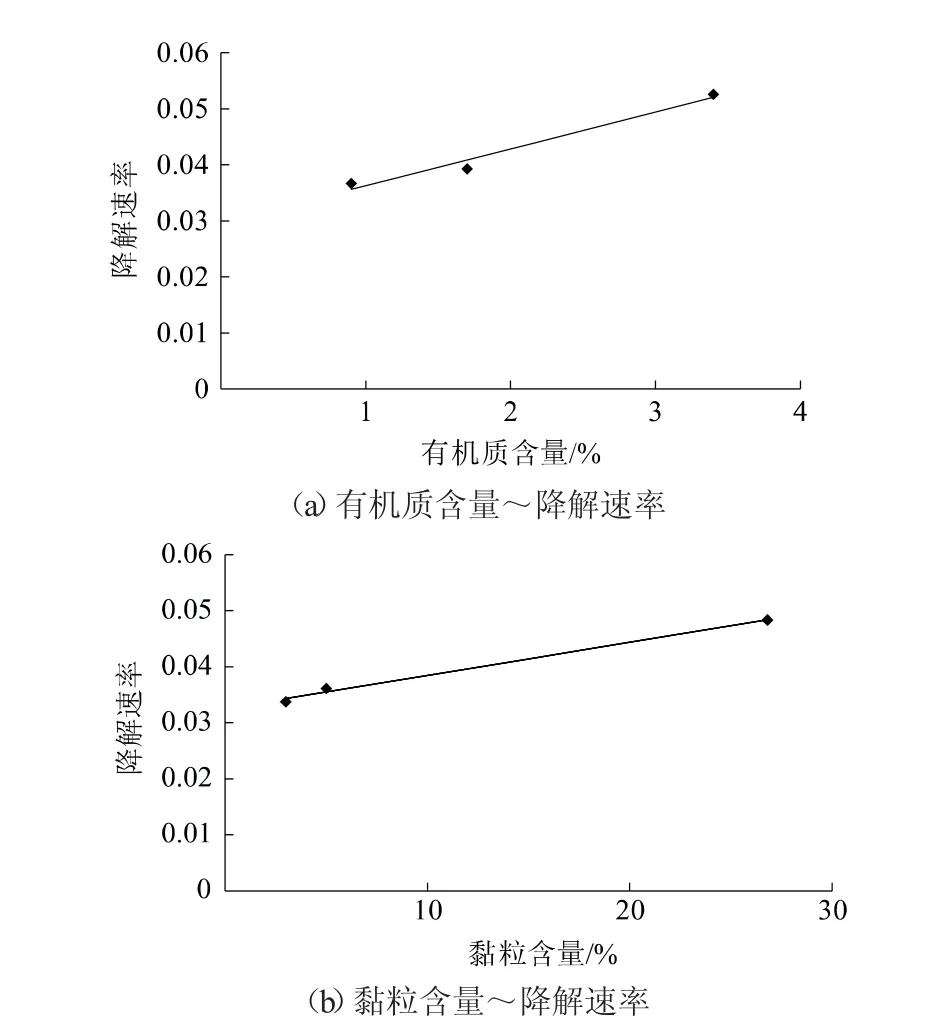
图3 好氧条件下丙硫菌唑降解速率随有机质含量和黏粒含量的变化趋势
2.3 厌氧条件降解特性
厌氧条件下丙硫菌唑降解速率低于好氧条件,降解半衰期由小到大依次为黑土(30.3 d)、水稻土(41.5 d)、红土(53.1 d)(表6)。
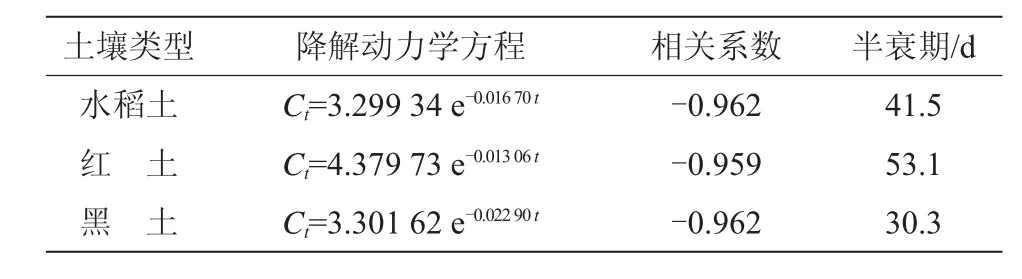
表6 丙硫菌唑厌氧降解参数
厌氧实验先经过氧培,这一阶段土壤中好氧微生物的生物活性没有改变,而后加水至1~3 cm高,并通入氮气使实验系统处于厌氧环境,此时土壤表面积水、氧气交换能力减弱,持续通入的氮气使得土层和水层含氧量逐渐降低,抑制了好氧微生物的活性,因此与好氧条件相比,丙硫菌唑在3种土壤中的半衰期均有不同程度的延长,但降解半衰期也是随土壤有机质及黏粒含量增加呈缩短趋势(图4、图5)[18-19]。
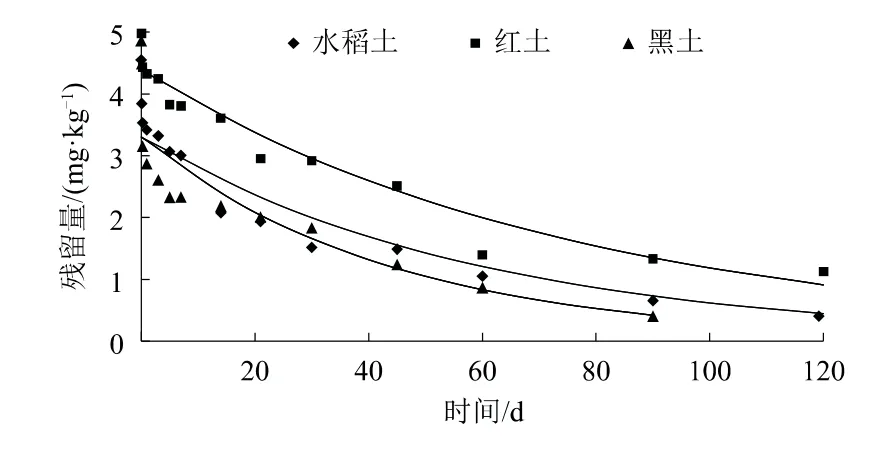
图4 丙硫菌唑厌氧降解曲线
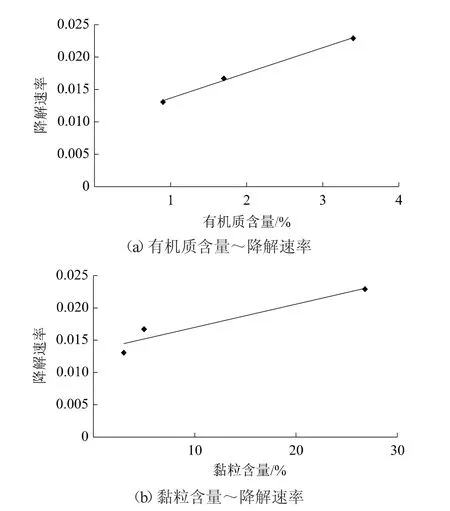
图5 厌氧条件下丙硫菌唑降解速率随有机质含量和黏粒含量的变化趋势
2.4 水稻田厌氧降解特性
与好氧及厌氧条件相比,丙硫菌唑降解半衰期均有所延长,降解半衰期从小到大依次为黑土(32.2 d)、水稻土(45.3 d)、红土(54.7 d)(表7)。
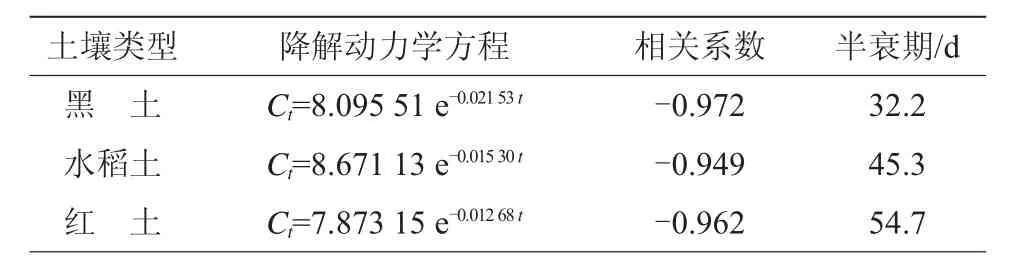
表7 丙硫菌唑水稻田厌氧降解参数
土壤降解主要以微生物降解和水解为主,积水厌氧条件下,不断通入的氮气逐渐降低系统中氧气的含量,抑制了土壤中好氧微生物的活性,降低了微生物对农药的降解能力,丙硫菌唑的降解半衰期得到不同程度的延长[17-19]。积水厌氧条件下,3种供试土壤的有机质含量、pH值及粒径等存在差异,使得丙硫菌唑降解速率有所不同。此时,土壤pH值对农药的水解作用也有一定的影响,但降解半衰期亦随土壤有机质及黏粒含量增加呈缩短趋势(图6、图7)。
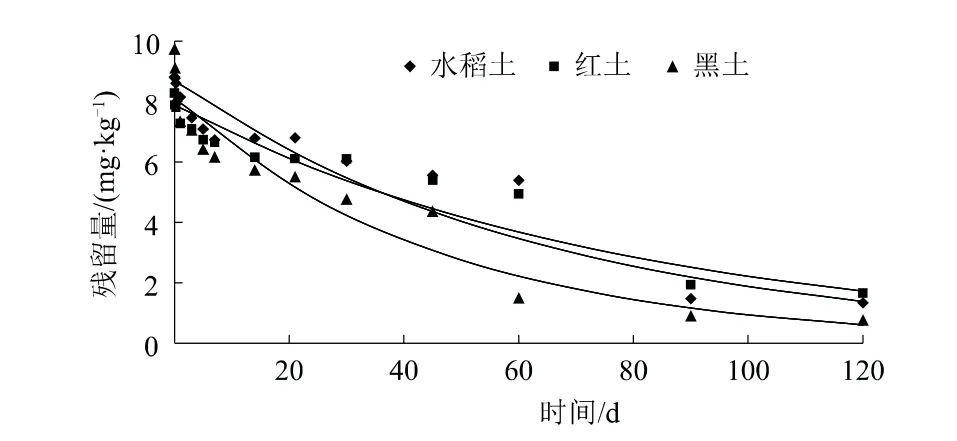
图6 丙硫菌唑水稻田厌氧降解曲线
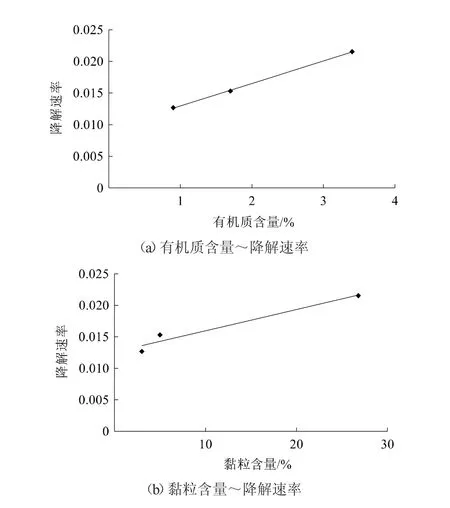
图7 水稻田厌氧条件下丙硫菌唑降解速率随有机质含量和黏粒含量的变化趋势
3 结 论
研究表明,本实验条件下,在安徽水稻土、江西红土和吉林黑土中丙硫菌唑总残留量均随培养时间延长而降低。在好氧、厌氧及水稻田厌氧3种条件下,半衰期为13.3~54.7 d。在吉林黑土中丙硫菌唑降解最快,在江西红土中降解最慢,降解速率与土壤有机质及黏粒含量呈正相关性。
结果表明,好氧条件下丙硫菌唑在安徽水稻土、江西红土、吉林黑土中均属易降解;厌氧条件下其在安徽水稻土、江西红土、吉林黑土均属中等降解;水稻田厌氧条件下其在安徽水稻土、江西红土、吉林黑土也均属中等降解。

