UPLC-MS/MS检测甘蓝中甲氨基阿维菌素苯甲酸盐和除虫脲残留和消解
吴 迟,欧阳小庆,才 冰,汤从峰,王长宾,何明远
(北京依科世福科技有限公司,北京 101102)
甘蓝(Brassica oleracea L.)又名卷心菜、洋白菜等,富含蛋白质、糖类、微量元素以及维生素等营养物质,是世界公认的保健蔬菜之一[1]。菜青虫是危害甘蓝的一种重要害虫,幼虫取食叶肉不仅形成虫洞,而且伤口易诱发软腐病,严重影响甘蓝的产量与品质[2-3]。目前,对菜青虫的防治主要依赖于高毒化学农药,杨海珍等[4]进行田间药效试验发现1%甲氨基阿维菌素苯甲酸盐(以下简称甲维盐)乳油对甘蓝菜青虫病防效好,王旭民等[5]发现25%除虫脲可湿性粉剂对甘蓝菜青虫具有持效性,通常采用叶面直接喷雾防治菜青虫,为保证甘蓝的食用安全性,开展甲维盐和除虫脲在甘蓝中的残留和消解动态研究具有重要意义。
甲维盐的结构式见图1,其是一种超高效绿色杀虫剂,通过作用于昆虫神经元突触或神经肌肉突触,阻断神经冲动传导而使昆虫麻痹、拒食、死亡[6]。除虫脲是苯甲酸基苯基脲类杀虫剂,具有胃毒和触杀作用[7],其结构式见图1。除虫脲主要抑制昆虫几丁质合成酶的合成,从而抑制幼虫、卵、蛹表皮几丁质的合成,使昆虫不能正常蜕皮、化蛹、羽化和产卵,从而影响害虫的整个世代[8]。目前甲维盐和除虫脲的残留检测方法主要包括高效液相色谱-荧光法(HPLC-FLD)[9]、液相色谱-质谱法(LC-MS)[10]、气相色谱法(GC)[11]等,前处理大多采用液液萃取[9]、固相萃取[11]、QuEChERS[12]法。其中QuEChERS前处理方法结合UPLC-MS/MS,灵敏度高,重复性好,已有研究报道除虫脲在荔枝[13]、苹果[14]、棉叶[15]中的残留与消解,但有关除虫脲在甘蓝中的残留与消解未见报道。
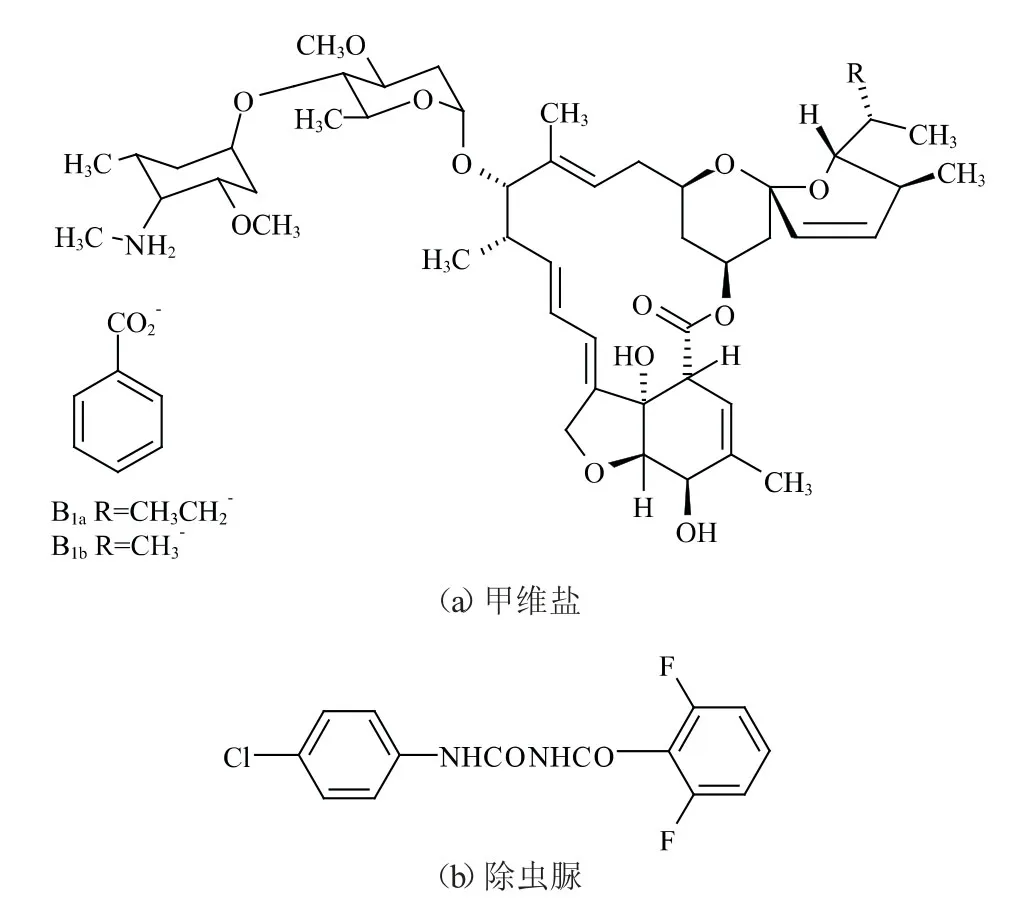
图1 甲维盐和除虫脲的结构式
目前,我国规定甲维盐在甘蓝上的最大残留量(Maximum Residue Limit, MRL)为0.1 mg/kg,除虫脲在甘蓝上的MRL值为2 mg/kg[16]。为评价甲维盐和除虫脲在甘蓝上的残留水平及消解动态,笔者开展了甲维盐和除虫脲在甘蓝上的田间消解动态研究,并建立UPLC-MS/MS快速检测甲维盐和除虫脲在甘蓝中的残留分析方法,为这2种药剂的安全使用及安全食用甘蓝提供依据。
1 材料与方法
1.1 田间试验设计
参照NY/T788—2018《农作物中农药残留试验准则》[17]于2019年5—10月分别在湖南张家界、云南昆明、江苏句容、贵州贵阳4个试验点进行10%甲维·除虫脲悬浮剂在甘蓝中的残留消解动态试验。每个试验点设1个处理小区和1个对照小区,每小区面积不小于50 m2,小区设置在相邻区域,设置隔离行,避免污染。处理小区施药2次,于甘蓝小菜蛾低龄幼虫盛发期2次喷雾施药,施药间隔10 d,施药制剂量为750 g/hm2(3.75 g/50 m2),末次施药2 h,1、3、7、10 d后分别采集样本,切成1~2 cm大小的碎块,混匀后,四分法缩分,取2份样本,每份样本150 g左右,分别装入可封口的样品袋中,在低于-18℃条件下保存。
1.2 仪器和试剂
Waters Xevo TQD超高压液相色谱质谱联用仪、色谱柱:ACQUITY UPLCBEH C1(82.1 mm×50 mm,1.7 μm),沃特世科技上海有限公司;MS105分析天平,梅特勒-托利多仪器上海有限公司;YP502N电子天平,上海菁海仪器有限公司;KQ-500DE数控超声波清洗器,昆山市超声仪器有限公司;Eppendorf移液器、TG-18台式高速离心机,四川蜀科仪器有限公司;0.22 μm微孔滤膜,天津博纳艾杰尔公司;UMV-2多管旋涡混合器,北京优晟联合科技有限公司。1 mL注射器,无锡市宇寿医疗器械有限公司。
甲维盐标准品(纯度甲维盐B1a:95.2%;甲维盐B1b:3.1%)、除虫脲标准品(纯度99.3%),北京勤诚亦信科技开发有限公司;N-丙基乙二胺(PSA),天津博纳艾杰尔公司;乙腈、甲酸(色谱纯,分析纯),赛默飞世尔科技有限公司;氯化钠(分析纯),国药集团化学试剂有限公司;10%甲维·除虫脲悬浮剂,北京依科世福科技有限公司。
1.3 分析方法
1.3.1 检测条件
质谱条件:电喷雾离子源,正离子电离模式(ESI+);毛细管电压为3.70 kV,离子源温度为150℃,去溶剂温度为500℃,去溶剂气(N2)流量为1 000 L/Hr,锥孔反吹气(N2)流量为0 L/Hr。采用多重反应监测(MRM),以保留时间和离子对(母离子和2个子离子)信息比较进行定性分析,以母离子和响应值最高的子离子进行定量分析。具体质谱参数见表2。

表1 梯度洗脱条件
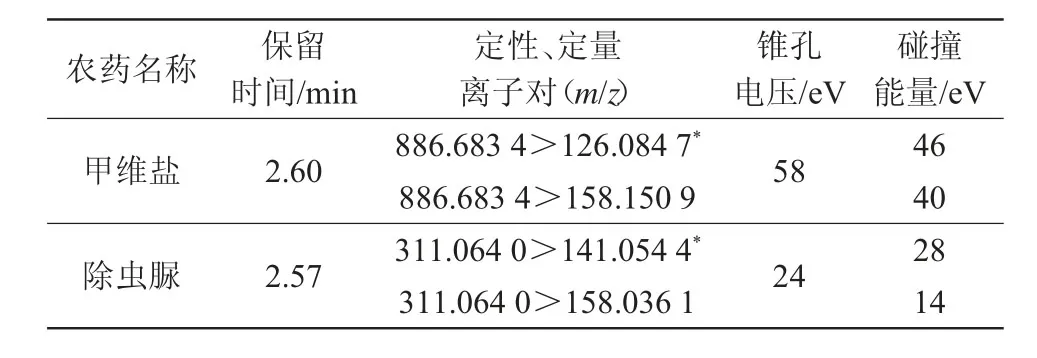
表2 多重反应检测(MRM)质谱参数
1.3.2 样品前处理
准确称取10.00(±0.05)g甘蓝于50 mL离心管中,加入10 mL去离子水,10 mL乙腈,混匀,超声提取15 min,然后向离心管中加入5 g NaCl,2 400 r/min涡旋2 min,再4 000 r/min离心5min,移取上清液1.500 mL于装有50 mg PSA的离心管中,2 400 r/min涡旋2 min,10 000 r/min离心2 min,取上清液过0.22 μm微膜过滤,待测。
1.3.3 标准曲线配制及基质标准曲线绘制
用电子天平分别准确称取甲维盐标准品0.010 52 g,除虫脲标准品0.010 12 g,分别用乙腈定容至10.0 mL,配制成质量浓度为1 000 mg/L的标准储备液,用乙腈作溶剂,将标准储备液稀释成质量浓 度 分 别 为0.01、0.02、0.03、0.10、0.20、0.50、1.00、2.00、5.00 mg/L的甲维盐、除虫脲的混合标准溶液,单独配制质量浓度为20.0 mg/L的除虫脲标准溶液,现用现配。
分别采用甘蓝基质空白提取液作溶剂,将标准溶液稀释10倍,得到质量浓度分别为0.001、0.002、0.005、0.01、0.02、0.05、0.10、0.20、0.50 mg/L的甲维盐、除虫脲混合基质标准溶液及2.00 mg/L的除虫脲基质标准溶液,现配现用。按1.3.1条件进行检测,分别以甲维盐和除虫脲的质量浓度为横坐标、相应的峰面积为纵坐标作图,绘制标准曲线。
1.3.4 添加回收试验
在空白甘蓝中添加3个水平浓度甲维盐、除虫脲标准溶液,甲维盐添加水平分别为0.001、0.10、1.00 mg/kg,除虫脲添加水平分别为0.002、0.20、2.00 mg/kg,每个水平重复5次。甲维盐添加水平为1.00 mg/kg的提取液及除虫脲添加水平为2.00mg/kg的提取液经甘蓝空白基质溶液10倍稀释后进样检测。按1.3.1条件进行检测,计算添加回收率及相对标准偏差(RSD)。
1.3.5 数据处理
甲维盐和除虫脲在甘蓝中的残留量随时间变化,可用一级动力学方程式(1)表示。

式中:Ct为时间t时的农药残留量,mg/kg;C0为施药后的原始沉积量,mg/kg;k为消解系数;t为施药后时间,d。
通过式(1)得到消解系数k,再通过式(2)即可计算消解半衰期T1/2。

2 结果与分析
2.1 检测条件优化
为了获得甲维盐、除虫脲多反应监测参数,采用在质谱直接进标准品(100 μg/L)的方式,在100~500 m/z范围内扫描,对正离子电离(ESI+)和负离子电离(ESI-)同时进行监测。结果表明,在ESI+模式下,甲维盐和除虫脲具有明显的特征离子峰[M+H]。再调整合适的锥孔电压选定母离子,调节碰撞能量,进一步获得定量和定性离子及相应的碰撞能量,最终优化条件如1.3.1所述。进一步优化色谱条件,最终采用乙腈+0.01%甲酸水溶液体系为流动相,在所设梯度洗脱条件下得到较好的灵敏度、重现性及峰形(图2)。

图2 甲维盐和除虫脲标准品色谱图
2.2 方法的线性范围、准确度和精密度
基质匹配外标法定量分析在0.001~2 mg/L的质量浓度范围内,甲维盐和除虫脲的峰面积(y)与其质量浓度(x)呈现良好的线性关系。其回归方程分别是:y=2 133 344.295 2 x+5 143.362 9,r=0.999 8(甲维盐);y=124 538.882 2 x+2 240.770 8,r=0.998 6(除虫脲)。在0.001、0.10和1.00 mg/kg添加水平下,甲维盐在甘蓝中的平均回收率在99.1%~105%,RSD值为3.02%~8.70%;在0.002、0.20和2.00 mg/kg添加水平下,除虫脲在甘蓝中的平均回收率在97.2%~101%,RSD值为4.03%~6.96%(表3)。甲维盐和除虫脲的LOQ值分别为0.001、0.002 mg/kg,该方法的回收率、准确度、精密度、灵敏度均满足NY/T 788—2018《农作物中农药残留试验准则》[17]的检测要求(回收率在70%~120%,RSD值不大于20%)。
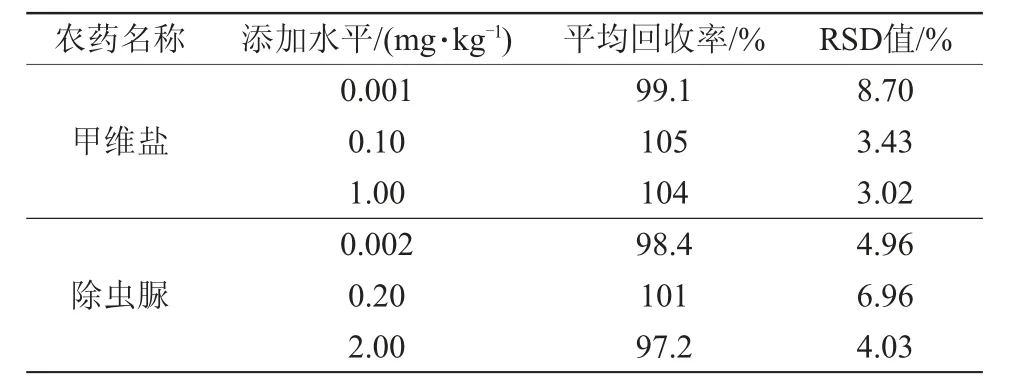
表3 甲维盐和除虫脲在甘蓝中的添加回收率及RSD 值(n=5)
2.3 甲维盐、除虫脲在甘蓝中的消解动态
在4个消解试验点中甲维盐在甘蓝中的平均原始沉积量不大于7.06×10-3mg/kg,不符合一级动力学方程,无法拟合降解曲线。湖南张家界试验点中除虫脲在甘蓝中的平均原始沉积量为0.122 mg/kg,检测数据不符合一级动力学方程,无法拟合降解曲线。云南、江苏、贵州3个试验地区除虫脲在甘蓝中的消解动态均符合一级动力学方程回归曲线Ct=C0e-kt(表4),其消解动态见图3。除虫脲在云南、江苏、贵州3个试验地区甘蓝中的消解半衰期分别为2.31、6.08、2.51 d;可见,除虫脲在云南和贵州消解较快,在江苏消解较慢。
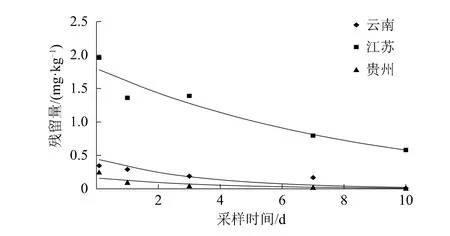
图3 除虫脲在不同地区的消解动态

表4 除虫脲在甘蓝中消解动态
3 结论与讨论
本研究建立了UPLC-MS/MS测定甘蓝中甲维盐和除虫脲的残留分析方法。在0.01~2 mg/L范围内,甲维盐和除虫脲的浓度与色谱峰面积均呈现良好的线性关系;在0.001、0.10和1.00 mg/kg添加水平下,甲维盐在甘蓝中的平均回收率在99.1%~105%,RSD值为3.02%~8.70%;在0.002、0.20和2.00 mg/kg添加水平下,除虫脲在甘蓝中的平均回收率在97.2%~101%,RSD值为4.03%~6.96%。甲维盐和除虫脲的LOQ值分别为0.001、0.002 mg/kg。与Du等[10]建立的HPLC-MS/MS测定甲维盐的方法以及徐娟等[17]建立的HPLC-MS/MS测定除虫脲的方法相比,本研究的定量限更低,灵敏度更高,且该方法快速简便,准确可靠。
据文献[18]报道,除虫脲在萝卜上的消解半衰期为5.87~5.92 d,在荔枝上的消解半衰期为3.5~4.9 d[13],在棉叶中的消解半衰期为5.0~8.6 d[15],在土壤中的消解半衰期为3.8~14 d[15]。本研究中除虫脲在甘蓝上的消解半衰期为2.31~6.08 d。除虫脲在不同作物的消解半衰期差异不大,属于易消解农药。甲维盐在水稻植株、水样和土壤中的消解半衰期分别为1.52~1.61、1.93~2.04和2.01~2.14 d[20];在黄瓜中的消解半衰期为0.1~0.6 d[21];在烟叶中的消解半衰期为2.13 d[22]。甲维盐在不同的基质中消解半衰期均较短,易降解,在本研究中各试验点甲维盐在甘蓝上的原始沉积量不大于7.06×10-3mg/kg。除施药剂量低的原因外,可能还存在消解较快的因素。本研究提供了甲维盐和除虫脲在甘蓝上的残留分析方法以及除虫脲在甘蓝上的消解动态数据,为甲维盐和除虫脲在甘蓝上的安全使用提供数据支持。

