不同细胞唾液酸受体类型及唾液酸转移酶与流感病毒敏感性的研究
常吉祥,杨春光,袁 兵,杨子峰,张云辉*
(1.昆明理工大学医学院,云南 昆明 650504;2.云南省第一人民医院昆明理工大学附属医院,云南 昆明 650032;3.呼吸疾病国家重点实验室呼吸疾病国家临床研究中心/广州医科大学附属第一医院,广东 广州 510120)
流感病毒(Influenza virus)是一种呈杆状或丝状的正粘病毒科(Orthomyxoviridae)病毒,根据病毒感染种属可分为人流感病毒、禽流感病毒(Avian influ⁃enza virus,AIV)、以及猪流感病毒等,其中人流感病毒根据其核蛋白的抗原性分为甲型流感病毒(IAV)和乙型流感病毒等。IAV 可通过人的呼吸道传播引起严重的呼吸疾病;AIV 在家禽与野禽间呈高度接触性传播,也可直接感染人类引起死亡,严重影响畜牧业发展且威胁人类生命安全[1]。
流感病毒表面血凝素(Hemagglutinin,HA)蛋白与宿主呼吸道的唾液酸受体结合可介导病毒的吸附及膜融合过程,是病毒侵入宿主细胞并产生有效复制的前提[2]。唾液酸(Sialic acid,SA)是经唾液酸转移酶(Sialyltransferase,ST)参与调控合成的流感病毒受体决定簇,参与流感病毒感染人类的ST 主要包括Neu5Ac α(2-3)Gal 唾液 酸转 移酶1~4(ST3GAL1~ST3GAL 4)和Neu5Ac α(2-6)Gal 唾液酸转移酶1(ST6GAL1),它们分别将底物CMP-Neu5Ac 中的Neu5Ac 及SA 以α(2-3)和α(2-6)糖苷键的形式转移到半乳糖(Gal)等糖脂或糖蛋白形成受体[3]。ST 调控SA 与Gal 之间糖苷键的连接方式,不同的糖苷键结构可形成底物特异性不同的SA 受体,最终影响SA与流感病毒表面HA 的结合[4-5]。一般认为人类流感病 毒 优 先 结 合α(2-6)唾 液 酸(SAα(2-6)Gal、Neu5Acα(2-6)Gal),而AIV 优先识别α(2-3)唾液酸(SAα(2-3)Gal、Neu5Acα(2-3)Gal)[6],这种流感病毒与受体结合特性可能限定了病毒感染宿主的范围。已有文献报道,H5N1 AIV(A/duck/Guangxi/35/2001(DK/35)株可以同时识别SAα(2-3)Gal 和SAα(2-6)Gal 受体[7];H9N2 AIV 流行株则趋向为结合人源SA 受体SAα(2-6)Gal[8],表明IAV 感染人类的第一步是其HA 受体的亲和性要发生改变。目前未见宿主细胞SA 受体及ST 的表达与流感病毒相关性研究的报道。因此,本研究将人源IAV CA04 株与AIV Y280 株感染9 种细胞,初步探究宿主细胞ST 表达与流感病毒敏感性的相关性,为流感病毒侵入机制研究奠定基础,为抗流感病毒药物研究选择合适的细胞系提供参考依据。
1 材料与方法
1.1 病毒与细胞人源IAV A/California/04/2009/(H1N1)(CA04)株、AIV A/Duck/HongKong/Y280/1997(H9N2)(Y280)株由香港大学MalikPeris 教授惠赠。CA04株在MDCK 细胞中传代,Y280株在10 日龄鸡胚传代后,测定病毒滴度后备用。犬肾细胞(MDCK)、幼仓鼠肾细胞(BHK)、人喉表皮样癌细胞(Hep-2)、人支气管上皮细胞(16HBE)、人非小细胞肺癌细胞(A549)、非洲绿猴肾细胞(Vero)、中国仓鼠卵巢细胞(CHO-k1)、鸡成纤维细胞系(DF-1)和人源胚胎肾细胞(HEK293T)均购自美国标准培养物保存库(ATCC)。
1.2 主要试剂高糖型细胞培养基(DMEM)、胎牛血清(FBS)、青/链霉素购自Gibco 公司;无血清培养基VIVO15 购自Lonza 公司;TPCK 胰酶、牛血清白蛋白(BSA)购自Sigma 公司;新鲜鸡血样品采自活禽市场;FITC 标记的素黑接骨木凝集素(Sambucus Nigra, SNA)、怀 愧 凝 集 素I(Maackiaamurensis,MAA I)购自Vector Laboratories 公司;鼠源抗IAV 核蛋白IgG 抗体、羊抗鼠IgG-FITC 购自ABcam 公司;去唾液酸化BSA、含DAPI 的封片介质购自Thermo Fisher 公司;核酸提取试剂盒购自诺唯赞公司;RTPCR 试剂盒、荧光定量PCR 试剂盒均购自TaKaRa公司。
1.3 流感病毒感染不同细胞后的增殖水平的测定
将MDCK、BHK、HEP-2、16HBE、A549、Vero、CHO-k1、DF-1 和293T 细胞传代至96 孔板。37 ℃5% CO2培养。分别将CA04 株(1×105TCID50/0.1 μL)和Y280 株(1×105TCID50/0.1 μL)用无血清DMEM 培养基10 倍倍比稀释至101~106倍,将6 个稀释度的病毒液以每孔100 μL 分别接种至长成单层上述细胞的96 孔板中,每个稀释度设6 个复孔。48 h 后,每孔取50 μL 上清液于U 型血凝板中与0.5%的鸡红细胞悬液混合,记录每孔凝集度,并采用Reed-Muench法分别计算半数细胞感染剂量(TCID50)。
1.4 SA 受体类型及其与流感病毒结合能力的检测
将1.3 中所述细胞传代至带有爬片的24 孔板中,每种细胞设2 个复孔,待细胞长至50%时,弃去培养基。每种细胞选两孔分别加入100 μL/孔FITC 标记的植物凝集素SNA(特异性结合SAα(2-6)Gal)和MAA I(特异性结合SAα(2-3)Gal)(终浓度5 μg/mL),室温孵育1 h 后,以含有抗荧光淬灭剂的封片液(含有DAPI)封片,经直接免疫荧光法检测各细胞表面受体类型;同上述细胞爬片操作,待细胞长至50%时,每种细胞取2 孔,分别接种MOI 10 的CA04 和Y280 株病毒液,4 ℃孵育90 min,PBS 洗涤后,每孔加500 μL 的4%多聚甲醛固定30 min,每孔加100 μL 鼠源抗IVA 核蛋白IgG(5 μg/mL),4 ℃孵育过夜,每孔加100 μL 羊抗鼠IgG-FITC(5 μg/mL)室温孵育1 h。经间接免疫荧光试验(IFA)检测各细胞表面SA 受体与流感病毒的结合情况。
1.5 细胞表面SA 受体的定量检测将1.3 中所述细胞传代至6 孔板,细胞长至90%时,收集细胞,以1×106个/管分装,4 ℃离心,预冷的PBS 重悬、离心,重复上述步骤3 遍。加3%去唾液酸化BSA,室温封闭1 h,每种细胞分装两管分别加入200 μL FICT 标记的植物凝集素溶液SNA 和MAA I(终浓度分别为5 μg/mL),室温避光孵育30 min。经过预冷的PBS 重悬、离心,重复3 遍后,经流式细胞仪检测FITC 通道的荧光强度。利用FlowJo V10 软件统计分析各组细胞样品的平均荧光强度(MFI)。
1.6 各细胞ST 相关基因mRNA 转录水平的检测
根据GenBank 中登录的不同物种的GAPDH(NM_001357943; NM_001244854; NM_001003142; NM_204305)、ST3GAL4(NR_145671;NM_001246699;XM_014113293;JX035870)和ST6GAL1(NM_173216;XM_015276836;NM_001246815;XM_022414319)基因序列,利用Primer Premier 6.0 软件设计引物(表1),并由北京六合华大基因科技有限公司合成。收集1.3中所述细胞,利用核酸提取试剂盒提取各细胞总RNA,反转录为cDNA,以其为模板,利用表1 中的引物,经荧光定量PCR 检测各细胞中ST3GAL4 和ST6GAL1 基因的mRNA 转录水平。
2 结 果
2.1 各细胞中流感病毒滴度测定的结果两种流感病毒(CA04、Y280 株)感染9 种细胞(MDCK、BHK、Hep-2、16HBE、A549、Vero、CHO-k1、DF-1和293T)48 h 后,检测细胞上清中病毒滴度。结果显示,感染CA04 株 后,MDCK、16HBE、 DF-1 和A549检测到了病毒滴度,分别为3.2×102TCID50/0.1 mL、3.2×101TCID50/0.1 mL、2.6×101TCID50/0.1 mL、0.95×101TCID50/0.1 mL;而AIV Y280 株在9 种细胞中系均有复制,其中病毒滴度从高到低依次为MDCK、DF-1、Vero、293T、CHO-k1、Hep-2、A549、16HBE、和BHK,分别为6.3×103TCID50/0.1 mL、6.3×102TCID50/0.1 mL、3.9×102TCID50/0.1 mL、3.9×102TCID50/0.1 mL、3.2×102TCID50/0.1 mL、3.2×102TCID50/0.1 mL、2.5×102TCID50/0.1 mL、1.9×102TCID50/0.1 mL、9.9×101TCID50/0.1 mL(图1)。表明人流感病毒CA04 株仅在MDCK、DF-1、16HBE 和A549 细胞中有一定的复制能力;AIV Y280株在MDCK 细胞中的复制能力最强,而在其余细胞中的复制能力相近。
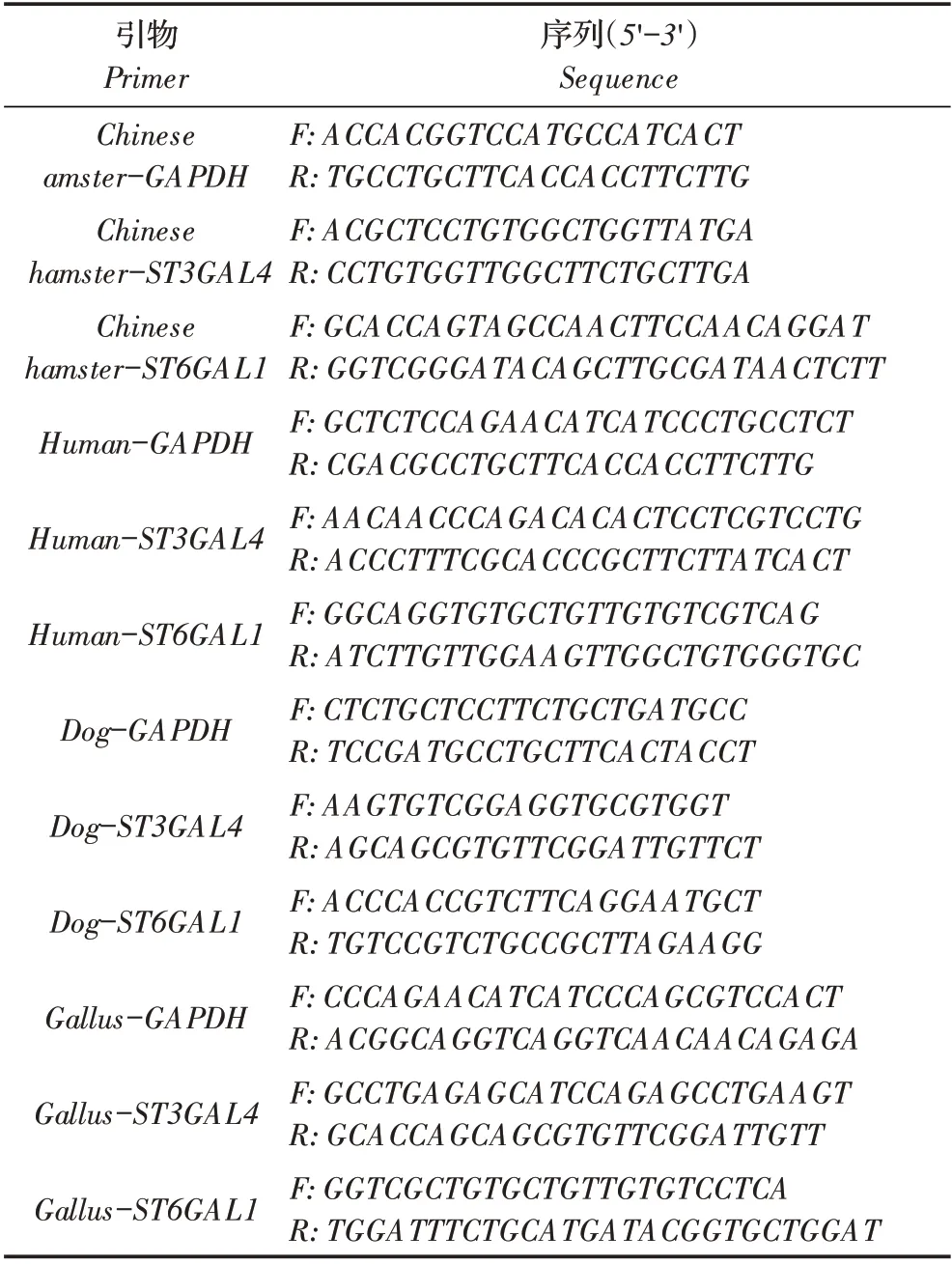
表1 实验所用引物信息Table 1 Primers used in this study

图1 两株流感病毒在不同细胞中的复制能力的检测结果Fig.1 Detection of replication abilities of two influenza viruses in different cells
2.2 SA 受体类型及其与流感病毒结合的检测结果将9 种细胞分别加入FITC 标记的植物凝集素SNA 和MAA I 后,采用直接免疫荧光法检测各细胞表面特异性受体。结果显示,SNA 处理细胞后,MDCK、16HBE 、DF-1 和A549 细胞可见大量绿色荧光,而BHK 细胞绿色荧光最少(图1A),表明前4种细胞含有大量SAα(2-6)Gal 结构的糖链,而BHK的SAα(2-6)Gal 含量最少。这与人源IAV CA04 株在各细胞中病毒滴度测定的结果一致,即有大量SAα(2-6)Gal 糖链的细胞对CA04 株敏感性较高;SAα(2-6)Gal 糖链含量较少的BHK 细胞对CA04 株敏感性较低。MAA I 处理细胞后, MDCK、DF-1 和16HBE 细胞表面可见很强的绿色荧光信号,BHK、HEP-2、A549、Vero、CHO-k1 和293T 细胞绿色荧光信号明显较弱(图2B),表明MDCK、DF-1 和16HBE 细胞表面比其它细胞含有更多的SAα(2-3)Gal 结构的糖链。因此,SAα(2-3)Gal 含量高的细胞对AIV Y280 株敏感性较高。同时也表明细胞对流感病毒的敏感性与其表面SA 受体含量呈正相关。
为进一步研究流感病毒与SA 受体类型的关系,经IFA 检测各细胞表面受体与病毒的结合能力。结果可见,人源IAV CA04 株感染各细胞后,MDCK、DF-1 和A549 细胞的荧光强度最高(图2C);AIV Y280 株感染细胞后,MDCK、DF-1 细胞的荧光强度高于其余细胞(图2D)。结果表明,不同细胞对流感病毒的结合能力存在差异, MDCK、DF-1 和A540 细胞含较多的SAα(2-6)Gal 糖链,因此对人流感病毒CA04 株结合能力较强;细胞表面有更多的SAα(2-3)Gal 糖链结构的MDCK、DF-1 则对AIV Y280 株结合能力较强。病毒与细胞表面受体结合能力与其表面ST 糖链含量呈正相关。
2.3 细胞表面流感病毒SA 受体的定量检测结果
将9 种细胞分别加入FITC 标记的植物凝集素SNA 和MAA I 后,采用流式细胞技术检测细胞表面被标记的唾液酸受体的荧光强度,并采用FlowJo V10 软件分析各细胞表面的MFI 即SA 的含量。结果显示,SNA 标记的DF-1 细胞的荧光强度显著高于其它细胞(p<0.05),MDCK 的荧光强度显著高于293T、Hep-2、A549、16HBE、和BHK(p<0.05)(图3A),MDCK 的荧光强度与CHO-k1、Vero 无统计学差异(p>0.05)(图3A);MAA I 标记的各细胞之间的荧光强度差异不显著(图3B)。表明9 种细胞中MDCK 和DF-1 细胞表面SAα(2-6)Gal 糖链结构最为丰富,其结合人流感病毒CA04 株的能力较强;而SAα(2-3)Gal 糖链结构在细胞之间差异不大,其结合AIV Y280 株的能力无显著差异,与2.1 的结果基本一致。同时进一步表明,SA 糖链含量与流感病毒的敏感性呈正相关。

图2 各细胞表面SA 受体及其对不同病毒结合能力的检测结果Fig.2 Detection results of sialic acid receptors on cell surface and their binding ability to different viruses

图3 各细胞表面SA 的定量检测结果Fig.3 Quantitative detection results of SA on the surface of various cell lines
2.4 各细胞ST相关基因的mRNA转录水平的检测结果为了从基因水平分析细胞表面SA受体含量,经荧光定量PCR 检测9 种细胞ST 相关基因(ST3GAL4、ST6GAL1)的mRNA 转录水平。结果显示,MDCK、DF-1细胞的ST3GAL4、ST6GAL1 mRNA转录水平高于其 它细 胞,Vero、293T、CHO-k1、Hep-2、A549、16HBE 细胞两种ST mRNA 转录水平均较低,BHK 细胞的两种ST mRNA 转录水平均最低(图4)。结合2.1的结果表明,MDCK、DF-1 细胞ST(ST3GAL4、ST6GAL1)含量较高,其与流感病毒的结合能力较强;而BHK 细胞的ST(ST3GAL4、ST6GAL1)转录水平最低,其结合流感病毒的能力也最低甚至无结合能力。细胞结合流感病毒的能力与其表面的ST 转录水平也呈正相关。结合2.3 的结果表明,MDCK、DF-1 细胞的ST(ST3GAL4、ST6GAL1)含量较高,其细胞表面SAα(2-6)Gal/SAα(2-3)Gal 糖链结构最丰富;而BHK 细胞的ST(ST3GAL4、ST6GAL1)转录水平最低,其细胞表面SAα(2-6)Gal/SAα(2-3)Gal 糖链结构最少。细胞表面SAα(2-6)Gal/SAα(2-3)Gal糖链与其胞内ST 转录水平也呈正相关。

图4 ST 相关基因ST6GAL1(A)、ST3GAL4(B)在各细胞中转录水平的检测结果Fig.4 Results of transcription levels of sialyltransferase ST6GAL1 (A) and ST3GAL4 (B) in each cell
3 讨 论
细胞作为流感病毒的增殖基质,具有经济方便,外界影响因素少,重复性好,质量稳定等优点。MDCK 广泛应用于人类流感病毒的分离和增殖,其对流感病毒敏感性较高,但其却不适于人源H3N2 流感病毒的生长[9]。为寻找更多合适流感病毒增殖的宿主细胞,本研究通过人/禽两种流感病毒感染9 种常用细胞后测定病毒的TCID50,比较不同的细胞对人/禽流感病毒的敏感性。结果显示,含有丰富SAα(2-6)Gal 糖链的MDCK、16HBE 和DF-1 对人源流感病毒CA04 株敏感,而Vero 、293T、CHOk1、Hep-2 和BHK 对该病毒不敏感;含丰富SAα(2-3)Gal 糖链的MDCK、DF-1 细胞同时也对AIV Y280 株敏感。
存在于细胞表面糖蛋白或糖脂中的SA 是流感病毒受体[10],流感病毒感染宿主细胞是由其表面HA 与宿主细胞表面上的糖链受体SA 共同介导的,这可能是本研究中细胞对流感病毒敏感性差异的原因。因此,为分析不同细胞对流感病毒敏感性差异的原因,本研究利用免疫荧光技术检测9 种细胞表面的流感病毒受体类型,并通过间接免疫荧光技术以及流式细胞术对9 种细胞表面SAα(2-6)Gal 和SAα(2-3)Gal 两种糖链进行定性定量分析。结果显示,细胞表面含有大量SAα(2-6)Gal 和SAα(2-3)Gal 糖链结构的MDCK 与DF-1 细胞表面吸附大量流感病毒,而SAα(2-6)Gal 和SAα(2-3)Gal 含量较少的BHK、Hep-2 与CHO-k1 细胞则结合少量流感病毒。表明细胞对流感病毒的敏感性与细胞表面SA 中SAα(2-6)Gal 和/或SAα(2-3)Gall 糖链含量呈正相关。
为分析细胞表面SA 含量与ST 相关基因mRNA转录的关系,本研究检测了SA 受体合成途径中的关键酶ST 在不同细胞中的mRNA 转录水平。结果显示,MDCK、DF-1 的ST3GAL1 和ST6GAL1 mRNA 转录水平较高。文献报道干扰ST6GAL1 与ST3GAL4 的表达水平,能够抑制流感病毒在Vero 细胞中的增殖[11-12];过表达ST6GAL1 则能增加MDCK 对人流感病毒的敏感性[13],表明ST 的表达水平影响流感病毒对宿主细胞的感染。本研究中,ST6GAL1 mRNA 转录水平高的细胞表面有着丰富的人流感病毒受体SAα(2-6)Gal,同样ST3GAL4 mRNA 转录水平高的细胞则有着丰富的AIV 受体SAα(2-3)Gal,受体丰富的细胞(MDCK 和DF-1)表现出对流感病毒高的结合能力以及较高的敏感性。由此表明,细胞对流感病毒的敏感性与SA 受体含量有关,而SA 含量受ST表达影响,即ST 表达影响细胞对流感病毒的敏感性。但是,本研究中16HBE 等细胞ST 的转录水平与其受体含量、病毒结合量结果并不完全一致,这可能是因为SA 受体并非流感病毒感染传播的唯一决定因 子[14];Vero、A549 和CHO-k1 细 胞 对Y280 株 敏感,但其ST3GAL4 mRNA 转录水平并不高,这可能是因为SAα(2-3)Gal 的合成还受ST3 家族中其它酶的调控[15];免疫荧光与流式细胞术的结果显示,16HBE、Vero 、293T、CHO-k1、Hep-2、A549 细胞表面AIV 受体SAα(2-3)Gal 的荧光值不高,可能是因为MAA I 仅特异性识别SAα2-3Galß1-4GlcNAc,而对SAα2-3Galß1-3GlcNAc 特异性不强,而该细胞系表面可能还存在丰富的SAα2-3Galß1-3GlcNAc。本研究的MDCK、DF-1 中的ST3GAL4 与ST6GAL1 均具有较高的转录水平,无法证明单一类型ST 与流感病毒感染宿主细胞能力的相关性。因此,ST 在流感病毒侵入宿主细胞中的作用还需进一步深入研究。Kosuke Takada 等人发现,在MDCK 中过表达人类流感病毒受体[SAα(2-6)Gal]和降低AIV 受体[SAα(2-3)Gal]的表达水平,其比野生MDCK 更有效支持人源H3N2 流感病毒的分离和生长,并且保持更高的遗传稳定性[16]。这为后续研究提供思路,即能否通过修饰表达不同ST 的表达水平,从而改变细胞对不同流感病毒的敏感性。
综上所述,本研究结果表明,不同细胞对人/禽流感病毒的敏感性存在差异,这与细胞表面SA 含量以及ST 的转录水平相关,这为开发新的适用于流感病毒培养的细胞提参考依据。

