新城疫病毒对宿主核糖体蛋白RPL11 降解机制的初步研究
徐智凯,杨 彬,李梦娇,仇旭升,谭 磊,孙英杰,刘炜玮,宋翠萍,廖 瑛,丁 铲,王金泉*,孟春春*
(1.新疆农业大学动物医学学院,新疆 乌鲁木齐 830052;2.中国农业科学院上海兽医研究所,上海 200241)
新城疫病毒(Newcastle diseases virus,NDV)是单股负链不分节段的RNA 病毒,在分类上属于副黏病毒科副黏病毒属(Avulavirus)的禽副黏病毒I 型(Avi⁃an paramyxovirus-1)。该病毒宿主广泛,目前可感染超过250 余种禽类[1]。核糖体大亚基蛋白11(Ribo⁃somal protein L11,RPL11)是核糖体60S 大亚基的重要组成部分[2]。RPL11 在进化上是一种高度保守的蛋白质,作为核糖体蛋白,RPL11 在细胞质中合成后,经核孔运输至细胞核中,并在核仁内参与核糖体的组装。组装成熟的核糖体经核孔又进入细胞质中,发挥合成蛋白质的功能[3]。核仁为RPL11 在细胞内的富集区域,细胞质中的RPL11 则随成熟的核糖体呈弥散性分布[4]。已有研究表明,在NDV 感染细胞早期,其M 蛋白能够在细胞核和核仁中聚集,并且在整个感染过程中持续存在于核仁中[5]。另有研究表明NDV 可通过PERK/PKR 和GADD34-PP1 信号通路调节宿主的翻译系统,但具体的作用机制仍未被解析[6]。RPL11、RPL5 蛋白与5S rRNA 形成5S核糖体蛋白粒子(5S RNP),这对于成熟核糖体的组装至关重要[7]。本研究结果显示,当NDV 感染后细胞自身蛋白翻译受到明显抑制,而病毒蛋白却一直在增加,推测是由于病毒感染后影响了细胞内成熟核糖体的组装进而导致某些蛋白的翻译效率下降。基于此,本实验通过检测NDV 感染后RPL11 蛋白表达量的变化,来证实该推测的正确性,为深入研究NDV感染后引起宿主细胞的核糖体应激提供了参考,同时也对解析NDV 的致病机制提供了新的切入点。
1 材料与方法
1.1 主要实验材料NDV SH15 分离株(属于ClassⅡ分支中的基因Ⅲ型)、成纤维传代细胞系DF-1 和pFlag-14 质粒由本实验室保存;鼠Puromycin 单克隆抗体(MAb)、家兔RPL11 MAb 购自美国Abcam 公司;鼠β-actin 多克隆抗体(PAb)、Flag MAb、山羊抗鼠IgG-Cy5、山羊抗鼠IgG-(H+L)、山羊抗兔IgG-FITC、山羊抗鼠IgG-FITC 和DAPI 染料均购自美国Sigma 公司;小鼠抗核衣壳蛋白(NP protein)MAb 由本实验室制备。TRIzol 试剂购自碧云天生物技术有限公司;SYBR qPCR Master Mix 试剂盒和反转录试剂盒均购自上海东圣生物有限公司:Lipo2000、GIBCO-DMEM 培养基、细胞用磷酸盐缓冲液(PBS)、胎牛血清(FBS)、T4 DNA 快速连接酶、限制性内切酶购自美国Invitrogen 公司;嘌呤霉素Puromycin 和蛋白酶体抑制剂MG132 均购自Selleck 公司。
1.2 Puromycin 标记NDV 感染后细胞新合成蛋白的检测Puromycin 具有与tRNA 分子末端类似的结构,能够与氨基酸结合,代替氨酰化的tRNA 与核糖体的A 位点结合,并掺入到生长的肽链中,因而其可以用于标记新合成的蛋白[8]。将NDV 以MOI 1接种于DF-1 细胞1 h 后,换维持液(含2%胎牛血清的DMEM)继续培养。分别收集NDV感染后8 h、16 h、24 h 和32 h 后的细胞,并在每个收样时间点前1 h向维持液加入终浓度为20 μmol/mL 的Puromycin 标记新合成蛋白。细胞经PBS 漂洗1 次,离心后弃去PBS,加入150 μL RIPA裂解液,100 ℃加热10 min,-80 ℃保存备用。将各个时间点收集的细胞样品经12% SDSPAGE 凝胶电泳,转印至NC 膜,分别用鼠抗Puro⁃mycin MAb(1:1 000)、鼠抗NP MAb(1:1 000)和鼠抗β-actin PAb(1:1 000)作为一抗,用山羊抗兔IgG-(H+L)(1:10 000)和山羊抗鼠IgG-Cy5(1:10 000)作为二抗,经western blot 检测NDV 感染后细胞新合成蛋白、β-actin 和病毒NP 蛋白的表达情况,并以未感染病毒的DF-1 细胞作为对照。
1.3 NDV 感染细胞后内源性RPL11 蛋白表达的western blot 检测参照1.2 所述方法,同时收集MOI 1 的NDV 感染8 h、16 h、24 h 和32 h 后和分别以MOI 1 和0.1 的NDV 感染16 h 和32 h 后的细胞样品,常规处理经SDS-PAGE 后,分别以兔抗RPL11(1:1 000)多克隆抗体、鼠抗NP MAb(1:1 000)为一抗,以山羊抗兔IgG-(H+L)(1:10 000)和山羊抗鼠IgG-Cy5(1:10 000)作为二抗检测上述细胞中RPL11和病毒NP 蛋白的表达情况,并以每个时间点未感染病毒的DF-1 细胞作为对照。
1.4 RPL11 基因转录水平的检测分别根据RPL11(001305188.1)和β-actin(L08165.1)的基因序列设计荧光定量PCR 检测引物RPL11-F/R、β-actin-F/R(表1),引物由上海生工生物工程技术服务有限公司合成。同时收集MOI 1的NDV 感染8 h、16 h、24 h和32 h 后和分别以MOI 1 和0.1 的NDV 感染16 h 和32 h后的细胞样品,经TRIzol 提取各时间点的细胞总RNA,反转录合成cDNA,-20 ℃保存备用。采用SYBR qPCR Master Mix 试剂盒,以引物RPL11-F/R和β-actin-F/R 检测RPL11 基因和β-actin 的转录水平。反应条件:95 ℃2 min;95 ℃5 s、60 ℃10 s,72 ℃50 s,40 个循环。最后以β-actin 扩增值为参照,根据2-ΔΔCT方法,计算RPL11 基因mRNA 的相对转录水平。以未感染病毒的DF-1 细胞作为对照。
1.5 NDV 感染细胞后RPL11 蛋白分布的激光共聚焦检测将DF-1 细胞铺于激光共聚焦小皿中,将MOI 1 的NDV 感染DF-1 细胞,24 h 后使用4%多聚甲醛固定细胞,0.1%Triton-100 通透处理20 min,5%BSA 封闭1 h,再分别以兔抗RPL11 多克隆抗体(1:200)和鼠抗NP MAb(1:200)为一抗,使用山羊抗兔IgG-FITC(1:500)和山羊抗鼠IgG-FITC(1:500)为二抗,使用DAPI 核染5 min,检测RPL11 蛋白在细胞核与细胞质中的分布,以未感染NDV 的DF-1细胞作为对照。通过Zeiss(蔡司分析软件)对荧光点进行统计,分析RPL11 蛋白和病毒NP 蛋白表达量的变化。
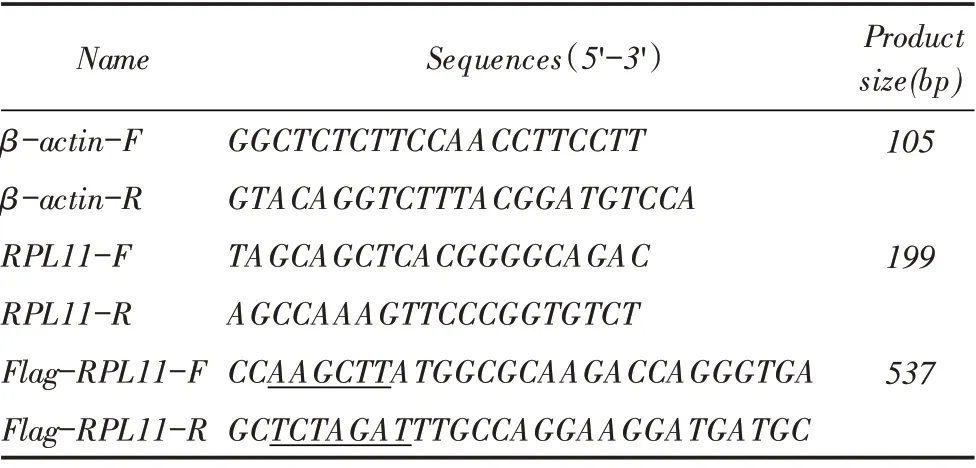
表1 荧光定量PCR 以及构建重组质粒的引物Table 1 Primers used for qRT-PCR and construct plasmids
1.6 重组质粒的构建、转染及NDV 感染对外源RPL11 蛋白表达影响的检测提取DF-1 细胞的总RNA,反转录为cDNA,以其为模板以引物Flag-RPL11-F/R 经PCR 扩增RPL11 基因的完整阅读框,克隆至pFlag-14 中构建重组质粒pFlag-RPL11 并测序鉴定。采用Lipo2000 将构建的重组质粒pFlag-RPL11 和pFlag-14 空质粒分别转染DF-1 细胞,24 h后收集细胞,常规处理后经SDS-PAGE 电泳,按照1.3 的方法经western blot 鉴定外源RPL11 蛋白的表达。为检测NDV 是否影响外源RPL11 蛋白的表达水平,将重组质粒pFlag-RPL11 转染DF-1 细胞24 h后,再分别使用MOI 0.1 和MOI 1 的NDV 感染,24 h后收集细胞蛋白样品,经1.3 的western blot 检测RPL11 和病毒NP 蛋白表达水平。以未感染病毒的DF-1 细胞作为对照。
1.7 蛋白酶抑制剂对NDV 感染细胞后RPL11 蛋白表达影响的检测MG132 是一种具有细胞通透性的泛素蛋白酶体抑制剂,能够抑制20s 蛋白酶体ZLLL-MCA的降解活性,从而使蛋白酶体降解蛋白的过程受到抑制[9]。将DF-1细胞培养于6 孔板,12 h后,将MOI 1 的NDV 感染细胞,1 h 后在细胞维持液中添加终浓度为15 μmol/mL 的MG132。设正常培养的细胞为对照,设感染后不加MG132 的细胞为阳性对照。24 h 后同时收集上述3 组细胞的培养上清,经Reed-Muench 法测定病毒TCID50。同时收集细胞蛋白样品,参照1.2、1.3的western blot 方法分别检测NDV感染后RPL11、β-actin和病毒NP蛋白的表达情况。
2 结 果
2.1 NDV 感染后细胞新合成蛋白的检测结果
NDV 感染细胞不同时间后收集经Puromycin 标记的细胞,裂解后经western blot 检测新合成蛋白的含量。结果显示,NDV 感染后8 h,Puromycin 标记的蛋白无明显变化;16 h 后NDV 感染细胞中新合成蛋白开始减少;随着时间的延长感染细胞中的新合成蛋白逐渐减少直至完全消失;而病毒NP 蛋白的表达量却一直增加(图1A)。通过灰度扫描分析结果显示,与未感染病毒的对照细胞相比,感染后8 h、16 h、24 h、32 h 的细胞中新合成的蛋白量下降至原来的96%、85%、37%、10%(图1B)。以上结果表明NDV 感染了DF-1 细胞并且在其中正常复制;NDV 感染后显著抑制细胞新合成蛋白的翻译,并呈时间依赖性。

图1 NDV 感染后puromycin 标记蛋白含量的检测结果Fig.1 The expression level of puromycin labeled protein after NDV infection
2.2 NDV 感染后RPL11 蛋白表达及该基因转录水平的检测结果分别检测NDV 感染后不同时间点RPL11 的蛋白表达和mRNA 转录水平。Western blot结果显示,NDV 感染DF-1 细胞16 h 后,细胞中RPL11蛋白的表达量开始减少,至感染后24 h和32 h后基本检测不到RPL11 蛋白,病毒NP 蛋白表达量却一直上升(图2A)。分别以MOI 0.1 和MOI 1 的NDV 感染DF-1 细胞,收集感染后16 h 和32 h 细胞,west⁃ern blot 结果显示感染后16 h,MOI 1 NDV 感染的细胞RPL11 蛋白的表达量比MOI 0.1 NDV感染的细胞更少。到感染后32 h 时,MOI 0.1 组仅能检测到少量RPL11 蛋白,而MOI 1 组则几乎检测不到RPL11 的表达,而病毒NP 蛋白表达量则显著上升(图2B)。采用qRT-PCR 检测RPL11 mRNA 的转录水平,结果显示,感染后不同时间收集的细胞和感染不同剂量NDV后于不同时间收集的细胞与对照细胞相比,其mRNA 的转录水平均无显著变化(p>0.05)(图2C、2D)。上述结果表明NDV 感染导致RPL11 蛋白的表达水平下降,且该下降与病毒感染的时间和剂量呈正相关,但并不影响RPL11 mRNA 的转录水平。推测病毒是在翻译后修饰环节影响了RPL11 的表达水平。
2.3 NDV 感染后RPL11 蛋白分布的激光共聚焦检测结果NDV 感染细胞24 h 后,采用激光共聚焦试验分别检测RPL11 蛋白在细胞核与细胞质中的分布。红色荧光信号是NDV 的NP 蛋白,绿色荧光信号是RPL11 蛋白,蓝色荧光是细胞核。观察可见,未感染病毒的对照细胞中绿色荧光的RPL11 蛋白均匀分布于细胞核和细胞质中且荧光信号很强烈;NDV 感染的细胞中RPL11 的绿色荧光强度明显变弱,且细胞核和细胞质中绿色荧光减少的趋势相同。虽然组装为60S 大亚基的核心蛋白RPL11 的表达呈明显下降趋势,但病毒NP 蛋白的红色荧光信号却呈显著增加趋势(图3A)。通过蔡司软件对荧光点的统计结果显示,NDV 感染的细胞RPL11 的荧光强度与对照细胞相比下降了12%,差异极显著(p<0.01)(图3B)。结果表明NDV 感染后可同时导致细胞核和细胞质中RPL11 蛋白的表达水平下降,而病毒NP蛋白的表达却不受其影响。
2.4 NDV 感染对外源RPL11 蛋白表达影响的检测结果构建的重组质粒pFlag-RPL11 经测序鉴定正确后转染DF-1 细胞,24 h 后收集细胞蛋白样品。western blot 结果显示,转染重组质粒的细胞相对转染空质粒的对照细胞在20 ku~25 ku 的位置出现了特异性条带与预期一致(图4A),表明重组质粒在DF-1 细胞中表达了RPL11 蛋白。将重组质粒转染DF-1 细胞24 h 后,再分别以不同剂量的NDV 感染24 h,western blot 检测结果显示与对照细胞相比,NDV 感染细胞的外源RPL11 的表达量明显下降,且下降程度随着感染病毒剂量的增加而更明显,病毒NP 蛋白的表达量却在增加(图4B)。以上结果表明NDV 感染细胞后也可以导致外源RPL11 蛋白表达水平下降,且该下降程度与病毒的感染剂量呈正相关。

图2 NDV 感染后RPL11 的蛋白水平和转录水平的检测Fig.2 Detect of the expression and transcription level of RPL11 after NDV infection

图3 NDV 感染后RPL11 蛋白分布变化的激光共聚焦检测结果Fig.3 Confocal laser detection results of protein distribution changes after NDV infection

图4 NDV 感染细胞后对外源RPL11 蛋白表达影响的检测结果Fig.4 Effect of NDV infection on the expression of exogenous RPL11 protein
2.5 蛋白酶抑制剂对NDV 感染细胞后RPL11 蛋白表达影响的检测结果将MOI 1 的NDV 感染DF-1细胞1 h后,添加MG132,24 h后收集细胞上清,测定病毒的TCID50并经western blot检测RPL11蛋白的表达。病毒滴度测定结果显示, MG132 处理和不处理的细胞病毒滴度分别为10-7.4TCID50/mL和10-7.2TCID50/mL,统计学分析显示二者无明显差异(p>0.05)(图5A)。Western blot 结 果 显 示,MG132 处 理 的细 胞RPL11 的表达量比NDV 感染但未经该药物处理的细胞有所增加,然而较正常对照细胞仍略微下降,且NP 蛋白的表达量略有下降(图5B)。上述结果表明使用MG132 处理细胞后,可以回补NDV 感染导致的RPL11 蛋白表达水平的下降,进而也表明RPL11 表达水平的下降是由于蛋白泛素酶体途径导致蛋白的降解所致。

图5 蛋白酶抑制剂MG132 对NDV 感染细胞后RPL11蛋白表达影响的检测结果Fig.5 Effect of protease inhibitor MG132 on RPL11 protein expression after NDV infection
3 讨 论
完整核糖体(Ribosome)是一个椭球形的粒状无膜细胞器,由40S 小亚基和60S 大亚基组成。其中60S 大亚基是由47 种大亚基蛋白和5S RNA、28S RNA 以及5.8S RNA 3 种核糖体RNA 包裹而成,RPL11 是核糖体60S 大亚基的重要组成部分,是其起始合成的核心原件[10]。
本研究通过Puromycin 标记NDV 感染细胞后的胞内新生蛋白,发现宿主新生蛋白的合成受到明显抑制;使用NDV NP 蛋白MAb 进行western blot 检测发现病毒蛋白的合成却一直呈增加趋势。随后发现细胞内核糖体蛋白RPL11 呈明显减少趋势,且与病毒感染剂量和感染时间成正相关。但qRT-PCR 结果却显示RPL11 基因mRNA 的转录水平无明显变化。通过外源转染pFlag-RPL11 再感染NDV,发现NDV可使外源性RPL11 蛋白的表达水平下降。随后使用泛素蛋白酶体抑制剂MG132 处理细胞,显示NDV 介导的RPL11 蛋白表达下降可被特异性阻断。综上得出如下结论:NDV 感染DF-1 后,可导致细胞内的RPL11 蛋白通过泛素蛋白酶体依赖途径所降解。
本研究结果表明NDV 感染细胞导致RPL11 表达量降低后仅影响宿主蛋白的合成,而病毒NP 蛋白的含量却随感染时间的延长呈一直增加的趋势。此前有研究报道表明核糖体大亚基蛋白RPL13 对于酵母的蛋白翻译是必须的,但在人单核细胞U937 细胞中敲除RPL13,对细胞的多聚核糖体的形成、整体翻译活性、翻译保真度和细胞增殖等均无显著影响,而仅对核糖体RNA 的甲基化水平有影响[11]。基于此,本研究提出一个假设,即病毒感染后,由于胞内核糖体大亚基蛋白RPL11 的表达量明显下降,导致其形成完整的核糖体受到影响,这对细胞自身蛋白合成来说可能是致命的,具体表现为细胞内新合成蛋白显著下降。由于NP 蛋白的含量一直增加,因此推测RPL11 对于病毒蛋白的合成可能是非必须,缺少RPL11 蛋白的不完整核糖体可翻译一些特定类型的mRNA 进而有利于病毒复制。后续本研究团队将进一步验证该假说是否成立。
泛素蛋白酶体系统(UPS)是细胞内ATP 依赖的非溶酶体蛋白降解系统,可以降解细胞内80%~90%的蛋白[12-13],包括:细胞周期调节因子、肿瘤抑制因子、转录激活和抑制因子、细胞表面受体以及突变或受损的蛋白等[14-15]。据报道真核细胞中核糖体相关蛋白的质量控制(RQC)也是被E3 泛素连接酶Ltn1 所控制,该E3 连接酶可识别处于“失速”状态的核糖体,进而将其泛素化和降解[16],后续本团队将对RPL11 蛋白的降解是否与Ltn1 酶有关深入探究。此 外RPL11 和RPL5 以 及5S rRNA 形 成的5S RNP 是形成核糖体60S 大亚基的必须单位,并已证实RPL5与RPL11 的稳定性具有高度相互依赖关系[7]。NDV感染后RPL11 发生泛素化降解,但本研究未检测RPL5 和5S rRNA 的表达变化。后续将系统地对构成5S RNP 的组分进行检测,以整体分析NDV 感染后5S RNP 的表达变化。本研究为解析NDV 感染后宿主细胞内蛋白翻译的变化提供了新的着眼点。

