基于Gluc 的马源NLRP3 炎症小体激活系统的建立
王 岩,刘 聪,那 雷,王雪峰,林跃智,王晓钧
(中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/马传染病和慢病毒病研究创新团队,黑龙江 哈尔滨 150069)
NLRP3 炎症小体是一种由NLRP3 蛋白(NOD-,LRR- and pyrin domain- containing protein 3)、凋亡相关斑点样蛋白(Apoptosis-associated speck-like pro⁃tein,ASC)和含半胱氨酸的天冬氨酸蛋白水解酶pro-caspase-1 组成的大分子多蛋白复合物,可识别多种病原相关分子模式和宿主来源的危险信号,如细菌的穿孔素、肽聚糖、病毒的dsRNA、DNA、脂蛋白、ATP 和尿酸等[1-3]。当机体受到刺激时,NL⁃RP3 与接头蛋白ASC 结合,招募并切割pro-caspase-1 形 成 具 有 活 性 的caspase-1(p20 和p10 两 个 亚 单位)。活化的p20 进一步切割pro-IL-1β 和pro-IL-18产生成熟的IL-1β(p17)和IL-18,分泌到细胞外引起炎症反应[4-5](图1)。

图1 NLRP3 炎症小体的结构及组装Fig.1 The structure and formation of NLRP3 inflammasome
NLRP3 炎症小体在参与炎症及天然免疫调节中发挥重要作用。目前已有多项研究发现NLRP3 炎症小体在病毒复制调控及疾病进程中起重要作用,特异性NLRP3 体外重建系统是开展炎症调控机制研究的前提[6-8]。目前已有鼠源和猪源NLRP3 炎症小体体外筛选系统的相关报道[7,9],然而由于该系统中的组成分子具有较为严格的种属特异性,无法开展马源NLRP3 炎症小体的研究。因此,建立马属动物NL⁃RP3 炎症小体的激活系统是研究马属动物炎症调控反应的关键。本研究拟参考鼠源NLRP3 炎症小体激活系统的构成,并引入Gaussia 萤光素酶(Gaussia lu⁃ciferase,Gluc)作为激活指示信号[9],通过将GLuc 前端的分泌信号肽去掉后连接到pro-IL-1β 的羧基端,构建重组表达质粒,与炎症小体组分中相应的表达质粒(ASC、NLRP3 和caspase-1)依次共转染HEK 293T 细胞;通过检测细胞上清中的荧光信号和细胞内p17 蛋白的表达,确定不导致pro-IL-1β 切割的NLRP3 复合体中相应组分的最适剂量,从而建立特异性马源NLRP3 炎症小体激活系统,并且实现细胞内IL-1β 的切割活性和细胞上清中成熟IL-1β 的平行检测,为马属动物NLRP3 炎症小体的调控研究提供技术手段。
1 材料与方法
1.1 主要实验材料pcDNA3.1-HA、pCAGGS 质粒和人胚胎肾细胞HEK 293T 细胞由本实验室保存;E. coil DH5α 感受态细胞购自天根生化科技(北京)有限公司;pMCS-Gaussia Luc 质粒购自Thermo Fisher Scientific 公司;马组织(EIAV 感染马的脾脏)由本实验室保存。
1.2 主要试剂TRIzolTM试剂、限制性核酸内切酶购自Thermo Fisher Scientific 公司;反转录试剂盒购自TaKaRa 公司;KOD 高保真酶购自TOYOBO 公司;同源重组酶Seamless Assembly Cloning 购自Clone Smarter 公司;胶回收试剂盒、DNA 小提试剂盒购自Omega 公司;DNA 转染试剂PolyJetTM购自SignaGen Laboratories 公司;5×passive lysis buffer 购自Promega公司;鼠源抗Flag 标签抗体、鼠源抗HA 标签抗体、红外荧光标记的羊抗鼠IgG(IgG-Dylight 800)、GLuc 底物Coelenterazine(native)购自Sigma 公司;Ni⁃gericin 购自APExBIO 公司。
1.3 重组质粒的构建根据GenBank 中eqIL-1β 基因序列(D42147.1)、eqCaspase-1 基因序列(NM_001081842)、eqASC 基因序 列(XM_001500509.4)、eqNLRP3 基因序列(XM_005598741.3)),设计特异性引物(表1)。采用TRIzol 试剂提取马组织的总RNA,经反转录制备cDNA,以cDNA 为模板,利用引物IL-1β-F1/IL-1β-R1,扩增eqIL-1β 目的基因。以此PCR 产物为模板,利用引物IL-1β-F2/IL-1β-R2 扩增eqIL-1βflag 基因,经Not I 和Xho I 双酶切后克隆到pCAGGS 载体中,构建重组质粒pCAGGS-eq⁃IL-1β-flag。以真核表达质粒pCAGGS-eqIL-1β-flag为模板,利用引物pCAGGS-IL-1β-F/pCAGGS-IL-1β-R 扩增线性pCAGGS-eqIL-1β-flag载体;以pMCSGaussia Luc 质粒为模板,利用特异性引物GLuc-F/GLuc-R,扩增线性目的基因Gluc(Gaussia Luc),利用同源重组方法将目的基因Gluc 克隆到pCAGGS-eqIL-1β-flag 载体中,构建重组质粒pCAGGS-eqIL-1β-GLuc-flag。以pCAGGS 载体为模板,利用引物casppCAGGS-F/casp-pCAGGS-R 扩 增 线 性pCAGGS 载体;以上述马组织的cDNA 为模板,利用引物Casp-1-F/Casp-1-R 扩增线性目的基因eqCaspase-1。利用同源重组方法将目的基因eqCaspase-1克隆到pCAGGS载体中,构建重组质粒pCAGGS-eqCaspase-1-HA。以上述马组织的cDNA为模板,利用引物ASC-F/ASC-R 扩增eqASC 目的基因,经Hind III 和Not I 双酶切后克隆到pcDNA3.1-HA 载体中,构建pcDNA3.1-eqASC-HA 质粒。以上述马组织的cDNA为模板,利用引物NLRP3-F/NLRP3-R 扩增eqNLRP3 目的基因,通过Hind III和Not I 双酶切后克隆于pcDNA3.1-HA 载体中,构建pcDNA3.1-eqNLRP3-HA质粒。

表1 用于相关重组质粒构建所需引物Table 1 Primers used for the construction of recombinant plasmids
1.4 Western blot 检测各蛋白在HEK 293T 细胞中的表达将HEK 293T 细胞以每孔4×105个细胞均匀铺于12孔板中,待细胞生长至80%时利用PolyJet转染试剂分别转染500 ng pCAGGS-eqIL-1β-flag、500 ng pCAGGS-eqIL-1β-GLuc-flag、500 ng pCAGGS-eqcas⁃pase-1-HA、500 ng pcDNA3.1-eqASC-HA、500 ng pcDNA3.1-eqNLRP3-HA 质粒。37 ℃培养24 h 后弃去培养液,加入裂解液裂解细胞,离心去除细胞碎片并收集细胞裂解液上清,经SDS-PAGE 凝胶电泳后,用半干转膜仪将蛋白样转印至PVDF 膜,5%脱脂乳封闭2 h,分别用鼠源抗Flag 抗体(1:5 000)和鼠源抗HA 抗体(1:5 000)作为一抗,用红外荧光标记的羊抗鼠IgG(1:10 000)作为二抗,利用激光扫描成像系统Odyssey 扫描,检测各目的蛋白的表达。
1.5 激活系统的构建参照1.4 中转染方法将250 ng pCAGGS-eqIL-1β-GLuc-flag 质粒分别与不同剂量(0、1.56 ng、3.12 ng、6.25 ng、12.5 ng、25 ng、50 ng和100 ng)的pCAGGS-eqCaspase-1-HA 质粒共转染HEK 293T 细胞,20 h 后收集25 μL 上清与GLuc 底物Coelenterazine(native)混合后利用微孔板化学发光检测仪检测荧光强度,同时裂解细胞,按1.4 中west⁃ern blot 方法检测细胞中切割的IL-1β 蛋白,确定上清中荧光强度较低且不能导致细胞中IL-1β 蛋白切割的pCAGGS-eqCaspase-1-HA 质粒的最适转染剂量;在此基础上,再将250 ng pCAGGS-eqIL-1β-GLuc-flag、pCAGGS-eqCaspase-1-HA(确定的最适剂量)质粒与不同剂量的pcDNA3.1-eqASC-HA(0、1.56 ng、3.12 ng、6.25 ng、12.5 ng、25 ng、50 ng 和100 ng)质粒共转染HEK 293T 细胞,按上述检测方法确定不能导致IL-1β 蛋白切割的pcDNA3.1-eqA⁃SC-HA 质粒的最适转染;按上述转染方法再将250 ng pCAGGS-eqIL-1β-GLuc-flag、最 适 剂 量 的pCAGGS-eqCaspase-1-HA 质粒、最适剂量的pcDNA 3.1-eqASC-HA 质粒不同剂量(0、1.56 ng、3.12 ng、6.25 ng、12.5 ng、25 ng、50 ng 和100 ng)的pcD⁃NA3.1-eqNLRP3-HA 质粒共转染HEK 293T 细胞,按上述检测方法确定不能导致IL-1β 蛋白切割的pcD⁃NA3.1-eqNLRP3-HA 质粒的最适转染剂量。
1.6 激活系统有效性的检测根据1.5 中确定的pCAGGS-eqIL-1β-GLuc-flag、pCAGGS-eqCaspase-1-HA、pcDNA3.1-eqASC-HA、pcDNA3.1-eqNLRP3-HA 质粒的最适转染剂量进行HEK 293T细胞的共转染实验,于收样前2 h 分别加入不同剂量(0、2 μmol/L、4 μmol/L、8 μmol/L、16 μmol/L 和32 μmol/L)的NL⁃RP3炎症小体激活剂Nigericin,按照1.5中检测方法进行细胞上清的荧光强度与细胞中切割的IL-1β 蛋白检测。
2 结 果
2.1 重组质粒的酶切鉴定分别利用Not I/Xho I、Hind III/Not I、Nhe I/Kpn I对构建的重组质粒pCAGGSeqIL-1β-flag、pCAGGS-eqIL-1β-GLuc-flag、pCAGGSeqCaspase-1-HA、pcDNA3.1-eqASC-HA和pcDNA3.1-eqNLRP3-HA 进行双酶切鉴定,分别获得了864 bp、1 365 bp、1 215 bp、585 bp、3 093 bp 大小的目的条带,经测序鉴定后确定大小和序列均与预期结果相符(图2),表明各质粒均正确构建。

图2 重组质粒的酶切鉴定Fig.2 Digestion analysis of the recombinant plasmids
2.2 重组蛋白表达的鉴定将重组质粒pCAGGS-eq⁃IL-1β-flag、pCAGGS-eqIL-1β-GLuc-flag、pCAGGSeqCaspase- 1- HA、 pcDNA3.1- eqASC- HA 和pcD⁃NA3.1-eqNLRP3-HA 分 别转染HEK 293T 细胞,west⁃ern blot 检测目的蛋白大小均符合预期(图3)。表明各重组蛋白均可在HEK 293T 细胞中正确表达。
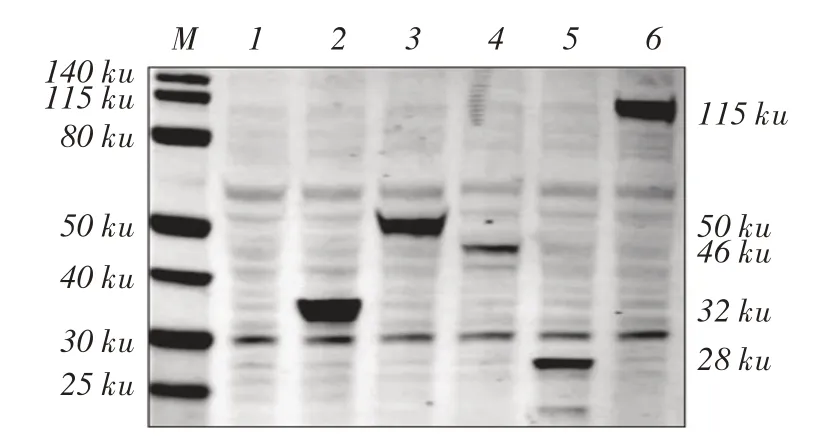
图3 重组蛋白表达的western blot 鉴定Fig.3 Western blot analysis for recombinant proteins expressed in HEK293T cells
2.3 NLRP3 体外激活系统构建为确定NLRP3 炎症小体激活系统中各质粒的最适转染剂量,分别对NLRP3 炎症小体复合物中pCAGGS-eqCaspase-1-HA、pcDNA3.1-eqASC-HA 和pcDNA3.1-eqNLRP3-HA 质粒进行剂量依赖性试验。结果显示,随着pCAGGS-eqCaspase-1-HA 质粒转染剂量的增加,细胞中切割的IL-1β 蛋白水平逐渐升高,且细胞上清中荧光强度也逐渐增强。当pCAGGS-eqCaspase-1-HA 质粒转染剂量为3.12 ng 时,western blot 几乎检测不到切割的IL-1β,同时,细胞上清中荧光信号也较弱,因此可以确定NLRP3 激活系统中的pCAGGSeqCaspase-1-HA 质粒发挥切割IL-1β 作用的临界转染剂量为3.12 ng(图4A)。将250 ng pCAGGS-eqIL-1β-GLuc-flag 质粒、3.12 ng pCAGGS-eqCaspase-1-HA 质粒与不同剂量的pcDNA3.1-eqASC-HA 质粒共转染,当pCAGGS-eqASC-1-HA 质粒转染剂量为3.12 ng 时,western blot 检测不到切割的IL-1β,同时,细胞上清中荧光信号也较弱,确定NLRP3 激活系统中的pCAGGS-eqASC-1-HA 质粒发挥切割IL-1β 作用的临界转染剂量为3.12 ng(图4B)。再将250 ng pCAGGS-eqIL-1β-GLuc-flag 质 粒、3.12 ng pCAGGS-eqCaspase-1-HA 质粒、3.12 ng pCAGGSeqASC-HA 质粒与不同剂量的pcDNA3.1-eqNLRP3-HA 质粒共转染,当pCAGGS-eqASC-1-HA 质粒转染剂量为3.12 ng 时,western blot 检测不到切割的IL-1β,同时,细胞上清中荧光信号也较弱,确定NLRP3 激活系统中的pCAGGS-eqNLRP3-1-HA 质粒发挥切割IL-1β 作用的临界转染剂量为6.25 ng(图4C)。结果表明,本研究所构建的马源NLRP3炎症小体激活系统中各个组分的工作剂量分别为pCAGGS-eqIL-1β-GLuc-flag 250 ng、pCAGGS-eqCas⁃pase-1-HA 3.12 ng、pcDNA3.1-eqASC-HA 3.12 ng 和pcDNA3.1-eqNLRP3-HA 6.25 ng。
2.4 NLRP3 体外激活系统有效性的检测在确定的NLRP3 炎症小体激活系统中各质粒的转染剂量条件下,加入NLRP3 炎症小体激活剂Nigericin[10],以检测所建立系统的有效性。结果显示,随着Nigeri⁃cin 剂量的增加,细胞中切割的IL-1β 蛋白水平逐渐升高,且细胞上清中荧光强度也逐渐增强(图5)。表明该系统对NLRP3 的激活因素可以产生有效应答,可用于后续能激活或抑制马NLRP3 炎症小体相关蛋白或药物的筛选研究。

图4 NLRP3 炎症小体体外激活系统构建Fig.4 Construction of NLRP3 inflammation activation system in vitro

图5 马NLRP3 炎症小体体外激活系统有效性检测Fig.5 Verification of equine NLRP3 inflammasome activation system in vitro
3 讨 论
NLRP3 炎症小体在病毒复制调控及疾病进程中起重要作用,对NLRP3 炎症小体的激活机制及其在疾病进展中的调控作用是目前的热点研究。而建立灵敏特异的评估方法是该研究得以开展的重要前提。目前已建立了多种检测及评估方法,如采用激光共聚焦显微镜的方法判断NLRP3 和ASC 斑点样聚集情况;Western blot 检测NLRP3 和ASC 多聚复合物的形成;采用ELISA 方法检测细胞上清中炎症因子水平(IL-1β 和IL-18)等,对NLRP3 炎症小体是否激活综合评价[8,10-11]。这些方法中最为经典,最为直接的就是NLRP3 的体外激活系统。现已有关于猪源和鼠源NLRP3 炎症小体检测系统的报道并取得了一定进展。但是该系统尽管可通过western blot 检测细胞内pro-IL-1β 的切割,但是对分泌到细胞上清中成熟的IL-1β 则需要ELISA 的辅助检测,但有多项研究发现这种方法对抗体的亲和力和特异性要求较高且敏感性较低,可能存在无法检测的情况。
本研究在上述研究的基础上,引入了GLuc,建立了高敏感性的NLRP3 炎症激活系统。GLuc 是桡足类海洋动物Gaussia princeps 分泌的一种发光物质,是目前已知的最小的可自然分泌的荧光素酶,其灵敏度比萤火虫荧光素酶FLuc(Firefly luciferase)和海蜃荧光素酶RLuc(Renilla luciferase)高出约10 000倍,已被广泛用于蛋白互作与定位检测、启动子活性监测及肿瘤发生和药物治疗评价等研究领域[9,12]。GLuc 报告基因的使用,不仅可以提高检测的敏感性,重要的是实现了细胞内IL-1β 的切割活性和细胞上清中成熟IL-1β 的平行检测,使评价更为准确、便捷,方法更加方便。另外,如果利用本研究中的GLuc-IL-1β 质粒构建成细胞系,也可为NLRP3炎症小体体内激活的检测提供可靠手段,并进一步促进对NLRP3 炎症小体调控机制的研究。
本研究中构建的激活系统虽然是基于NLRP3 炎症小体,但对于NAIP-NLRC4 和AIM2 这几类炎症小体,由于激活机制较为相似,因此将NLRP3 替换成NAIP-NLRC4 或AIM2,也可以构建其他几种类型炎症小体的体外筛选系统[2-3,13]。由此可见,本研究不仅建立了高效特异性的马源NLRP3 炎症小体的体外筛选系统,同时也为其它炎症小体的构建提供重要参考依据。本研究中构建的炎症小体激活系统将为马属动物炎症性疾病(如马传染性贫血病毒、马流感病毒、马疱疹病毒和马病毒性动脉炎、马鼻疽和马腺疫引起的相关疾病)的研究提供良好的检测平台,促进NLRP3 炎症小体活化及调控机制的认知,同时也为马属动物炎症相关性疾病提供新的治疗靶点。
——一道江苏高考题的奥秘解读和拓展

