牙源性干细胞来源的外泌体的研究进展
宫晟凯,孙仔昂,王 晓,蒋文凯,王 玮
外泌体(exosomes)是细胞主动向胞外分泌的大小均一的囊泡样小体,囊泡中包含有胆固醇、蛋白质(如各种细胞因子)及核酸(如DNA、mRNA、micro RNA)等分子[1],具有细胞间信号转导、修复血管、免疫调节、促进骨组织修复以及肿瘤发生等[2]生理功能。不同类型的细胞均可以释放出外泌体[3]。而间充质干细胞(mesenchymal stem cells,MSCs)分泌的外泌体由于具有与MSCs相似的生物学特性及功能,且比MSCs更稳定和易于保存受到了更多研究者的青睐[4-5]。
牙齿组织来源的MSCs均来自头颅神经嵴细胞,其独特的组织特异性使其和其外泌体在神经再生性疾病、牙髓牙本质再生、牙周组织再生以及其他难治性疾病方面具有潜在的优势。牙齿组织来源的MSCs,即牙源性干细胞,主要包括牙髓干细胞(dental pulp stem cells,DPSCs)、根尖牙乳头干细胞(apical papilla stem cells,SCAP)、脱落乳牙干细胞(stem cells from exfoliated deciduous teeth,SHED)、牙周膜干细胞(periodontal ligament stem cells, PDLSCs)、牙囊祖细胞(dental follicle progenitor cells,DFPCs)和牙龈间充质干细胞(gingival mesenchymal stem cells,GMSCs)等[6]。这些干细胞主要来自于阻生智齿、正畸拔除的前磨牙、脱落乳牙等医疗丢弃组织,取材方便,无医源性创伤;且均具有多向分化潜能、易分离培养、核型稳定、增殖速率高等特点[5]。近年来,牙源性干细胞在组织损伤修复以及组织再生等领域的应用受到了大量的关注,但同时干细胞治疗也存在一些问题如免疫排斥、干细胞遗传物质变异、体外扩增保存不易、伦理等问题[7-8]。而外泌体既保留了MSCs的功能又避免细胞移植相关的限制和风险,具有较广的应用价值。本文将对牙源性干细胞来源的外泌体在组织修复与再生方面的研究进展进行探讨。
1 外泌体概述
外泌体是体内活细胞分泌的一种膜性小囊泡,属于胞外囊泡(extracellular vesicles,EVs)的一种,可介导细胞相互间信息的传递[9]。外泌体在核内体网中形成,当多囊泡小体与胞膜融合时释放出细胞,直径在30~150 nm之间。研究发现不同细胞来源的外泌体具有不同的功能,其携带的信号分子包含脂质、蛋白质、DNA、mRNAs、miRNA以及siRNA等,均与它们存在的微环境紧密相关[10]。外泌体通过配体/受体识别,大胞饮、内吞、吞噬或直接与受体细胞胞膜融合等方式,进入到受体细胞内,并将携带的信号分子释放到受体细胞中,从而触发了受体细胞或器官中必要的分子反应[11]。外泌体在许多疾病如癌症、免疫系统疾病、感染和心脏大血管疾病等的生理和病理过程中充当了不可忽视的角色[12-13]。
大量的证据表明外泌体参与了组织损伤修复和再生的过程,因此我们有可能利用这些天然粒子启动复杂的生物学过程来促进组织损伤修复与再生。与运送细胞及细胞因子到达体内组织的传统方式相比,外泌体的优势在于[10]:首先,外泌体含有多种生理性相关因子及蛋白,可以同时激活目标组织的多种通路,有利于提高治疗效果,且由于其是天然来源,故具有较好的生物相容性和稳定性;其次,外泌体不含遗传程序,不会引起目标细胞的基因修饰或改造;再次,外泌体比较稳定,一般不会改变表型,治疗结果具有可重复性和可预测性。基于以上优势,外泌体在各个方面已崭露头角。外泌体可以促进血管内皮细胞增殖、迁移以及促血管化相关基因的表达和蛋白分泌,不仅可以促进新血管的形成,还可以加速它们在损伤位点的成熟[14]。同时外泌体在神经系统中也扮演着重要的角色,可以调节髓鞘形成、神经元的生长和存活以及清理病理性蛋白等[15]。另外,研究表明MSCs来源的外泌体具有抗炎和免疫调节功能,促进了巨噬细胞的极化和增殖[16]。而近年来人们发现外泌体在骨组织和牙组织再生方面也有较好的效果:研究发现人脂肪干细胞来源的外泌体锚定在PLGA支架上有效促进了骨再生[17]。MSCs来源的外泌体与脱矿骨基质支架复合有效促进了血管化和骨再生[18]。人类诱导多潜能干细胞来源的外泌体与磷酸三钙支架复合,可通过激活PI3K/Akt通路促进成骨分化(在缺损模型中显著促进了血管化和骨再生)[19]。牙齿的发生是由表皮-间充质间的交流以及各种生长因子共同调节完成的。外泌体在表皮-间充质间的交流中扮演着重要角色。研究表明,表皮来源的外泌体促进了MSCs的成牙分化和矿化,而MSCs来源的外泌体诱导表皮细胞产生了基底膜的复合物、釉原蛋白和成釉蛋白[20]。除了以上外泌体,牙齿组织如牙髓细胞、牙周膜细胞以及牙齿来源的MSCs也能分泌外泌体,它们在组织损伤修复及再生过程中也发挥着重要作用。
2 牙源性干细胞来源的外泌体的生物学功能
牙源性干细胞通过内分泌和/或旁分泌外泌体作用与不同类型的靶细胞进行细胞间通信,广泛参与细胞生物学活动的调控。
2.1 促血管再生作用
牙髓作为牙齿内部唯一的软组织,在其修复再生营养供给和疾病防御等方面起着重要的主导作用,血管生成是牙髓再生的关键。冼雪红等[21]通过研究发现牙髓细胞来源的外泌体促进了血管内皮细胞的增殖、促血管形成相关因子的表达以及管腔的形成,在此过程中通过抑制p38 MAPK信号通路提高了管腔形成能力。柳鑫等[22]也发现不同浓度的人牙髓干细胞(hDPSCs)外泌体可提高内皮细胞的增殖活性,且其增殖促进作用具有浓度依赖性,可诱导内皮细胞形成管腔,这表明hDPSCs来源的外泌体可促进内皮细胞血管生成。以上均表明牙源性干细胞来源的外泌体能够促进牙髓血管的修复再生。
2.2 免疫调节作用
巨噬细胞在炎症环境及组织再生调控中扮演着重要的角色,其两种亚型分别起到促炎(M1)和抗炎(M2)的作用。而促进巨噬细胞由促炎的M1型向抗炎的M2型转化,对于实现调控组织再生显得尤为重要。王巧云等[23]通过提取大鼠牙髓干细胞(rDPSCs)的外泌体,构建皮肤缺损模型,检测外泌体处理的皮肤创伤组织中巨噬细胞向不同亚型极化相关因子的表达,发现外泌体能够促进巨噬细胞向M2型极化,可能促进皮肤组织的修复再生。此外,苏晓磊等[24]利用脂多糖(LPS)诱导大鼠急性肺损伤,并分别用LPS和LPS联合的DPSCs外泌体处理损伤肺泡巨噬细胞,结果显示经过高剂量DPSCs外泌体处理后的大鼠肺泡巨噬细胞内TNF-α和IL-1β表达量明显降低,表明外泌体对LPS诱导的急性肺损伤有保护作用,其机制可能与抑制MAPK通路和激活NF-κB信号通路有关。此外,研究发现SHED来源的外泌体具有抑制急性期炎症反应的作用,且可以保护多巴胺能神经元免受氧化应激引起的凋亡,对如炎症和氧化应激等病理过程具有保护意义[25-26]。同时,王孟宏等[27]研究发现SHED来源的外泌体miR-100-5p能够抑制哺乳动物雷帕霉素靶蛋白(mTOR),缓解颞下颌关节骨关节炎,抑制髁突软骨细胞的炎症反应,而且SHED来源的外泌体可以通过移动小胶质细胞极化来减少神经炎症,可改善大鼠运动功能恢复,减少皮质损伤[28]。Zheng等[29]也发现PDLSCs来源的外泌体能通过Th17/Treg/miR-155-5p/SIRT1调节作用减轻炎症微环境网络,能最大限度地控制多个下游损伤信号因子,可能为牙周炎治疗寻找新的靶点。外泌体由于通过诱导细胞分泌抗炎细胞因子和促进M2巨噬细胞的形成,因而被认为是MSCs免疫调节作用的驱动力[30-31]。
2.3 促成牙分化作用
施万(Schwann)细胞是成牙本质细胞的主要来源。Li等[32]发现来自hDPSCs的外泌体,特别是来自LPS预处理的hDPSCs,可以促进Schwann细胞的增殖,迁移和牙源性分化,它们可以迁移到损伤部位,并在牙齿发育和再生过程中分化为成牙本质细胞。Hu等[33]通过研究DPSCs来源的外泌体的micro RNA表达谱,表明了在成牙分化诱导条件下分离的DPSCs来源的外泌体是诱导DPSCs分化的较好诱导因子。同时,Huang等[34]研究发现,成牙分化诱导条件下牙髓细胞来源的外泌体更好地促进了DPSCs和骨髓间充质干细胞的成牙分化,当其与DPSCs复合后在体内牙齿切片上促进了牙髓样组织再生。此外,蒋欢[35]也证明了SCAP来源的外泌体能够被大鼠的骨髓间充质干细胞内吞,促进其向成牙本质分化和矿化结节的形成。Ivica等[36]研究发现牙髓细胞来源的外泌体能促进人骨髓间充质干细胞的迁移与增殖,且此外泌体可在纤维蛋白水凝胶中实现有效缓释,为通过以干细胞归巢的方式实现无髓牙齿牙髓再生提供新的技术支持。综上所述,牙源性干细胞来源的外泌体在促进细胞的迁移和成牙分化方面具有重要价值。
2.4 促进骨损伤修复
口腔颌面部是人体的重要器官,牙槽骨因感染、外伤等原因造成的缺损是口腔颌面部常见的疾病之一[37]。外泌体在生理和病理条件下对骨重建有很好的作用,另外,PDLSCs与骨损伤修复也存在着密不可分的关系,在牙周组织再生中具有重要作用[38]。Chew等[39]发现,MSCs外泌体载胶原蛋白海绵有效地修复了缺损促进了牙周组织的骨和牙周膜再生,推测MSCs来源的外泌体可通过增加细胞的运动和增殖来促进牙周组织再生。费栋栋[40]也证实PDLSCs内部不同细胞存在成骨异质性,其外泌体在介导细胞成骨分化中具有重要作用。
2.5 治疗神经退行性病变

2.6 其他方面
口腔内的伤口愈合速度会比其他部位的伤口愈合速度要快,牙龈组织的修复速度大约是皮肤损伤修复速度的两倍,其中很重要的原因之一就是GMSCs,而外泌体作为旁分泌的主要成分,传递信息物质、参与细胞间通讯,在GMSCs发挥修复作用的过程中具有重要的作用。时权等[42]研究发现,GMSCs来源的外泌体联合壳聚糖/丝素蛋白凝胶海绵能有效促进糖尿病皮肤创面的修复。同时,Zhang等[43]研究发现GMSCs及其外泌体与小肠黏膜下-细胞外基质(SIS-ECM)或其外泌体的联合移植能够促进舌乳头的恢复、味蕾再生和神经支配,为舌癌患者术后的舌重建提供了可能。此外,牙源性干细胞来源的外泌体在抗肿瘤方面也发挥着重要作用。Stanko等[4]发现用氧化铁纳米粒子标记DPSCs能够维持体内肿瘤的趋化性,且由自杀基因yCD:UPRT导入的DP-MSCs释放的外泌体能够很容易穿透整合人类的肿瘤细胞,在前药5-氟胞嘧啶的存在下,诱导肿瘤细胞凋亡。
3 总 结
外泌体是由各种细胞分泌的一种直径为30~150 nm、由脂质双分子层包裹的微囊泡结构,富含多种生物分子、生物蛋白和核酸。外泌体可通过旁分泌或内分泌方式作用于靶细胞,实现其生物学功能。其具有免疫调节作用,具备“促炎和抗炎”的双重功能,是组织损伤修复不可或缺的因子[44];且可以介导细胞间信息传递及特殊功能的分子转移,对于促组织修复再生具有重要作用[45-46],近年来的研究表明外泌体可能是一种很有前景的干细胞替代物,可能成为“无细胞治疗”的有效手段[34,47-48],具有广阔的临床应用前景。
牙源性干细胞由于取材方便,易于培养,且具有神经源性等优势,使其外泌体在组织损伤修复与组织再生领域成为潜在的优势资源。文中引用的多项研究表明,牙源性干细胞来源的外泌体在血管再生、免疫调节、成牙分化、骨损伤修复、治疗神经退行性病变以及皮肤、味蕾再生、肿瘤治疗等方面均已取得较好的疗效(图1)。根据现有的研究,来源于牙齿不同部位的干细胞分泌的外泌体都有其独特的功能,比如DPSCs来源的外泌体功能更多体现在血管再生、免疫调节以及治疗神经退行性疾病方面,而PDLSCs来源的外泌体功能则更多体现在牙周膜和骨组织再生方面,这与其来源的干细胞的生物学特性是紧密相关的。当然目前对于牙源性干细胞来源外泌体的研究仍处于早期阶段,研究也仅限于对于每种外泌体单一功能的研究,尚没有在各个领域进行系列研究,因此还有许多未知的领域等待我们探索和发现。
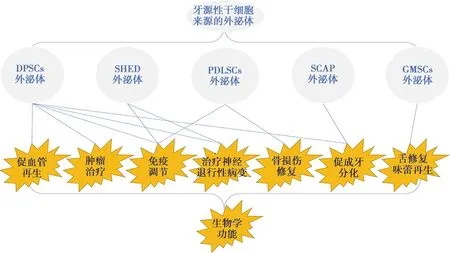
图1 牙源性干细胞来源的外泌体的生物学功能
目前,关于外泌体的研究仍存在一些问题:①外泌体的提取和鉴定尚无明确统一的标准,提取方法并不能保证在足够产量的前提下得到较高纯度的外泌体,仍需改进提取方法或开发新的方法;②外泌体在组织损伤修复以及再生过程中的潜在作用机制仍不清楚,其中哪些成分参与了此过程并发挥作用仍需研究;③在组织再生领域,外泌体到达目标组织会出现大量的流失,无法达到有效作用浓度,如何实现外泌体的有效缓释并研究其作用于目标组织的有效浓度仍是亟待解决的问题。
——外泌体与老年慢性疾病相关性的研究进展

