花椰菜BraERF023a的克隆及在响应盐和干旱胁迫中的功能
李慧,韩占品,贺丽霞,杨亚苓,尤书燕,邓琳,王春国
1天津农学院园艺园林学院,天津 300384;2南开大学生命科学学院,天津 300071
0 引言
【研究意义】ERF转录因子隶属于AP2/ERF转录因子超家族,在植物响应逆境胁迫中发挥重要作用。花椰菜是重要的蔬菜作物,土壤盐渍及干旱是造成花椰菜种植减产的主要环境灾害。但对花椰菜响应盐及干旱胁迫的分子基础认识十分有限,这已成为采用分子育种等手段创制花椰菜抗逆新种质及培育新品种的重要瓶颈。因此,克隆ERF等逆境应答相关转录因子或基因并阐释其功能,对开展抗逆花椰菜分子育种及基因靶向育种具有重要意义。【前人研究进展】植物在生长发育过程中需要不断应对持续变化的不利环境,如动物啃食、病原体侵染等生物胁迫和干旱、高温、土壤盐渍等非生物胁迫。这其中干旱、盐害及温度胁迫是影响植物地理分布,造成农作物减产甚至绝收的主要环境灾害[1]。因此,阐释植物响应逆境胁迫的分子基础及调控机制,进而在作物中开展抗逆分子育种一直是植物学研究的前沿及热点领域。已有研究表明,WRKY、MYB、bZIP、NAC和AP2/ERF等转录因子家族成员在植物生长发育及响应各类逆境胁迫中发挥重要作用[2-3],其中 AP2/ERF转录因子家族为植物所特有。该家族成员具有参与 DNA结合的AP2保守结构域,该结构域约由60个氨基酸残基按照3个β折叠和1个α螺旋的方式构成一个典型三维结构[4-6]。根据 AP2结构域的数量和识别序列的不同,AP2/ERF转录因子家族可以分为 AP2、ERF、DREB、RAV和Soloist 5个亚家族[7-8]。其中ERF亚家族只含有1个AP2结构域,被证实主要通过识别并特异性结合各类胁迫响应相关基因顺式作用元件,而在植物抵抗各种逆境胁迫过程中发挥重要的调控作用[6,9]。水稻中ERF亚家族成员SNORKEL1(SK1)和SNORKEL2(SK2)可以促进水稻节间伸长,从而使植株可以在深水环境中存活[10]。在拟南芥中过表达菊花CmERF053的研究表明,CmERF053可能参与细胞分裂相关的侧枝形成调控途径,同时在植物抵御干旱胁迫中发挥作用[11]。大豆中GmERF6能够被干旱诱导表达,将GmERF6在拟南芥中过表达可显著提高转化株的抗旱性[12]。在拟南芥中过表达甜薯IbRAP2-12和芜菁BrERF4同样也可提高转化株对盐和干旱胁迫的耐受性[13-14]。PARK等[15]研究发现拟南芥AtERF71/HRE2功能缺失可使突变株表现为盐敏感,而将AtERF71/HRE2转入突变体中,植株表现出耐盐性,可成功抵抗渗透胁迫,且提高转化株对低氧胁迫的耐受能力。此外,研究证实,辣椒的CaERFLP1[16]和CaPF1[17],番茄的TERF1[18]和JERF1[19]以及小麦中TaERF1[20]的过表达均可显著提高转化株对盐及低温等逆境的适应能力。综上所述,ERF转录因子已被证实在植物响应逆境胁迫,特别是非生物逆境胁迫中发挥重要作用。【本研究切入点】虽然在不同植物中已有多个ERF转录因子被克隆并证实其在逆境应答中发挥重要作用,但对ERF转录因子在花椰菜逆境应答中的功能及调控机制仍知之甚少。笔者实验室前期对花椰菜中的AP2/ERF家族成员采用高通量转录组测序方法进行了分析,从中筛选、鉴定到146个ERF转录因子,并证实包括BraERF025a等在内的多个ERF亚家族成员在盐及干旱胁迫前后呈现显著差异表达特征[21]。进一步的分子进化树分析结果表明BraERF023a是与BraERF025a同属于一个进化分支的ERF亚家族成员,二者具有较近的亲缘关系[21]。但BraERF023a是否也响应盐及干旱胁迫,且其是否在花椰菜抵抗盐及干旱胁迫中发挥作用仍未知。【拟解决的关键问题】对花椰菜中的BraERF023a进行克隆,揭示其序列特征,以及在盐及干旱胁迫条件下的表达特征,并通过过表达分析阐释BraERF023a在盐及干旱胁迫应答中的功能。
1 材料与方法
试验于 2017—2019年在南开大学生命科学学院植物细胞及分子遗传学实验室进行。
1.1 试验材料
供试花椰菜‘津品 70’种子由天津市科润蔬菜研究所孙德岭研究员惠赠。拟南芥为哥伦比亚生态型。克隆载体pEASY-T1购自北京全式金生物技术有限公司。植物表达载体pCAMBIA3301、大肠杆菌DH5α、农杆菌菌株LBA4404由笔者实验室保存。
1.2 DNA提取
野生型和过表达BraERF023a转基因拟南芥、花椰菜幼苗新鲜组织,于研钵中加入液氮快速研磨成粉末状,采用经典CTAB法提取DNA。ddH2O于4℃过夜溶解DNA沉淀。在溶解液中RNase A于37℃金属浴中反应 2 h除去 RNA。NanoDrop®ND-1000检测DNA浓度和质量。高质量的DNA于-20℃保存备用。
1.3 RNA提取及反转录
参照植物总 RNA提取试剂盒的操作说明提取花椰菜及拟南芥叶片总RNA。NanoDrop®ND-1000检测提取RNA的浓度,2%琼脂糖凝胶电泳检测RNA完整性。采用M-MLV反转录酶合成cDNA第一链(具体操作参照Promega公司的M-MLV反转录说明书进行)。
1.4 花椰菜不同逆境胁迫处理
待花椰菜幼苗长至四片真叶时,将幼苗从营养土中取出,自来水缓缓冲洗根部,注意不要伤害到根系,随后将幼苗分为两组,每组至少16个单株。将其中一组幼苗根部直接浸入含有 200 mmol·L-1NaCl的水溶液进行盐胁迫处理;另外一组幼苗根部浸入含 20% PEG6000的水溶液中进行模拟干旱处理。分别在0、4、8、12和24 h时摘取叶片并进行总RNA提取。提取的RNA反转录合成cDNA第一链,-80℃保存备用。
1.5 不同胁迫处理条件下BraERF023a表达特征的定量表达分析
采用 qRT-PCR方法对花椰菜不同胁迫处理下BraERF023a的表达特征进行分析。反应体系为20 μL,其中含有10 μL 2×SYBR Green反应mix(罗氏公司)、1 μLBraERF023a定量引物(表 1)。以花椰菜BraActin为内参,采用2-ΔΔCT法进行定量数据分析。
1.6 BraERF023a植物过表达载体构建
以花椰菜cDNA为模板扩增具有NcoI和BstE II酶切位点的BraERF023a编码区cDNA。将BraERF023a的PCR扩增产物与pEASY-T1克隆载体连接(参照说明书),采用热激法将重组载体转化大肠杆菌DH5α。利用NcoI-BraERF023a-F/BstE II-BraERF023a-R引物组合对阳性克隆进行鉴定(表 1),并进一步对阳性克隆进行测序分析。对含有BraERF023a正确序列的阳性克隆及pCAMBIA3301表达载体分别进行NcoI和BstE II双酶切,回收酶切片段,利用T4 DNA连接酶将BraERF023a连接至 pCAMBIA3301载体的CaMV 35S启动子下游,筛选获得 35S::BraERF023a重组表达载体。采用热激法转化农杆菌LBA4404,利用BraERF023a特异引物和组合引物(35S-F/BraERF023a-R)对农杆菌阳性转化菌株进行分子鉴定(表1)。将含有35S::BraERF023a重组质粒的农杆菌采用浸花法遗传转化拟南芥。

表1 BraERF023a克隆、载体构建和定量RT-PCR分析引物序列Table 1 Primers used for BraERF023a cloning, vector construction and qRT-PCR assay
1.7 农杆菌介导BraERF023a过表达载体遗传转化拟南芥
于 250 mL液体 YEB培养基中,扩大培养含有35S::BraERF023a重组质粒的阳性农杆菌,使其OD600值约为1.2—1.6,5 500 r/min离心10 min收集菌体,用500 mL 5%的蔗糖溶液(含终浓度为0.05%的silwet L-77)重悬菌体,配成转化液。于盛花期将拟南芥花序浸入转化液中浸染30 s,用保鲜膜包好植株,平置于托盘中避光培养24 h,7 d后再次转化,两次转化完成后将拟南芥置于培养室中继续培养至种子成熟,收集种子,记为T0代。
1.8 BraERF023a过表达拟南芥的抗性筛选及鉴定
将春化后的BraERF023a转基因T0代拟南芥种子种于营养土中,待其长出两片真叶后,喷洒稀释10 000倍的 Basta溶液,对转化株进行抗性筛选。对筛选获得的T0、T1、T2和T3代抗性转化株进一步提取其DNA,利用特异引物(BraERF023a-F/BraERF023a-R)和组合引物(35S-F/BraERF023a-R)进行 PCR扩增(表1),检测BraERF023a是否已整合到拟南芥基因组中。进一步提取 T3代纯合抗性转化株RNA,以qBraERF023a-F/qBraERF023a-R为引物,采用qRT-PCR方法检测BraERF023a在拟南芥转化株中的表达特征,收获纯合的T3代转化株种子用于后续分析。
1.9 BraERF023a过表达拟南芥的表型及抗性分析
将 T3代过表达BraERF023a拟南芥转化株系和野生型对照种子同时播种,在相同的环境条件下进行培养,并对其株高、茎粗、抽薹时间、分枝数目、果荚长短等表型进行观察。此外,待过表达BraERF023a拟南芥转化株系和野生型对照长至3周时,在一次性浇足水后7 d,改为浇灌200 mmol·L-1NaCl溶液进行为期3周的盐胁迫处理,3周后观察二者在盐胁迫下的表型变化。对长至3周的过表达BraERF023a拟南芥转化株系和野生型对照在一次性浇足水后,停止浇水并进行为期20 d的干旱胁迫处理,之后复水,观察复水10 d后二者的干旱胁迫表型并统计其存活率。
2 结果
2.1 BraERF023a的克隆及序列分析
分别以花椰菜DNA、cDNA为模板,利用特异性引物组合BraERF023a-F/BraERF023a-R扩增BraERF023a的全长编码区(表 1)。扩增产物的电泳检测结果表明,无论是以DNA还是cDNA为模板均能扩增出一条约600 bp的特异条带,其长度与前期转录组测序获得的BraERF023a序列长度一致,证实花椰菜BraERF023a序列中无内含子。进一步对扩增产物进行TA克隆及测序,测序结果显示,BraERF023a编码区全长597 bp,预期编码一个含有198个氨基酸的蛋白质(图1)。序列分析发现,BraERF023a包含一个AP2保守结构域,该结构域包含3个β折叠和1个α螺旋,且保守结构域中第14和19位氨基酸分别为丙氨酸和天冬氨酸,均符合ERF转录因子的典型结构特征(图1)。进一步利用ProtFun 2.2 Server(http://www.cbs.dtu.dk/services/ProtFun/)对BraERF023a的蛋白功能进行预测分析。结果显示,BraERF023a可能主要在植物生长发育及转录调控两个过程中发挥作用。此外,序列比对及聚类分析结果显示,BraERF023a与B.napus、B. oleracea、B. rapa等十字花科芸薹属其他植物中的ERF023序列具有较高相似性(大于90%),而与水稻、玉米、高粱等禾本科植物中的ERF023相似性较低,表明ERF023在十字花科芸薹属作物中具有较高保守性,其可能具有相似的功能。
2.2 BraERF023a在盐胁迫和模拟干旱处理条件下的表达特征
200 mmol·L-1NaCl盐处理条件下,BraERF023a的表达量随着处理时间的延长显著升高,表明盐胁迫处理可以显著诱导BraERF023a的表达(图2-a)。与其相似,在 20%的 PEG6000模拟干旱胁迫处理条件下,花椰菜中的BraERF023a在胁迫处理后不同时间段的表达量均显著高于处理前(图 2-b),表明BraERF023a不但正向响应盐胁迫,也受干旱胁迫的诱导表达。
2.3 BraERF023a表达载体构建及鉴定
分别采用基因特异引物(BraERF023a-F/BraERF023a-R)和组合引物(35S-F/BraERF023a-R)进行菌液PCR,鉴定重组载体是否已成功转入农杆菌中。随机挑取6个阳性克隆进行检测,PCR产物的电泳结果显示在 6个阳性克隆中均可检测到长度约为 600 bp和1 100 bp的特异性条带(图3-a),条带大小均符合预期,表明 35S::BraERF023a过表达载体已成功转入农杆菌中。
2.4 BraERF023a过表达拟南芥转化株系筛选及分子鉴定
野生型拟南芥于盛花期经农杆菌浸花法侵染后培养至种子成熟,记为T0代,T0代种子萌发后进行Basta抗性筛选。筛选结果显示,绝大部分幼苗叶片逐渐黄化,26个植株生长发育状况正常,初步鉴定为抗性转化株系。随机选取其中 10个抗性转化株系分别进行DNA水平及转录水平的分子鉴定。以DNA为模板,采用BraERF023a特异引物及BraERF023a与载体序列组合引物分别进行PCR检测,在其中5个株系中可以分别扩增出与预期大小一致的约600 bp和1 100 bp的特异性条带,表明BraERF023a已成功整合到这些株系的基因组中(图3-b)。进一步采用qRT-PCR方法对BraERF023a在这5个阳性株系中的表达特征进行分析。结果显示,BraERF023a在这 5个株系中的表达水平显著高于野生型对照(图 3-c),证实BraERF023a不但成功整合到转化株基因组内,并且实现在转化株的高表达。将这5个T0代植株进行多代自交纯合,T3代株系用于后续分析。
2.5 BraERF023a过表达转基因拟南芥表型分析
为揭示BraERF023a在拟南芥中过表达是否影响转化株的生长发育,对过表达BraERF023a转基因拟南芥在正常生长条件下不同生长阶段的表型特征进行观察、分析。结果显示,幼苗生长初期(3周以前),过表达BraERF023a转基因拟南芥株系与对照相比无明显差异,但在幼苗生长3周后,过表达BraERF023a转化株系的长势明显优于对照(图4)。待植株进入成熟期,对其株高、分枝数目等表型特征进行统计分析。结果显示,过表达BraERF023a转化株系相对于对照植株表现为植株更高、分枝数目更多、花茎更粗,整体生物量增加。但二者花序大小及果荚长度无明显差异。在抽薹时间方面,过表达BraERF023a转化株系比对照滞后约一周(表2)。上述结果表明,在拟南芥中过表达BraERF023a对转化株的生长发育有一定影响,其可以促进转化株的生长发育,延长其抽薹期,但对转化株育性、结种量无显著影响。
2.6 BraERF023a过表达转基因拟南芥盐胁迫分析
BraERF023a过表达转基因拟南芥和野生型对照经盐胁迫后生长均受到一定抑制。但对照组拟南芥叶片萎蔫黄化严重甚至全部枯萎,植株存活率低;而过表达BraERF023a转化株系叶片虽也发生黄化,但程度显著低于对照(图5),且尽管受到盐胁迫,BraERF023a过表达转化株植株最终的存活率(86%)显著高于对照组(41%)。表明在拟南芥中过表达BraERF023a可以提高转化株抵御盐胁迫的能力。
2.7 BraERF023a过表达转基因拟南芥干旱胁迫分析
干旱胁迫处理20 d后,BraERF023a过表达转化株系和野生型植株均萎蔫严重,但野生型植株基本已全部萎蔫黄化至死亡,而BraERF023a过表达转化株系萎蔫黄化程度相对野生型较轻,部分转化株系叶片仍保持绿色(图6)。对所有干旱处理植株进行复水,复水10 d后,其中2个过表达BraERF023a转化株系中(L8、L9)的大部分植株恢复生长,而对照组绝大部分已枯萎(图 6)。且过表达BraERF023a转化株系的存活率显著高于对照组(图 7)。表明在拟南芥中过表达BraERF023a可以显著提高转化株的耐旱性。
3 讨论
3.1 BraERF023a在植物中的分子进化特征分析
AP2/ERF转录因子最初在植物中被发现。1994年 JOFUKU等[4]从模式植物拟南芥中分离到第一个AP2转录因子APETALA2,该转录因子与花发育和种子萌发有关。随后AP2/ERF转录因子家族成员陆续从不同植物中被鉴定、克隆,并证实其为植物所特有。基因结构分析表明AP2/ERF家族成员均含有保守的AP2结构域[5]。根据AP2结构域的数目及序列特征,AP2/ERF家族中的ERF亚族和DREB亚族均含有单个的AP2结构域[6],但是AP2结构域第14位和第19位氨基酸残基在两者中不同。ERF亚族成员AP2结构域的第14位和19位分别为丙氨酸和天冬氨酸,而DREB亚族成员该结构域第14位和19位分别为缬氨酸和谷氨酸[7]。通过对BraERF023a的序列分析发现,其具有1个AP2结构域,并且保守结构域第14位和19位分别为丙氨酸和天冬氨酸,符合ERF亚族成员的典型结构特征,证实其为ERF转录因子。已有研究证实ERF转录因子可与GCC盒(AGCCGCC)等下游靶基因的顺式作用元件结合,从而在基因转录调控中发挥作用[9,22]。进一步的序列比对发现,BraERF023a与双子叶植物,特别是与花椰菜同属于十字花科芸薹属的其他植物中的ERF023在进化上具有较高保守性,而与单子叶植物中该转录因子的序列同源性较低,暗示BraERF023a在祖先植物进化形成单子叶和双子叶植物时,序列已发生分化,但其功能是否也发生了亚功能化,有待进一步探究。在克隆并揭示BraERF023a序列及表达特征基础上,通过遗传转化策略将其在花椰菜中进行过表达,并分析过表达BraERF023a花椰菜转化株系生长发育及在逆境胁迫条件下的表型及生理特征,对于阐释BraERF023a的功能具有重要价值。但花椰菜遗传转化效率受材料基因型、遗传背景等因素影响很大,不同基因型材料遗传转化效率普遍不高,很难在短期内获得转化株系,即使获得了转化株系,很多转化株系也不能正常结籽。因此,转化效率低及结籽困难一直是花椰菜基础研究进展缓慢的一个重要瓶颈。基于此,本研究为探究花椰菜BraERF023a的功能,首先将其转入到易于转化的模式植物拟南芥中进行功能分析。BraERF023a在花椰菜中过表达及采用CRISPR/Cas9基因编辑技术敲除的工作正在进行中。
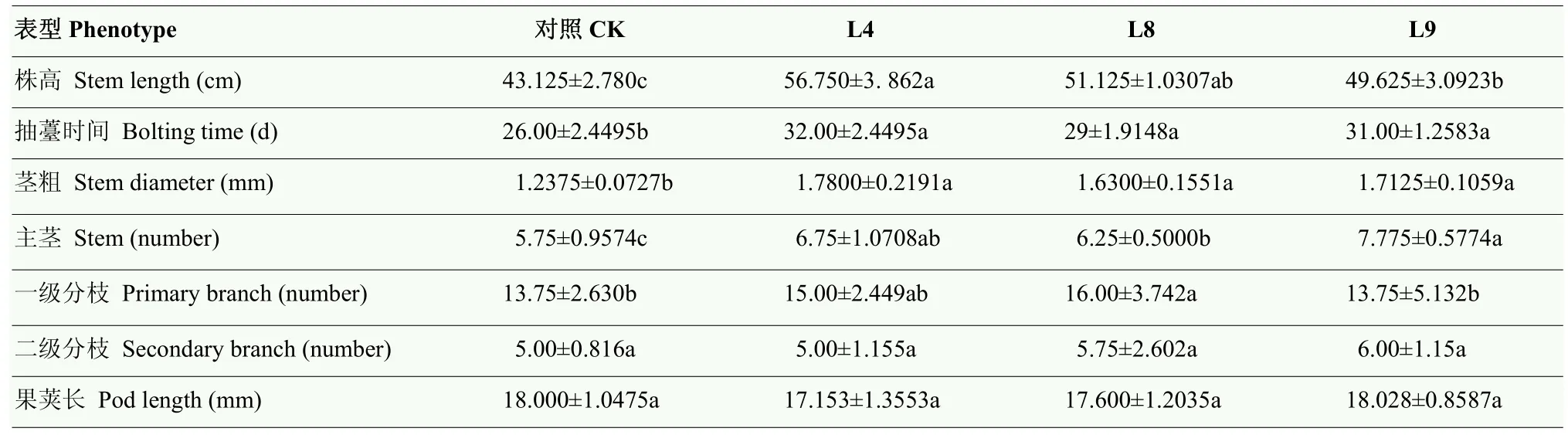
表2 过表达BraERF023a转基因拟南芥表型分析Table 2 Phenotypic analysis of overexpression BraERF023a transgenic Arabidopsis
3.2 BraERF023a响应盐和干旱胁迫分析
已有研究表明,ERF转录因子亚家族成员主要在植物逆境响应中发挥作用。但不同植物来源的ERF成员或同一植物中不同的ERF成员对逆境胁迫的响应特征不尽相同。JERF1在烟草中过表达可增强转化株对低温及高盐的耐受[23]。拟南芥AtERF1的表达受ABA负调控,其过表达导致ABA积累和脯氨酸增加,进而增强转化株对干旱、高盐和热胁迫的耐受性[24]。过量表达MdERF72的苹果愈伤组织在高盐和低温胁迫处理下,生长势明显强于野生型对照,表明MdERF72在响应高盐、低温胁迫过程中发挥着重要的正调控作用[25]。苜蓿中 ERF转录因子MfERF1过表达可促进转化株多胺的合成与转化,提高植株抗氧化能力和脯氨酸积累,进而提高转化株对低温的耐受[26]。BOLT等[27]研究发现ERF105在拟南芥对冻害的耐受性中发挥重要作用,是拟南芥冷驯化中所必需的转录调控因子。ERF102和ERF103也被证实在拟南芥冷驯化中扮演重要角色[28]。有关花椰菜中ERF转录因子的报道很少。笔者课题组前期的研究表明,在花椰菜中至少存在146个ERF成员,这其中绝大部分成员的功能未知[21]。本研究结果表明,盐及干旱逆境胁迫可显著诱导花椰菜中BraERF023a的表达,暗示BraERF023a是一个盐及干旱正向响应应答因子。进一步的过表达功能分析表明,在拟南芥中过表达BraERF023a可显著提高转化株对盐及干旱胁迫的耐受。该结果进一步证实,BraERF023a在植物耐盐及抗旱应答中发挥重要的正向调控作用。此外,前期研究结果表明花椰菜中除BraERF023a外,还具有一个BraERF023a的等位变异,命名为BraERF023b,其编码区长度为567 bp,比BraERF023a少30 bp[21]。在花椰菜中BraERF023b是功能性冗余还是具有其他功能有待进一步探究。目前,有关不同植物中ERF023的研究很少。在杏桃干旱胁迫响应的研究中发现,干旱胁迫可诱导其内PpERF023的表达,暗示PpERF023在干旱胁迫应答中发挥重要作用[29]。杏桃ERF023在拟南芥中的同源基因AtHARDY被证实在提高植株的水分利用效率,提高对干旱胁迫的适应能力过程中发挥重要作用[30]。这暗示不同植物来源的ERF023在干旱胁迫应答中可能发挥重要作用,但其是否也都参与盐胁迫应答并发挥作用有待进一步探究。在葡萄中的研究表明,ERF023可能参与葡萄对病原菌的防御,其过表达在提高葡萄对灰霉病的抗性方面有一定作用[31]。暗示ERF023不但在非生物逆境胁迫中发挥作用,也响应生物胁迫。因此,进一步克隆不同植物中的ERF023,并揭示其对不同逆境胁迫响应的分子机制,对于阐释ERF类转录因子的功能具有重要意义。
3.3 BraERF023a在生长发育中的功能分析
尽管大部分研究表明ERF类转录因子主要在植物响应逆境胁迫中发挥作用。但也有研究表明一些ERF转录因子参与植物生长发育调控。如拟南芥中ERF转录因子家族成员TINY可抑制植物激素BR调控的生长发育过程,同时也调控植株对干旱的胁迫反应。TINY过表达可导致植物生长发育迟缓[32]。在水稻中ERF转录因子OsEATB可通过下调赤霉素生物合成基因限制节间伸长,导致植株矮化[33]。NAKANO等[34]研究表明,番茄SlERF52在花梗离区特异表达,其在花梗脱落中发挥重要作用。过量表达拟南芥AtERF019不但可以提高植物的耐旱性,还可以延迟植株生长和衰老[35]。在黄瓜中鉴定出 138个ERF家族成员,其中多个成员被认为在雌花发育过程中发挥调控作用[36]。本研究结果表明,正常生长条件下,在拟南芥中过表达BraERF023a可使转化株表现出显著不同于野生型对照的生长发育特征,如相对于野生型对照,过表达BraERF023a转基因拟南芥植株更高,主茎加粗,莲座和一级分枝数增多、生物量提高等,并且过表达转化株的抽薹时间延长,致使其生长期延长(表2、图4)。该结果表明在拟南芥中过表达BraERF023a可以促进转化株的生长发育,暗示BraERF023a不但是一个盐及干旱胁迫响应的正向调控因子,其在植物生长发育调控过程中也可能发挥重要作用,有待对其调控机制进行深入探究。
4 结论
花椰菜BraERF023a含有一个保守的AP2结构域,其与十字花科芸薹属植物中的ERF023具有较高序列同源性。转录表达特征分析证实盐及干旱胁迫可显著诱导BraERF023a的表达。在拟南芥中过表达BraERF023a可促进转化株的生长发育,并显著提高转化株对盐及干旱胁迫的耐受力。结果证实,BraERF023a在植物响应盐及干旱胁迫中发挥重要的正向调控作用,是一个优质耐盐抗旱基因,在花椰菜抗逆分子育种中具有重要应用价值。

