烟草赤星病拮抗芽胞杄菌的筛选、鉴定及促生防病作用
王雯丽 曾庆超 李燕 夏博 黄林祥 吴元华 王琦


摘要:为获得对烟草赤星病菌具有较好生防效果的芽胞杆菌,从福建、山东、云南等地烟草叶片中分离得到187株菌株,对烟草种子进行浸种处理,通过测定发芽率筛选到能够促进种子萌发的6株菌株;利用平板拮抗法、离体叶片接种法、温室生测发现FJ1、FJ-6能促进烟草生长且对赤星病防效较好;通过生理生化和分子生物学鉴定,FJ1为萎缩芽胞杆菌(Bacillus atrophaeus),FJ6为贝菜斯芽胞杆菌(Bacillus velezensis)。防病特性研究发现,两菌株含有参与脂肽类抗生素Surfactin、Fengycin和Iturin合成的基因且脂肽类粗提物对赤星病菌丝生长有明显的抑制作用,抑制率分别为59%、650%。综上FJ、FJ1-6具有优良的促生防病特性及显著的促种子萌发效应,可应用于烟草育苗及赤星病的防治
关键词:烟草赤星病;筛选;芽胞菌;生物防治
烟草(Nicotiana tabacumI.)是我国重要的经济作物,种植面积和产量均居世界首位。近年来,烟草病害的不断发生,给烟农带来的经济损失不容小觑。其中,烟草赤星病(Alternaria alternata)是我国烟叶生产中的主要叶部病害,危害较重。据调査该病给我国烟叶带来的影响位居第二,仅次于病毒病。该病主要发生在成熟期,一且发生便会迅速扩展,严重降低烟叶产量和质量。目前烟草赤星病主要采用化学防治,但化学药剂长时间施用病菌易产生抗药性,降低防效且污染环境,生长后期施用还会出现药剂残留,影响烟叶品质。目前利用生防菌预防烟草赤星病发生并减轻危害的研究已有报道。如DEBORAHE从烟草叶面上分离筛选得到的Bacillus cereus subsp.myeoidei能有效防治烟草赤星病害。罗楚翔等从土壤中分离得到对烟草赤星病菌拮抗作用极强的芽胞杄菌K。李安娜等从烟草叶围和根际分离筛选到B102对烟草赤星病的拮抗作用显著,抑菌带宽度达13mm。
芽胞杆菌(Bacillus spp)作为一种最为常见的生防细菌,含有内生芽孢,具有较好的抗逆能力,生长较快,容易在环境中存活,有利于菌剂的生产运输和储存1,是生物防治的重要菌种。本研究以烟草赤星病为靶标病害,从烟草叶片内分离筛选对烟草赤星病有较好防治效果的芽胞杆菌,并对其生防机制进行探究,以期为该病害生物制剂的开发提供有效的菌种资源,最终能在大田得到推广应用。
1材料与方法
1.1试验材料、时间
烟叶采集自福建、山东、云南等地烟草产区健康烟草植株,烟草赤星病菌株(Alternaria alternata)由贵州烟草科学研究院惠赠。
试验于2019年5月-2020年1月在中国农业大学生物防治与微生态实验室进行。
1.2试验方法
1.2.1活性物质的制备菌液、上清液、菌悬液的制备参考文献[13]
1.2.2菌株的分离分离前对烟草叶片表面进行消毒,将烟叶充分研磨,用灭菌水梯度稀释,稀释液于80℃水浴20min以杀死大部分耐热性差的细菌。水浴后将各个梯度的稀释液吸取100uL涂布于TSA培养基上,挑取生长性状不同的单菌落纯化培养,甘油保存。
1.2.3菌株的筛选(1)促生菌株的筛选将消毒后的烟草种子用菌液(10°CFU/ml)浸泡20min,以无菌培养液为对照,每个处理50粒。放于培养皿中,25℃保湿培养,4d后测出芽率。出苗后用菌液、上清液以及菌悬液进行灌根,无菌培养液作为空白对照。每次间隔7d,并且在最后一次处理7d后测量株高。
(2)防病菌株的筛选利用平板对峙培养法,在生长较好的赤星病菌边缘打取菌,放于PDA培养基中央,28℃培养24h后,在距菌饼2cm处接1L菌液,用无菌培养液作为空白对照,放于28℃培养。当对照长满平板时,观察处理的抑菌效果并计算抑菌率。
采用离体叶片法,将菌液调至10°CFU/mL,均匀喷酒在健康叶片上,无菌培养液作为空白对照,静置4h晾干。在消毒后的发芽盒中放入两张滤纸,用无菌水浸湿,将叶片正面朝上放入,刺伤,接种浓度为2×10°个/mL的赤星病菌孢子悬浮液,尽量避开叶脉,每片接6滴,每滴20L。发芽盒用保鲜膜覆盖扎孔,放置在25℃,人工气候培养箱中培养7d,每日照光16h。观察病害发生情况并记录病害严重程度1。
1.2.4生防菌株的鉴定形态学鉴定:将1.2.3中筛选到的FJl、FJ1-6在LB培养基上活化,于37℃条件下培养至菌落长出。观察单菌落的形态特征,主要包括大小、形状、颜色、光泽度等;摇培菌液用结晶紫染色,观察菌体形态。生理生化鉴定:参考文献[16-17],对菌株进行一系列生理生化测定,确定其分类地位。根据生物学特性测定生防菌株FJ、FJ1-6的生長曲线。分子生物学鉴定:①菌株基因组DNA的提取:蛋白酶SDS法提取。②16SrDNA、grB基因片段的PCR扩增:PCR反应体系(25uL)。③琼脂糖凝胶电泳检测,若条带正确,将PCR产物送往北京擎科新业生物技术有限公司测序(表1)。
1.2.5抑菌物质检测(1)测定代谢粗提物对赤星病菌分生孢子萌发的抑制作用:将浓度为2×10°个/mL的孢子悬浮液和稀释1倍、10倍、100倍的代谢粗提物滤液11混合加入试管中,以无菌培养液为空白对照。28℃培养12h,显微镜下观察孢子萌发情况,以芽管长度超过分生孢子小端直径半为准,每次观察100个分生孢子,并计算抑制率。
抑制率(%)=(对照萌发量-处理萌发量)/对照萌发量×100%
(2)脂肽类抗生素相关基因鉴定:以菌株FJ、FJ1-6的DNA为模板,用引物srfA-F/R、fenA-F/R、fenB-FR、iuA-FR扩增Surfactin、Fengycin、Iturin脂肽类化合物合成相关基因(表2),扩增产物琼脂
糖凝胶电泳检测。PCR反应体系同上。
(3)脂肽类粗提物对赤星病菌的抑制作用:采用脂肽类粗提物涂布法测定粗提物对烟草赤星病菌菌丝生长及产孢的影响。吸取200μL粗提物涂布于PDA培养基,用提取液甲醇为空白对照,中央接赤星病菌併,28℃条件下培养。待CK长满平板时,测量不同处理的菌落直径。显微镜下观察菌丝形态及产孢数量并计算抑制率。
抑制率(%)=(对照生长量-处理生长量)对照生长量×100%
结果
2.1菌株的分离和筛选
从福建、山东和云南等地烟叶内共分离得到187株菌株。经催芽试验检测,得到6株能够显著提高烟草种子出芽率的菌株。进一步经温室生测,发现FJ和FJ1-6两菌株的菌液、上清及菌悬液均能显著促进烟草生长(图1)。其中,菌液的促生效果最好(图2)。将筛选出的6株菌株进行平板抑菌效果检测,发现株菌FJI和FJ1-6对烟草赤星病菌具有显著拮抗效果,抑菌带均在5mm以上(图3)。采用离体叶片法对菌株FJ和FJ-6进行防病效果检测,结果表明,对照发病较为明显,有黄褐色的赤星病斑生成,叶背面病斑明显,直径均在3mm以上(图4)。
2.2生防菌株的鉴定
形态学鉴定(图5):FJ1单菌落扁平为黄白色,表面微微皱起有粘性,中间有一圈凸起,边缘不规则,呈齿状;菌体较小、短杄状。FJ1-6单菌落为浊白色,表面不光滑有粘性,中间有一圈凸起,边缘不整齐;菌体杄状。
生理生化鉴定:根据模式菌株Bacillus subtilis168的主要生理生化性状(表3),并结合文献[16-17]进行检索,发现菌株FJl、FJ-6的生理生化性状与Bacillus subtil一致,而枯草芽胞杆菌的近种有Bacillus amyloliquefaciens,Bacillus licheniformisBacillus atrophaeus,因此还需进一步做分子鉴定。根据生物学特性测定生防菌株FJ1、FJ-6的生长曲线,发现两株菌的生长曲线均符合芽胞菌生长规律(图6)。分子生物学鉴定:对FJl、FJ1-6菌株的16SrDNA、grB基因序列进行测序分析。将拼接序列在NCBI Genbank数据库进行比对,利用MEGA软件建立系统发育进化树,确定菌株的分类学地位。比对结果表明,菌株与Bacillusspp有较高的同源性。但研究报道,16SIDNA仅能将菌株准确定位到属。因此,初步判定2株菌为芽胞菌属(Bacillus spp.)图7)。进一步对2株菌的grB基因进行比对分析发现FJ与Bacillus atrophaeus同源性较高,FJ-6与Bacillus velezensis同源性较高(图8)。综合生理生化及分子生物学分析,确定2株菌的分类学地位:FJ为Bacillusatrophaeus,FJ1-6为Bacillus velezensis。
2.3菌物质检测
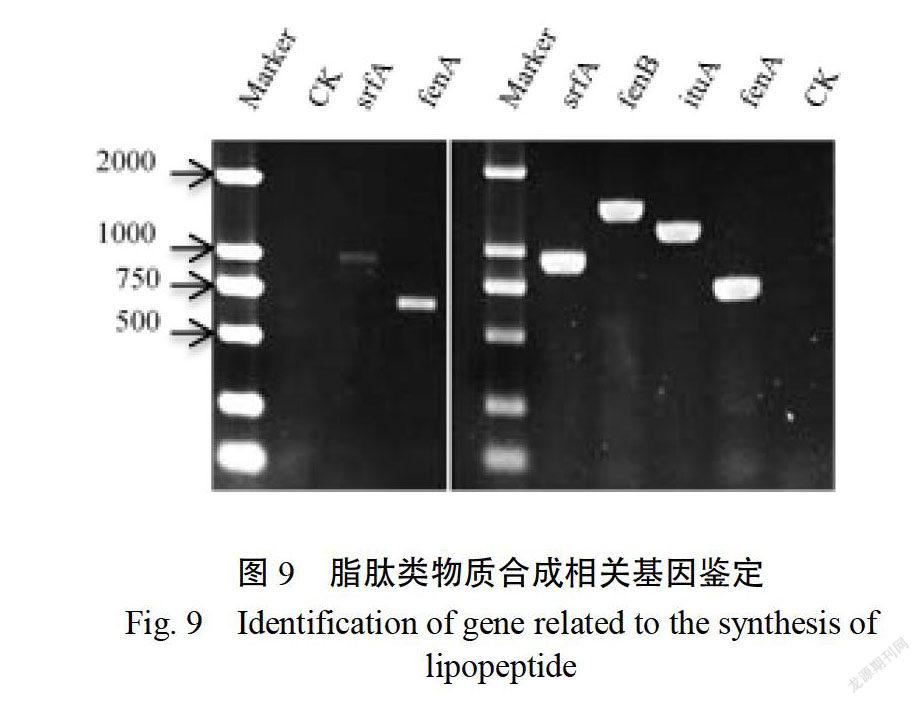
脂肽类物质相关基因鉴定结果表明(图9),芽胞杆菌FJ含有参与抗生素Surfactin和Fengycin合成的基因sr和enA;而芽胞杆菌FJ-6含有参与抗生素Surfactin、Iturin和 Fengycin合成的基因s、i和emAB,可能产生这些基因编码的脂肽。
脂肽类粗提物对赤星病菌的抑制作用结果表明(图10),生防菌FJ1、FJ6脂肽类粗提物对烟草赤星病菌丝有明显的抑制作用,且FJ-6的抑制作用更强,抑制率分别为56.9%、65.0%由图11可看到,经菌株脂肽类粗提物处理过的菌丝与对照相比胞壁加厚、颜色较深、表面粗糙且多为畸形膨大呈念珠状且产孢量明显减少。
代谢粗提物对分生孢子萌发的影响由表4可知菌株FJ和FJ1-6可产生抑制烟草赤星病菌分生孢子萌发的物质,且抑制作用随浓度的升高而增大。
3讨论
目前,已报道的生防菌大多来源于壤。相对于非寄主来源的微生物,内生细菌本就源自寄主可在植物内部与病原菌进行空间、营养竞争,调控植物产生植物激素、抗生素等多种活性物质,抑制病原菌的繁殖,能更好地防治病害,因而内生抗细菌逐渐受到生物防治的青2。易龙等筛选出对烟草赤星病菌(A.alternata)有较强拮抗作用的叶片内生菌株Ib162。周岗泉等2从烟草种子中分离出对青枯雷尔氏菌(Ralstonia solanacearum)防治效果高达95%的内生细菌。本研究针对烟草赤星病,筛选了两株具有防病和促生作用的菌株,研究结果表明筛选的菌株在平板对峙及温室条件下都有良好的防治效果。MARTIN等2报道尽管生防菌有很强的抑制作用,但是环境条件的改变能够影响生防菌对病害的防治效果。生防菌的防治效果还可能受到微生物群落结构的影响。因此,对于所筛选的菌株是否是一株有效的生防菌株,后续还需要在自然环境条件下进行试验验证。
在生物防治中,芽胞杆菌备受大家关注。芽胞杆菌是一类好氧和兼性厌氧菌,是植物微生态中的优势微生物种群,易培养、易保存。此外,芽胞杆菌还可以产生多种具有抗菌活性的代谢物,防病抗逆和定殖能力强,相比之下开发成菌剂更易发挥作用2,许多优良菌株已成功应用于植物病害的生物防治252。本试验从烟草叶片中分离出2株拮抗细菌,经16SIDNA和gB基因序列鉴定为萎缩芽胞杆菌(Batrophaeus)和貝菜斯芽胞杆菌(B.velezensis)。16SIDNA基因序列普遍应用于细菌鉴别或构造细菌的系统发育进化树。但鉴于序列间过高的相似度,此方法难区别亲缘关系接近的菌种,只能初步判定菌株为芽胞杄菌属。近几年研究发现联合mA和grB基因鉴定可以弥补这一缺陷,因此在BLAST对比结果中,挑选了许多基因序列相似性在90%以上的菌株当作分析目标进一步确定菌株FJ1和FJ-6的分类地位。随着分子生物学的发展,越来越多芽胞杆菌完成了全基因组测序,使得芽胞杄菌全基因组信息日益丰富的同时也进一步完善了芽胞菌的分类鉴定方法和标准。已有的文献报道,菌株经过16和生化性状鉴定为Bsbis,后续利用全基因组序列对菌株进行重新鉴定,菌株属于B.amyloliquefaciens2。也有大量的文献报道,同一属中菌株的平均核苷酸一致性低于95%。例如,菌株B.cereusAR156虽然被命名为B.cereus,但是其与其他B.cereus菌株的平均核苷酸一致性低于95%2;在其他属的菌株中也有相关的文献报道,例如Pseudomans virid laval。基于上述的文献报道,本研究虽然结合了生理生化和分子生物学技术进行菌株鉴定,鉴定结果是否准确我们还需要采取深入的分析。
两株芽胞杄菌防治赤星病的机理目前尚不明确,可能和它产生的抗菌物质有关。芽胞杆菌能够产生的脂肽类抗菌物质主要有Iturin、surfactin fengycin三大类。其中,对真菌具有强烈抑制作用的主要是Iturin和fengycin sli Iturin具有抗菌谱广低毒、低残留和低过敏性等特点,其抗菌机制是同时作用于病原菌的细胞壁和细胞膜;而fengycin的作用机理是影响真菌细胞膜的表面张力,导致微孔的形成、K*及其他重要离子的渗透,最后引起细胞死亡。两者都是潜在的具有极大开发应用价值的生物农药。刘邮洲等研究发现萎缩芽胞杄菌YL3的脂肽类粗提物中含有表面活性素和泛革素,具有较好的生防应用潜力。IU等发现贝莱斯芽胞杆菌H3能产生表面活性素,对多种病原菌具有明显的拮抗作用。本研究结果表明菌株FJ和FJ1-6基因组中含有uin和Fengycin合成的基因。但是,我们不能明确断定该菌株一定能够产生这两种类型的脂肽類抗生素。在后续的研究中,应结合基因组学和代谢组学深入解析该菌株中脂肽类抗生素基因簇的组成及代谢物的种类等。进一步明确这几种脂肽类抗生素在防治烟草病害中的作用以及不同抗生素之间对抑制病害的关系。
4结论
本试验筛选出的两株芽胞杆菌FJ(Bacillus atrophaeus)Fj1-6(Bacillus velezensis)不仅能促进烟草的生长与发育,而且对烟草赤星病有较好的防效。菌株产生的次生代谢物可抑制烟草赤星病菌分生孢子的萌发,致使菌丝畸形、产孢量械少从而抑制叶片病斑的扩展;脂肽类抑菌物质对烟草赤星病菌丝生长的抑制率高达65.0%,具有较好的生防应用前景,为烟草赤星病的生物防治提供了新的菌种资源。
参考文献
[1]王佩,欧雅姗,张强,等.烟草赤星病研究进展.安徽农业科学,2018(2):33-36
[2]刘学敏,李大壮.烟草赤星病研究现状及存在问题东北农业大学学报,2000,31(1):80-85
[3]陈杰,李六英,高敏,等.烟草赤星病室内防治药剂筛选及田间防治效果.中国烟草科学,2017,38(1):73-77
[4]朱宇航,黄思洋,陈华保,等烟草赤星病防治药剂的筛选.烟草科技,2019,52(5):14-19
[5] YANG Z, XUE G, DING Y, et al. Effects of tobacco brown spot stress on photosynthesis and osmotic regulation in tobacco cultivars with different resistance [J]. Acta Tabacaria Sinica, 2015, 21(3)82-87
[6] HOU Y, MA X, WAN W, et al. Comparative genomics of pathogens causing brown spot disease of tobacco: alternania longipes and altemaria alternata[]. Plos One, 2016, 11(5): 0155258
[7] JING C, ZHAO J, HAN X, et al. Essential oil of Syringa oblata Lindl. as a potential biocontrol agent against tobacco brown spot caused by Alternaria alternata[J]. Crop Protection, 2018, 104: 41-46
[8] DEBORAH R F, HARVEY WSJ Biocontrol of tobacco brown spot disease by Bacillus cereus subsp Mycoides in a controlled envi-onment]. Phytopathology, 1977(67): 930-932
[9]罗楚翔,彭建,杨欢,等烟草赤星病拮抗芽胞杆菌的筛选及培养基优化中国烟草科学,2014,3(3):50-55
[10]李安娜,金莹,逯鹏,等.抗烟草赤星病芽孢菌B102菌株的筛选及抑菌作用.烟草科技,2008(2):57-60
[11]杨得强,周春发,黄龙伟,等内生芽孢杆菌对植物生长发育及病害防治的研究进展.安徽农业科学,2020(4):114
[12]]姜乾坤,彭阁,王瑞.抗青枯内生细菌的筛选及其对烟草青枯病的防治效果.中国烟草科学,2017,38(5):13-17,31
[13]崔文艳,何朋杰,杨丽娟,等解淀粉芽胞杆菌B9601-Y2对大白菜软腐病防治效果研究.植物保护,2020,46(2):112-116,163
[14]路国兵,冀宪领,张瑶,等.桑树内生细菌的分离及生防益菌的筛选.蚕业科学,2007,33(3):350-354.
[15]张艳军,郭荣.烟草赤星病菌拮抗菌的筛选鉴定及发酵液稳定性分析.浙江师范大学学报(自然科学版),2019,42(2):179-183
[16]蔡妙英,东秀珠.常见细菌系统鉴定手册M北京:科学出版社,2001:370-410.
[17]中国科学院微生物研究所细菌分类组.一般细菌常用鉴定方法[M].北京:科学出版社,1978:11412
[18]张成省,孔凡玉,关小红,等.烟草叶围细菌pb5菌株的鉴定及其抑菌活性[J].中国生物防治,2008,24(1):63-68.
[19]何玲敏,叶建仁.植物内生细菌及其生防作用研究进展[J].南京林业大学学报:自然科学版,2014(6):153-159
[20] WANG, S A, WU, H J, QIAO, JQ, et al. Molecular mechanism of plant growth promotion and induced systemic resistance to tobacco mosaic virus by Bacillus spp. [J]. Journal of Microbiology Biotechnology,2009,19(10):1250-1258.
[21]易龙,肖崇刚,马冠华,等防治烟草赤星病有益内生细菌的筛选及抑菌作用.微生物学报,2004(1):19-22
[22]周岗泉,张建华,陈泽鹏,等.烟草内生细菌及其对烟草青枯病的生物防治研究.中国烟草学报,2008,29(2):31-34
[23] MARTIN, MACAYA-SANZ D, WITZELL J, et al. Strongin vitroantagonism by elm xylem endophytes is not accompanied by temporally stablein plantaprotection against a vascular pathogen under field conditions [J]. European Journal of Plant Pathology, 2015142(1):185-196
[24] ASLANI M A, HARRIGHI B, ABDOLLAHZADEH J Screening of endofungal bacteria isolated from wild growing mushrooms as potential biological control agents against brown blotch and internal stipe necrosis diseases of Agaricus bisporus [J]. Biological Control,2018,119:20-26
[25]李苗苗,張家韬,崔传斌,等三株芽孢杆菌的生防特性研究中国烟草科学,2020,41(4):80-89
[26]李苗苗,王晓强,王东坤,等.生防菌复配对烟草黑胫病的防治效果研究.中国烟草科学,2020,41(2):32-38
[27]陶永梅,潘洪吉,张小利,等.贝菜斯芽胞杆菌NSZ-YBG.JO(01的鉴定及其生物学特性.植物保护学报,2020,47(2):104-11
[28] ARREBOLA, ROMERO. Comparative Genomics Within the Bacillus Genus Reveal the Singularities of Two Robust Bacillus amyloliquefaciens Biocontrol Strains [J]. Molecular Plant-microbe
Interactions, 2015(1): 11-22
[29] ZENG Q, XIE J, LI Y, et al. Comparative genomic and functional analyses of four sequenced Bacillus cereus genomes reveal conservation of genes relevant to plant-growth-promoting traits JI entific Reports, 2018, 8(1): 10-18
[30] SAMAD A, ANTONIELL L, SESSITSCH A, et al. Comparative genome analysis of the vineyard weed endophyte Pseudomonas viridiflava CDRTC14 showing selective herbicidal activity [J]. Rep,2017,7(1):17-36
[31]别小妹,吕风霞,陆兆新,等.Bacillus subtilis fimbj脂肽类抗菌物质的分离和鉴定.生物工程学报,2006(4):644649
ChineseJoumalofBiologicalEngineering,2006(4):644-649
[32] JASIM B, SREELAKSHMI K S, MATHEW J, et al. Surfactin,iturin, and fengycin biosynthesis by endophytic bacillus sp. from bacopa monnieri [J]. Microbial Ecology, 2016, 72(1): 106-119
[33]刘邮洲,陈夕军,梁雪杰,等.一株萎缩芽胞杆菌YL3的鉴定及其脂肽类化合物分析.中国生物防治学报,2017,33(1)142-150
[34] LIU X Y, REN B, CHEN M, et al. Production and characterization of a group of bioemulsifiers from the marine Bacillus velezensis strain
[35]. Applied Microbiology Biotechnology, 2010, 87(5)1881-1893.

