基于CRISPR/Cas9技术的烟草烟碱相关基因敲除及功能研究
冯吉 程玲 蔡长春 孙光伟 孙敬国 杨锦鹏 李建平 陈振国

摘要:CRISPR/Cas9是一种重要的基因组定向编辑技术,近年来在植物基因组的定向敲除和分子育種材料创制中得到了广泛应用。为了发掘可用于分子育种的低烟碱烟草,以烤烟品种K326为试验材料,利用CRISPR/Cas9基因组编辑技术对控制烟草烟碱合成和转运的5个基因(PMT1、QPT、A0622、MNUP1和、JA47)进行定向敲除,并对T2代纯合基因型烟草植株进行烟碱含量检测。结果表明,定向敲除5个基因后获得100株成功编辑的1T0代烟草植株,突变检出率为299%,突变类型以单碱基插入或删除为主。对定向敲除烟碱合成基因P72和转运基因JAT1的T1代纯合基因型烟草植株进行序列分析,发现存在4种突变类型,分别是插入一个T、C、A碱基的插入突变和一个缺失44个碱基的缺失突变,从而引发移码使得翻译的氨基酸链大幅缩短,其T2代植株上部叶烟碱含量显著低于野生型植株。综上所述,CRISPR/Cas9技术能够高效定向敲除烟碱关键基因,为低烟碱烟草分子育种提供了理论和技术支撑。
关键词:基因;编辑技术;突变;烟碱
基因组编辑技术是近年在基因组水平上进行精确修饰的一种技术,该技术可对基因进行定向敲除、敲入、多位点同时突变和小片段的缺失等。与传统的诱变育种相比,通过该技术获得的遗传修饰生物材料与自然界长期进化形成的各类天然多态性个体相比不存在本质区别,且精确性更高、周期更短,最终达到的效果等同于天然诱变、人工诱变和传统杂交导入基因片段。目前美国政府已于2012年批准了首个基因组定向修饰获得的植物材料作为常规品种进行田间评价。
CRISPR/Caso(clustered regularly interspaced shortpalindromic repeats/crispr-associated nuclease 9,Cas)基因组编辑技术是第3代基因编辑技术101],是通过RNA介导由Cas9蛋白实现对目标基因的编辑。因CRISPR/Cas9基因组编辑技术具有设计简便、成本低、编辑效率高、特异性强等诸多优点,已在大量物种中得到了广泛应用171。CRISPR/Cas9技术在烟草研究领域上也有较多应用,2015年高军平等2首次在普通烟草中建立了CRISPR/Cas9技术体系,并对烟草MPDS和NPDR6基因实现了定点突变。
谢小东等2利用CRISPR/Cas9技术获得MPIN4(个腋芽生长相关基因)的烟草突变体,并通过表型验证证实了该基因功能。姚恒等2采用CRISPR/Cas9技术定向敲除烟草Ntppo1基因,并利用实时荧光定量PCR进行验证,结果显示T2突变体中MPO1表达水平比对照显著下降。谢小东等针对烟草5个基因构建了多靶点敲除系统,结果表明CRISPR/Cas9多基因编辑系统可进行有效突变烟草是一种传统的模式植物和重要的经济作物,烟碱含量是影响其经济价值的重要指标之-2因此,本研究采用CRISPR/Cast9基因组编辑技术,对5个控制烟碱含量基因(PMT1、OPT1、A622、NNUP1和.AT,其中PMT、QPT1及A622酶是烟碱合成途径中的重要酶;NNUP1和JAT1则是烟碱转运相关的蛋白2)进行定向敲除研究,并对所获敲除成功的材料进行基因功能研究,为发掘可用于烟草分子育种的烟草材料和烟草功能基因组学研究奠定基础。
1材料与方法
1.1试验材料和种植地点
本研究选用烤烟品种K326为试验材料。K326无菌苗培养于湖北省烟草科学研究院的组织培养室;K326转化植株种植在利川烤烟基地和海南三亚冬繁基地。
表达载体:pORE-Cas9/gRNA,由西南大学提供。主要的试剂:2xpower Tag PCR Mastermix和植物DNA提取试剂盒购自北京百泰克生物技术有限公司;大肠杆菌DH5q感受态细胞、农杆菌GV3101、限制性内切酶BsaI、DNAMarker、T4连接酶、头孢和卡那霉素购自北京博迈德基因技术有限公司;引物由北京天一辉远生物科技有限公司合成;PCR产物测序由武汉擎科创新生物科技有限公司完成。主要仪器:PCR仪,akaraTP600(日本);凝胶自动成像仪,MS-UVCI(美国);核酸蛋白测定仪,伯乐smartspecplus(美国)。
1.2试验方法
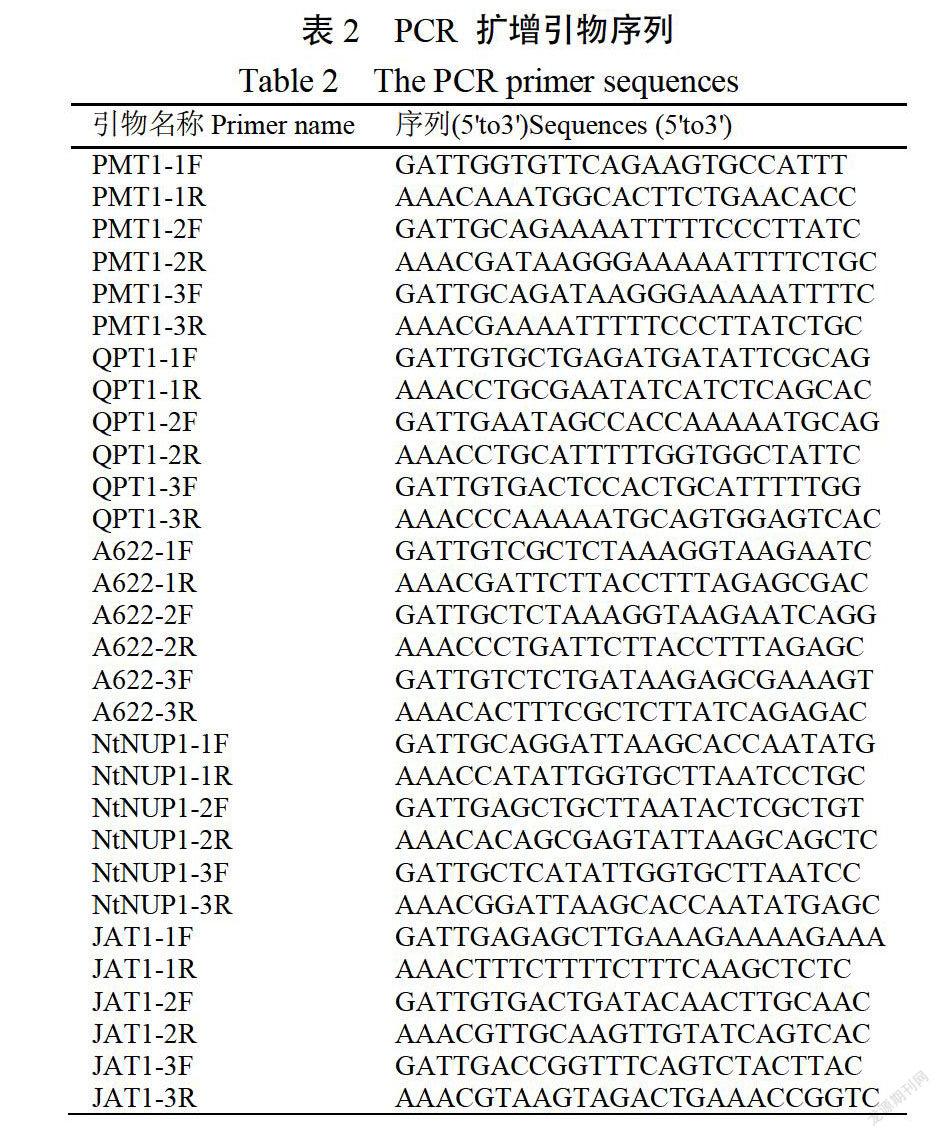
1.2.1SGRNA((singleguideRNA)设计利用中国烟草基因组数据库中PMT(AFI26810)、QP77(AJ748262)、A622(ABO71165)、NTNUP1(GU174267)和、JAT1(AM991692)基因的cDNA和genomicDNA序列,通过在线工具CRISPR Multitargeter(http://www.multicrisprnet/index.html)501设计了15个CRISPR/Cas9敲除的SGRNA寡聚核苷酸序列(表1)。
1.2.2基因敲除靶位点的cDNA引物设计根据
15个SGRNA序列(表1),设计了15对可扩增SGRNA序列的CDNA片段引物对(表2)。设计要求:引物的合成不需要PAM区(NGG);不是以G开始的要加G;序列的反向互补;之后分别在上游引物和下游引物的开头添加GAT和AAAC序列(可与BsaI酶切表达载体形成的粘性末端互补)。
1.2.3载体构建以设计好的靶位点序列作为正向引物,其反向互补序列作为反向引物,与经Bsal酶切pORE-Cas9SGRNA表达载体形成的黏性末端互补。靶位点序列通过T4连接酶连接到表达载体上后,将DH5a感受态细胞加入连接产物中,使连接产物转化到DH5q感受态细胞中。最后挑取单克隆作为模板,以载体上的引物JC-F(5TTAGGTTTACCCGCCAATA3)和靶位点的下游引物(表2)PCR扩增和验证。PCR反应程序为:94℃10min;94C40s,53C40s,72C30s,30个循环;72℃10min;4℃下保存。
1.2.4农杆菌介导的烟草叶盘转化和愈伤组织的筛选利用电转法将重组编辑载体转入农杆菌GV3101。在超净工作臺中将烟草无菌苗的成熟叶片切成1.0cm2左右的叶盘,然后将叶盘浸泡在携带质粒的农杆菌GV3101菌液中。农杄菌侵染10min后,以叶盘上表面平铺于MS固体培养基上,放入28℃培养箱中黑暗条件下共培养48h。然后再将叶盘上表面平铺于愈伤分化培养基上,在12h光照/12h黑暗条件组培室内培养,约1个月后可以看到叶盘边缘出现白色或绿色膨大的愈伤组织。待愈伤组织长出绿芽后,切下绿芽(1~2cm高)并转入MS固体培养基生根,1个月后可移栽到土里2121.2.5烟草阳性苗检测和目标基因检测烟草阳性苗的检测:采取CTAB法提取烟草叶片总DNAP。根据载体中所包含的抗卡那霉素基因为目标开发出特异引物对NPTI(左引物5CGTTGTCACTGAAGCGGGAAGG3;右引物5GAGCGGCGATACCGTAAAGCAC3)。以烟草株系叶片的基因组DNA为模板,PCR扩增含有靶位点的片段,PCR扩增产物均用1.0%的琼脂糖凝胶电泳检测分析确定是否为阳性苗。
目标基因检测:利用Primer5.0软件在目标基因的目标区域设计引物。以烟草叶片的基因组DNA为模板,PCR扩增目标区域的序列片段,PCR扩增产物送测序,分析目标基因是否被基因编辑成功。
烟草烟碱检测和数据分析:将烤后烟样取3份,每份15~20片,送湖北省烟草科学研究院进行烟碱含量检测。烟碱含量检测采用气相色谱法进行检测。
1.3数据分析
所有试验数据均通过Microsoft Ofiice Excel2010和SPSS19.0软件进行统计分析,多重比较采用Duncan法。
2结果
2.1阳性克隆检测
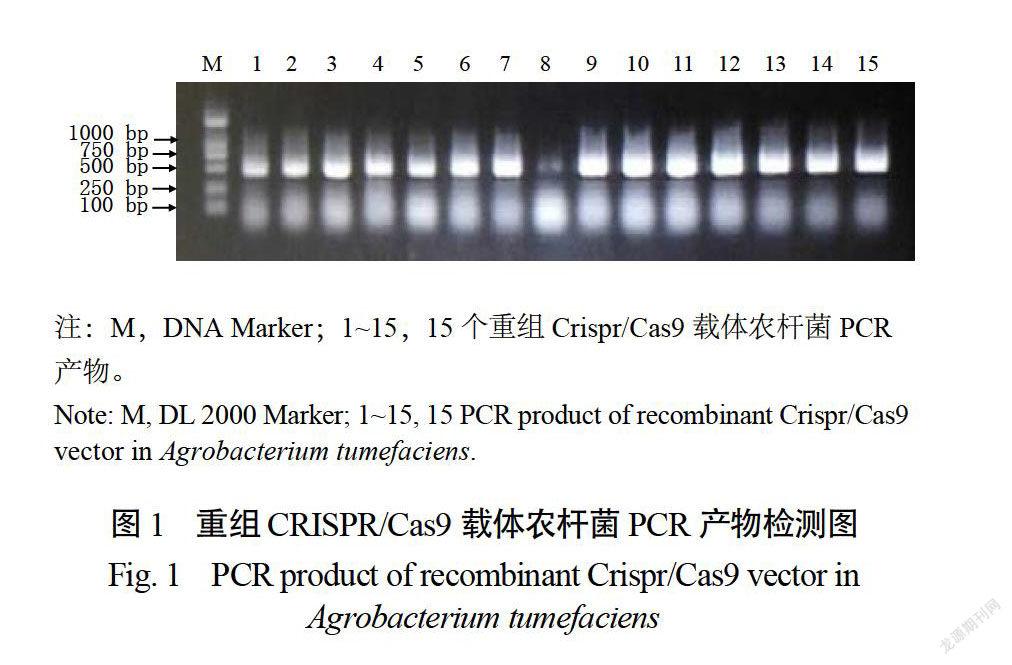
通过载体构建,总共获得15个载体。对经过卡那霉素筛选的15个单菌落进行菌落PCR检测验证,所用引物为JC-F和15个SGRNA的反向序列(表2)。如图1所示,得到预期450bp左右大小的整齐清晰的目标带型,结果表明重组CRISPR/Cas9载体质粒已成功转入农杆菌GV3101菌株内,可用于下一步遗传转化试验。
2.2烟草T0代阳性苗的种植和检测
在组织培养实验室,待幼苗长至3-5片叶时,进行取样提取烟草基因组DNA,以特异引物对NPTⅡ(目标基因为抗卡那霉素基因)进行PCR扩增,检测部分结果如图2。结果显示,1205株烟草再生植株中(包含所有15个转化载体)有751株是T0代阳性苗,每个载体获得转化阳性苗有30-70株不等,阳性率达到62%,说明转化试验成功率较高。2016年5月中上旬将751株中的460株T0代阳性转化苗(包含所有15个转化载体)从组织培养实验室移栽到利川烤烟基地。最终在烤烟基地只有334株1T0代烟草阳性植株存活(PMT基因:116株;OP7l基因:44株;A62基因:67株;MNUP1基因:59株;JAT基因:48株),存活率为72.6%(表3)。
对存活的34株烟草阳性植株(包含所有1个转化载体)进行取样,然后通过PCR和测序技术对目标基因进行检测(表4),获得100株成功编辑(即目标基因发生突变)的T0代烟草植株,突变检出率为299%(100334)。对于PMT1、A622和JA基因,3个靶位点中只有1个靶位点检测到成功编辑的植株(PMT基因:51.7%,0,0;A622基因:0,0,609%;JAT1基因:96%,0,0),这可能发生了脱靶现象或是检测的样本数量不够多。对于QPT2和MNUP1基因,3个靶位点都检测到成功编辑的植株,但同一个基因不同靶位点间的突变检出率却有巨大的差异(QPT71基因:5%,667%,583%;MNUP基因:92%,43.5%,27.3%)。同时测序结果分析还显示(表5),5个基因在靶位点处发生了多种形式的突变,包括在不同位点处的单碱基插入或删除、多碱基替换和大片段缺失(10碱基以上)。PMT和QPT两个基因的碱基突变类型主要以单碱基插入或删除为主(占总突变类型的50%以上),其次是多碱基替换。A62和NTNUPI两个基因的碱基突变类型主要以多碱基替换为主(占总突变类型的50%以上),其次是単碱基插入或删除。T基因的碱基突变类型主要以单碱基插入或删除为主(占总突变类型的70%以上),其次是大片段缺失(10碱基以上),最少的是多碱基替换。
对成功编辑的100株T0代烟草植株目标基因序列进行分析,发现基因靶位点SGRNA-PAM之后的序列出现双峰,说明Cas9蛋白在切断靶位点序列后,每条DNA修复的情况不一样,导致成功编辑的100株T0代烟草植株中突变型和野生型基因序列同时存在,即为嵌合体或杂合型植株。因此将这成功编辑的100株T0代烟草植株经自交后产生T1代烟草种子,用于下一步的纯合型突变体筛选。
2.3烟草T1代植株种植和检测
2016年10月中上旬从100份T1代种子中选取6份在海南三亚基地冬繁(只包含OP7基因靶位点2的突变植株和AT基因靶位点1的突变植株,每个基因3份材料),每个T1代株系种植20个单株,总共120株。最终在海南三亚基地只有99株T1代烟草植株存活(QPTl基因,40株;JA77基因:59株),存活率为82.5%。通过PCR扩增和测序,对99株T1代烟草植株的目标基因进行检测分析,其中55株成功编辑(OPT基因13株;JAT7基因42株),突变检出率为55.6%。55株T1代烟草植株中,纯合基因型有15株(QP7基因5株;T基因10株);杂合基因型有40株(OPT基因8株;JHAT基因32株)。
对15株纯合基因型T1代烟草植株的测序结果进行分析(图3),结果显示,QPT基因在靶位点处发生了2种类型的突变(图3A,基因检测引物对:左引物5I'GCAATTACAGCTTCCAAGGT.3';右引物5GCGCGAATCTGGATAGTTG3),一种是单碱基的插入(突变体Q1;插入一个T碱基),一种是单碱基的插入以及单碱基替换(突变体Q2;插入一个C碱基,T碱基替换为G碱基)。JAT1基因在靶位点处发生了2种类型的突变(图3C,基因检测引物对:左引物5GACAAGACAAGCCAACAAG3';右引物5AACACTGTGACCGCTACCAT3”),一种是单碱基的插入(突变体J1;插入一个A碱基),一种是44个碱基的缺失(突变体J2)。对这4种突变株系的编码蛋白氨基酸序列进行预测比对分析(图3B和D),由于插入单个碱基或44个碱基的缺失,引发移码致使提前遇到终止密码子,使得翻译的氨基酸链大幅缩短。因此,将这4种纯合基因型T1代烟草植株自交收种,获得T2代烟草种子用于功能验证试验。
2.4烟草T2代植株基因功能验证
2017年5月中上句将这4种纯合基因型T2代烟草植株(Q1,Q2,J1和J2)种植在利川烤烟基地,每个株系种植120个单株,以进行功能验证。结果显示(图4),正常生长条件下,这4种纯合基因型T2代烟草植株与野生型植株表型上无显著性差异。但通过检测上部烤后烟叶烟碱发现,突变体Q1与Q2,或J1与J2上部烟叶烟碱含量相比较未达到显著性差异;而突变体Q1和Q2与J1和J2相比较,Q1和Q2上部烟叶烟碱含量显著低于J和J2;同时突变体Q1,Q2,J和J2上部烟叶烟碱含量显著低于野生型植株上部烟叶烟碱含量。该结果表明利用CRISPR/Cas9基因编辑技术创制的OPT突变体和JA7突变体是成功的,烟碱合成基因OP77和烟碱转运基因AT能够显著影响烟叶中烟碱的积累。
3讨论
自从2013年CRISPR/Cas9基因组编辑技术首次应用于真核生物以后,已在各植物研究中进行了广泛的应用。2015年高军平等2首次在普通烟草中建立了CRISPR/Cas9技术体系,随后该技术在烟草各种性状研究中进行了探索和应用。本研究直接将该技术应用于烟草烟碱研究中并最终获得4种低烟碱纯合基因型2代烟草植株,该研究结果有助于烟草烟碱硏究和低烟碱分子育种的深入开展。
利用CRISPR/Cas9基因组编辑技术,对控制烟草烟碱合成和转运的5个基因进行基因编辑,获得100株成功编辑的烟草T0代植株,其中突变类型为单碱基插入或删除所占比例最大(50%以上),与之前研究结果基本一致29-30。对于PMT1、A622和J基因,发现有2个靶位点未检测到成功编辑的植株,可能发生了脱靶现象。造成脱靶现象的主要因素可能是SGRNA引起的错配或PAM序列引起的错配导致了脱靶,因此通过提高SORNA的特异性、改造Cas9蛋白或者降低Cas9和SGRNA在植物中的表达水平可以有效降低脱靶现象的发生51-3。然而在植物研究中脱靶并不是一个特别关注的问题,因为脱靶造成的其他基因序列的突变微不足道,其突变纯合或杂合后代也没发现进一步突变产生。而且即使发生了非特异性的定点突变,也可通过回交的方法将非特异性的定点突变进行回复2。对于OPT2和MNUP1基因,发现同一个基因不同靶位点间的突变检出率有巨大的差异,可能是SGRNA序列中靠近PAM区的第8至12个碱基之间的差异性对Cas9蛋白剪切精确性的影响造成的。还可能是一个靶位点在正向链上而另一个是在互补链上造成的2,比如QP7基因靶位点1在正向链上,靶位点3在互补链上,它们之间的突变检出率相差有10倍多。
通过检测野生型和4种纯合基因型T2代烟草植株烘烤后上部烟叶烟碱含量,发现突变体J和J2与Q1和Q2相比较,J和J2上部烟叶烟碱含量显著高于Q1和Q2。可能是因为烟碱转运蛋白JAT1与NTMATE1/2之间有部分功能相似度2,当突变体J1和J2中.MATl基因功能丧失后NTMATE1/2基因可替代其部分功能;也可能是烟碱合成基因OP7的功能对烟叶烟碱的影响大于烟碱转运基因JAT12。同时突变体Q1,Q2,J1和J2上部烟叶烟碱显著低于野生型植株相应部位烟叶烟碱,说明单个烟碱合成基因和烟碱转运基因功能丧失后能够显著影响烟叶烟碱的积累。由于本研究中普通栽培烟草是异源四倍体,在进化史上经历过多倍化的过程,绝大部分基因都有多个拷贝9733,因此单独敲除一个烟碱合成基因或烟碱转运基因后,可能会由其他拷贝基因在功能上互补,造成突变体烟草植株烟碱含量显著降低但不会降低到趋近为零;所以在后续烟草烟碱研究中,还需要利用CRISPR/Cast9介导烟草多基因编辑技术,创制出多基因突变体,才能更全面地研究烟草烟碱相关基因功能。
4结论
本研究利用CRISPR/Cas9基因组编辑技术对控制烟草烟碱合成和转运的5个基因进行了定向敲除,最终成功获得4种低烟碱纯合基因型T2代烟草植株并进行了功能研究。结果表明利用CRISPR/Cas9基因编辑技术创制的OP7突变体和T突变体的上部烟叶烟碱含量显著降低,且烟碱合成基因QPT对烟碱的影响大于烟碱转运基因JT,该结果为后续低烟碱烟草分子育种奠定了材料基础。虽然本研究中CRISPR/Cas9基因组编辑技术展示出简单、高效的优势,但该技术的脱靶问题和多拷贝基因靶位点设计问题目前尚未得到彻底解决。因此在未来的研究中应对CRISPR/Cas9基因组编辑技术进行相应改进,使该技术具有更为广阔的应用前景。
参考文献
[1]王维佳,李萌鑫.基因编辑技术在农业育种中的应用.安徽农业科学,2020,48(3):18-25
[2]王艳芳,苏婉玉,曹绍玉,等,新型基因编辑技术发展及在植物育种中的应用[J].西北农业学报,2018,27(5):617-625
[3]时欢,林玉玲,赖钟雄,等.CRISPR/Cas9介导的植物基因编辑技术研究进展[J].应用与环境生物学报,2018,24(3):640-650
[4]杨炳忻.香山科学会议第491-495次学术讨论会简述中国基础科学,2014
[5]王福军,趙开军.基因组编辑技术应用于作物遗传改良的进展与
挑战[J].中国农业科学,2018,51(1):1-16
[6]沈平,章秋艳,杨立桃,等.基因组编辑技术及其安全管理[J].中国农业科学,2017,50(8):1361-1369
[7]景润春,卢洪CRISPR/Case9基因组定向编辑技术的发展与在作
物遗传育种中的应用.中国农业科学,2016,49(7):1219-129
[8]解莉楠,宋凤艳,张旸.CRISPR/Cas9系统在植物基因组定点编辑中的研究进展.中国农业科学,2015,48(9):169-1677
[9]韩红兵,谢卡斌,曹罡,等,基因编辑技术在农业种质资源上的应用.中国工程科学,2018,20(6):82-86
[10] CONG L, RAN F A, COX D, et al. Multiplex genome engineering using CRISPR/Cas systems [J]. Science, 2013, 339: 819-823
[11]JIANG W Y, BIKARD D, COX D, et al. Rna-guided editing bacterial genomes using CRISPR-CAS system]. Nature Biotechnology, 2013, 31: 233-239
[12] PICKAR-OLIVER A, GERSBACH C A. The next generation CRISPR-CAS technologies and applications [J]. Nature Reviews Molecular Cell Biology, 2019, 20(8): 490-507
[13] BHAYA D, DAVISON M, BARRANGOU R CRISPR-CAS systems bacteria and archaea: versatile small RNAS for adaptive defenseand regulation [J]. Annual Review of Genetics, 2011: 45: 273-297
[14] WIEDENHEFT B, STERNBERG SH, DOUDNA J A. Rna-guided genetic silencing systems in bacteria and archaea [J]. Nature, 2012482:331-338
[15] SHEN B, ZHANG J, WU H Y, et al. Generation of gene-modified mice via Caso/Rna-mediated gene targeting [J]. Cell Research, 201323(5):720-723
[16] HSU P D, SCOTT D A, WEINSTEIN J A, et al. DNA targeting specificity of Rna-guided as9 nucleases J]. Nature Biotechnology,2013,31(9):827-832
[17] SHI JW, WANG E, MILAZZO J P, et al. Discovery of cancer drug targets by CRISPR-CAS screening of protein domains [J]. Nature Biotechnology, 2015, 33(6): 661-667
[18] LI J F, NORVILLE J E, AACH J, et al. Multiplex and homologous recombination -mediated genome editing in Arabidopsis and Nicotiana benthamiana using guide RNA and Cas9 [J]. Nature Biotechnology, 2013, 31: 688-691
[19] GIFFORD C A, RANADE S S, SAMARAKOON R, et al Oligogenic inheritance of a human heart disease involving a genetimodifier[J]. Science,2019,364(6443):865-870
[20] GAO J P, WANG G H, MA S Y, et al. CRISPR/Cas9-mediated targeted mutagenesis in Nicotiana tabacu[M]. Plant Molecular Biology,2015,87:99-110
[21] XIE X, QIN G, SI P, et al. Analysis of Nicotiana tabacum PIN genes identifies NIP/N4 as a key regulator of axillary bud growth Physiologia Plantarum, 2017, 160(2): 222-239
[22]姚恒,白戈,谢贺,等,利用CRISPR-Cas9技术创制烟草Vtabmxc2基因的定点突变.分子植物育种,2017,15(6):2328-2334.
[23]谢小东,高军平,李泽锋,等.CRISPR(Cas9介导烟草多基因编辑体系的应用.中国烟草学报,2019,25(4):72-80
[24]王威威,席飛虎,杨少峰,等.烟草烟碱合成代谢调控研究进展.亚热帯农业研究,2016,12(1):62-67
[25]张洪博.烟草重要基因篇:3.烟草烟碱合成代谢相关基因[J].中国烟草科学,2014,35(3):117-120
[26]金云峰,李军营,张建波,等.烟草烟碱代谢的生化和分子机制及其调控.基因组学与应用生物学,2015,34(4):882-891
[27]张晓颖烟草侧分生组织形成相关基因(lasb,rev)的基因编辑及功能研究[D]重庆:西南大学,2018.
[28]李宗平,覃光炯,陈茂胜,等.不同栽培方式对白肋烟烟碱转化率及TSNA含量的影响[J].中国烟草科学,2015,36(60):62-67
[29] JINEK M, CHYLINSKI K, FONFARA I, et al. A programmable dual-rna-guided DNA endonuclease in adaptive bacterial Immunity{[J]. Science,2012,337(60960):816-821
[30] MA X L, ZHANG Q Y, ZHU Q L, et al. A robust CRISPR/Cas9 system for convenient, high-efficiency multiplex genome editing inmonocot and dicot plants [J]. Molecular Plant, 2015, 8(8): 1274-1284
[31]BI TSAI S Q, ZHENG Z, NGUYEN N T, et al. GUIDE-SEQ enables genome-wide profiling of off-target cleavage by CRISPR-CASnucleases J]. Nature Biotechnology, 2015, 33(2): 187-197
[32] LABUHN M, ADAMS FF, NG M, et al. Refined SGRNA efficac prediction improves large- and small-scale CRISPR-CAS9applications [J]. Nucleic Acids Research, 2018, 46(3): 1375-1385
[33] SHEN B, ZHANG W S, ZHANG J, et al. Efficient genome modification by CRISPR-CAS9 nickase with minimal off-targeteffects[J]. Nature Methods, 2014, 11(4): 399-402
[34] PATTANAYAK V, LIN S, GUILINGER J P, et al. High-throughput profiling of off-target DNA cleavage reveals Rna-programmee Cas9 nuclease specificity J). Nature Biotechnology, 2013, 31(9)839-843
[35] FENG Z Y, MAO Y F, XU N F, et al. Multigeneration analysis reveals the inheritance, specificity, and patterns of Crisprcas-induced gene modifications in Arabidopsis [J]. Proc Nat.Acad.Scl.USA,2014,111(12):4632-4637
[36] CONG L, RAN F A, COX D, et al. Multiplex genome engineerin using CRISPR/Cas systems J]. Science, 2013, 339(6121): 819-823
[37]仁剛,蔡刘体,任学良.烟属起源与分子系统进化的研究进展
贵州农业科学,2011,39(1):1-8
[38]杨垚,张艳,党江波,等.以子房为材料制备烟草染色体标本的方法.中国烟草科学,2019,40(4):56-61

